多组学联合分析神经胶质瘤中SOX4表达差异及临床意义*
王 浩,周 权,葛娟娟,2,赵 元,胡美纯,朱 薿**
(1.湖北科技学院医学部基础医学院,湖北 咸宁 437100;2.湖北科技学院医学部药学院;3.湖北科技学院医学部生物医学工程与医学影像学院)
神经胶质瘤(glioma)是中枢神经系统恶性原发性肿瘤,对数百万人健康造成严重威胁[1]。目前胶质瘤可通过外科手术、放疗和化疗治疗[2],然而接受治疗的患者中位数存活期仅有15个月,预后较差[3]。由此,早期诊断和寻找预后标志物对于提高患者存活率和开发新治疗手段至关重要。SOX4是SOX(SRY-related HMG-box)转录因子C组家族成员,在肿瘤增殖、迁移和侵袭中发挥重要作用[4-5]。但是SOX4对胶质瘤的诊断和预后的作用价值尚无系统研究。本研究联合多组学数据,从DNA、mRNA水平分析SOX4在恶性胶质瘤(glioblastoma multiforme,GBM)和低级别胶质瘤(low-grade glioma,LGG)中的表达差异;探讨SOX4表达与GBM和LGG肿瘤发生相关通路、免疫细胞浸润、基因突变和DNA甲基化的相关性;评估SOX4对GBM和LGG的诊断和预后价值,为今后基于SOX4分子的临床运用和靶向药物开发奠定基础。
1 材料与方法
1.1 数据下载及数据预处理
从TCGA(https://www.portal.gdc.cancer.gov)数据库和GTEx(https://gtexportal.org/home/datasets)数据库中下载GBM和LGG表达谱数据。纳入本次研究的GBM样本包括TCGA数据库166例癌组织样本和5例癌旁组织、GTEx数据库1152例正常组织样本;LGG样本包括TCGA数据库523例癌组织样本、GTEx数据库1152例正常组织样本。本研究所有数据均来源于TCGA和GTEx公共数据库,因此,无需伦理批准及签署知情同意书。
1.2 SOX4基因在GBM和LGG中的表达
通过R软件(R software,version 4.0.0)收集GBM和LGG中HTSeq-FTPM格式的RNAseq数据并进行log2转化,表达差异数据运用R软件ggplots2包进行可视化。从单细胞数据库scTIME Portal(scTIME.sklehabc.com)中提取GSE131928数据信息,分析SOX4在胶质瘤组织各类细胞中的表达情况。
1.3 SOX4共表达基因筛选
根据SOX4基因表达中位数分别将GBM和LGG分为高SOX4组和低SOX4组,运用R软件DESeq2(1.26.0)包[6],以|log2(FC)|>1.5和adj.p value <0.05为条件,筛选SOX4共表达差异基因。用R软件ggplot2包绘制火山图、热图和韦恩图。
1.4 SOX4共表达基因功能富集分析
通过R软件ClusterProfiler(3.14.3)[7]包对SOX4共表达基因分别进行Gene ontology(GO)和通路Kyoto Encyclopedia of Genes and Genomes(KEGG)富集分析,以adj.p value<0.05表示差异有统计学意义。同样使用R软件ClusterProfiler包对基因表达矩阵进行GSEA分析,False discovery rate(FDR)<0.25且P<0.05具有显著富集。以adj.p value和标准化富集分数(normalized enrichment scores,NES)筛选GBM和LGG的TOP10通路。
1.5 SOX4相关蛋白与蛋白互作网络
STRING(https://string-db.org/)数据库对数据集中SOX4共表达基因进行蛋白质-蛋白质互作网络(protein interaction network,PPI)构建,并且利用Cytoscape(3.8.0)[8]中MCODE插件获取Top10关键基因(Hub gene)。
1.6 SOX4基因突变
通过cBioPortal(http://cbioportal.org)数据库对GBM数据集Glioblastoma(CPTAC,Cell2021)、Glioblastoma(Columbia,Nat Med.2019)、Glioblastoma Multiforme(TCGA,Firehose,Legacy)及LGG数据集Brain Lower Grade Glioma(TCGA,Firehose Legacy)、Low-Grade(UCSF,Science2014)中SOX4基因突变信息。
1.7 SOX4 DNA甲基化分析
MethSurv(https://biit.cs.ut.ee/methsurv/)是基于TCGA集中的450K数据构建的可视化分析工具。从MethSurv数据库中分别选择“GBM”和“LGG”,在“gene search”中输入“SOX4”,分析SOX4基因甲基化水平及其与预后的相关性。
1.8 免疫细胞浸润分析
24种免疫细胞的标记物是从Bindea及其同事的研究中提取的[9]。采用ssGSEA算法分析GBM和LGG中肿瘤24种免疫细胞的浸润情况,采用Spearman相关分析SOX4与这24种免疫细胞的相关性。
1.9 统计学方法
所有统计分析均采用R(4.0.0)软件。使用t检验分析不同组织中SOX4的表达差异。Receiver operating characteristic curve(ROC)法分析SOX4对GBM和LGG的临床诊断价值。采用Kaplan-Meier(KM)方法和单因素及多因素COX回归分析SOX4的临床意义与预后(总生存率,Over survival,OS)的相关性。P<0.05被认为差异具有统计学意义。
2 结 果
2.1 SOX4在胶质瘤组织中高表达及其临床诊断价值
分析TCGA和GTEx数据库中收集的多种肿瘤和对应正常组织中SOX4 mRNA表达量。与正常组织相比较,SOX4 mRNA在GBM、LGG、ACC、CHOL、LIHC、KIRP、LUAD等多种肿瘤组织中差异表达(图1A)。在GBM(图1B)和LGG(图1C)肿瘤组织中SOX4 mRNA水平显著高于癌旁组织。单细胞测序分析发现胶质瘤组织主要含有Macrophage、Malignant、Oligodendrocyte、T cell等类型细胞(图1D),其中SOX4主要在胶质瘤Malignant肿瘤细胞中表达(图1E)。
进一步分析不同临床特征胶质瘤患者中SOX4表达差异,结果发现GBM患者中SOX4表达与年龄无相关性(图1F),但SOX4在IDHMut GBM组织中的表达显著高于IDH WT者(图1G,P<0.05)。LGG中,年龄低于40岁的LGG患者组织中SOX4 mRNA表达显著高于40岁以上的患者(图1I,P<0.05)。SOX4在IDHMut LGG组织中的表达显著高于IDH WT者(图1J,P<0.05)。ROC分析发现SOX4在GBM中AUC=0.976,95%CI为0.969~0.987(图1H);在LGG中的AUC=0.985,95%CI为0.979~0.991(图1K),提示SOX4表达可能用于辅助诊断GBM和LGG。

A.TCGA和GETx数据库泛癌肿瘤组织和癌旁组织样本中SOX4 mRNA差异表达;B-C.TCGA和GETx数据库GBM(B)和LGG(C)样本中SOX4的差异表达;D-E.单细胞测序分析SOX4在不同胶质母瘤种类细胞中表达情况;F-H.SOX4表达与GBM患者中年龄(F)、IDH 状态(G)相关性和诊断价值(H);I-K.SOX4表达与LGG患者中年龄(I)、IDH 状态(J)相关性和诊断价值(K)
2.2 胶质瘤中SOX4功能富集分析
为了发现SOX4与共表达基因相关性,我们随后筛选了SOX4共表达基因。结果发现GBM患者中SOX4共表达基因有250个上调和93个下调(图2A、B);LGG中有9个基因上调和380个基因下调(图2C、D)。对GBM和LGG中SOX4共表达差异基因取交集,结果发现37个同时在GBM和LGG中共表达的差异基因(图2E)。GO功能富集分析发现37个差异基因主要与long-chain fatty acid transport,endocytic vesicle lumen,calcium-dependent phospholipase A2 activity等生物学现象有关(图2F~H)。KEGG结果显示这37个差异基因主要富集于Arachidonic acid metabolism,Glycerophospholipid metabolism,Pancreatic secretion等通路(图2I)。GSEA富集结果显示这些共表达基因在GBM中主要与神经脊分化、胰岛素分泌、炎症反应等途径有关(图2J)。LGG中这些共表达基因主要与有丝分裂合成、DNA的修复、免疫反应等多种相关途径有关(图2K)。
2.3 胶质瘤中SOX4相关蛋白互作网络
通过STRING数据库对筛选的37个共表达基因进行PPI分析(图2L),设定相互作用阈值为0.15,结果发现该蛋白互作网络图包含37个节点,45个边,节点的平均度值2.43。使用Cytoscape软件对该网络图进行可视化展示(图2M),并筛选Top10关键基因(图2N)。
2.4 胶质瘤中SOX4基因突变差异
为了解SOX4在胶质瘤组织中是否存在基因突变或拷贝数扩增等基因改变,我们通过cBioPortal(http://cbioportal.org)数据库分析发现SOX4在GBM中基因发生突变、增加的频率分别为0.14%和0.29%(图2O);760例GBM患者的13个样本中SOX4发生改变,SOX4在GBM的突变率为0.4%(图2P)。LGG中SOX4基因发生突变、增加、缺失的频率分别为0.35%、0.87%和0.17%(图2Q);591例LGG患者中52个样本的SOX4发生改变,SOX4在LGG的突变率为1.5%(图2R)。
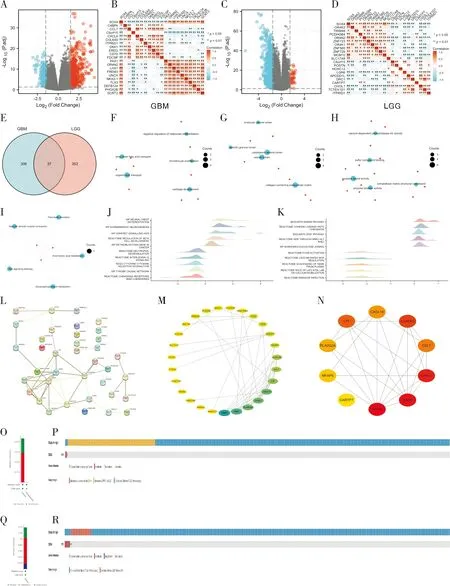
A-B.GBM中SOX4共表达差异基因火山图(A)、SOX4中TOP20共表达差异基因热图(B);C-D.LGG中SOX4共表达差异基因火山图(C)、SOX4中TOP20共表达差异基因热图(D);E.SOX4共表达基因韦恩图;F~H.GO分析共表达基因富集BP(F)、CC(G)MF(H)可视化网络;I.KEGG富集分析可视化网络;J-K.GSEA富集分析GBM(J)和LGG(K)中SOX4表达差异基因功能;L.STRING分析SOX4蛋白互作网络;M.Cytoscape软件分析SOX4蛋白互作网络;N.Cytoscape软件分析TOP10 SOX4蛋白互作关键基因;O-P.SOX4在GBM基因突变分析;Q-R.SOX4在LGG中基因突变分析
2.5 SOX4 DNA甲基化水平及其与预后相关性
通过MethSurv数据库分析GBM和LGG中SOX4 DNA甲基化水平。结果显示,GBM样本中有18个SOX4 DNA甲基化水平发生改变(图3A),COX回归和KM分析发现Cg22274825、Cg08625851和Cg00792966位点DNA甲基化与GBM预后密切相关(图3B~E,P<0.05)。LGG样本中有18个SOX4 DNA甲基化水平发生改变(图3F),其中Cg22274825、Cg23780597、Cg08625851位点DNA甲基化与LGG预后密切相关(图3G-H,P<0.05)。

A.GBM中SOX4 DNA甲基化位点变化热图;B.COX回归分析SOX4 DNA甲基化位点与GBM预后的相关性(森林图);C-F.KM曲线比较高低Cg22274825(C)、Cg08625851(D)和Cg00792966(E)位点DNA甲基化水平GBM患者总生存率;F.LGG中SOX4 DNA甲基化位点变化热图;G.COX回归分析SOX4 DNA甲基化位点与LGG预后的相关性(森林图);H-J.KM曲线比较高低Cg22274825(H)、Cg08625851(I)和Cg23780597(J)位点DNA甲基化水平GBM患者总生存率
2.6 SOX4与胶质瘤免疫细胞浸润的相关性
采用ssGSEA分析SOX4与多种肿瘤免疫细胞浸润的相关性(图4A),还分析SOX4与GBM(图4B)和LGG(图4C)中24种免疫细胞的相关性。Spearman相关性分析发现,与SOX4相关程度TOP5的GBM免疫细胞为Th2 cells(图4D)、Tgd(图4E)、Tcm(图4F)、TFH(图4G)、T helper cells(图4H)。与SOX4密切相关TOP5的LGG免疫细胞为Tgd(图4I)、T helper cells(图4J)、Th2 cells(图4K)、Tcm(图4L)、pDC(图4M)。
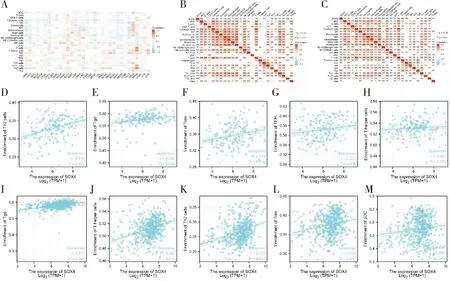
A.多种肿瘤中SOX4与免疫浸润细胞相关性热图;B.GBM中SOX4与免疫浸润细胞相关性热图;C.LGG中SOX4与免疫浸润细胞相关性热图;D-H.GBM中SOX4与免疫浸润TOP5免疫细胞相关性;I-M.LGG中SOX4与免疫浸润TOP5免疫细胞相关性
3 讨 论
本研究通过多组学联合分析发现SOX4 mRNA水平在胶质瘤中高表达,提示SOX4可能在胶质瘤中发挥作用。Luo等[10]证实降低SOX4使miR-133a过表达从而抑制胶质瘤的增殖、转移和EMT。Zhao等[11]证实miR-29a通过抑制SOX4转录翻译,促进胶质母细胞的侵袭。Liu等[12]证实激活SMAD2/3通路并诱导SOX4和SOX2的表达促进胶质瘤细胞迁移能力。Han等[13]通过体内外细胞实验证实降低SOX4表达能够抑制胶质瘤干细胞活性。这些结果都说明SOX4参与胶质瘤的发生发展。
为了探讨SOX4潜在作用机制,本研究通过SOX4在胶质瘤中共表达基因,进行功能富集分析,这些基因大多与有机酸转运、囊腔以及细胞外基质有关。本研究对SOX4共表达基因进行KEGG信号通路富集分析显示,他们参与花生四烯酸代谢、血管平滑肌收缩和RAS信号通路等。研究显示[14-17],花生四烯酸代谢途径在炎症反应中发挥关键作用,RAS信号通路介导胶质瘤的发生发展过程。由此可见,SOX4可能是治疗胶质瘤的新靶点。此外,本研究通过GSEA发现,SOX4高表达胶质瘤样本主要富集在有丝分裂、DNA修复、CD22受体、神经脊诱导分化、胰岛素分泌和炎症反应。SOX4 通过诱导细胞周期停滞和抑制细胞生长而在胶质瘤细胞中发挥抑癌作用,阻断辐射诱导的SOX4表达,抑制DNA修复,从而导致胶质瘤细胞的死亡[18-19]。本研究进一步证实了SOX4通过有丝分裂和DNA修复发挥影响肿瘤进展作用。胶质瘤的预后较差,治疗方法有限,免疫疗法是肿瘤治疗开创方法[20]。因此,为了提供治疗胶质瘤的证据,本研究通过免疫浸润发现SOX4与免疫细胞的关系,结果提示,SOX4与胶质瘤多种免疫细胞存在相关性。由此,推断出SOX4可能成为胶质瘤免疫治疗标志物。本研究通过ROC曲线分析SOX4对胶质瘤具有潜在的诊断价值。
为了探究影响SOX4表达的机制,本研究发现SOX4 DNA甲基化水平发生改变。DNA甲基化是一种常见的表观遗传机制,存在于所有形式的肿瘤中。本研究发现4个位点SOX4 DNA甲基化水平与胶质瘤预后密切相关,提示SOX4 DNA甲基化水平可作为预后评估分子应用于临床实践。另外,基因突变对肿瘤的发生、发展具有重要作用。SOX4在胶质瘤中有一定程度的突变,SOX4甲基化水平改变和突变发生可能是SOX4在胶质瘤中高表达原因之一。
综上所述,本研究中SOX4表达受DNA甲基化和基因突变调节,并与肿瘤免疫微环境有关。同时,SOX4及其DNA甲基化水平是潜在的诊断和预后评估因素,这说明SOX4可能参与胶质瘤的发生和发展。因此,SOX4可以成为潜在的诊断生物标志物以及胶质瘤的治疗靶点。SOX4功能的预测为胶质瘤的发病机制和在胶质瘤免疫治疗中的作用提供了见解,需要进一步研究,并探索临床应用和药物研发。

