微囊藻毒素-LR长期低剂量暴露诱导小鼠肾脏结构和功能损伤:基于激活PI3K/AKT信号通路
梁小芳,杨 越,徐帅帅,刘 映,褚晗玉,唐 艳,杨 飞,
1南华大学衡阳医学院公共卫生学院//湖南省典型环境污染与健康危害重点实验室,湖南 衡阳 421001;2中南大学湘雅公共卫生学院,湖南 长沙 410000;3苏州市吴中区疾病预防与控制中心,江苏 苏州215100
微囊藻毒素-LR(MC-LR)是一种在蓝藻水华污染中出现频率较高、产量较大和造成危害较严重的藻毒素[1]。MC-LR可通过饮水、食物链传递及水上活动等方式进入动物体内,对动物健康造成严重威胁[2,3]。有研究表明肾脏是MC-LR特异性分布的重要靶器官之一[4],实验证明小鼠经口服、腹腔注射和静脉MC-LR后,其肾脏中MC-LR含量远高于其他器官[5]。同时有研究提出MC-LR的暴露可引起肾脏损伤[2,6-11]。有体外实验表明,MC-LR可以阻滞G2/M期细胞群诱导人胚胎肾和人肾腺癌细胞凋亡[7]。同时在丁卡鱼、罗非鱼、鲫鱼和小鼠的急性毒性试验中,观察到MC-LR可以引起这些动物肾脏结构不同程度的病理改变,如肾小体的增大。鲍曼腔变宽并填充嗜酸性物质、肾小体鲍曼囊增厚等[8-11]。然而这些研究多为腹腔途径注射MC-LR后对肾脏的影响,且大都是急性染毒,仅有本课题组的前期做过MC-LR饮水染毒小鼠6月的研究[2]。且并未有研究对MC-LR长期暴露引起肾损伤的作用及其机制进行过探讨。
磷脂酰肌醇3-激酶(AKT)信号通路已被确定对癌症重要的3个主要信号通路之一,是一条细胞内信号传递的重要转导途径,它支持新陈代谢,影响细胞周期、存活、凋亡、增殖、生长和血管生成[12]。有研究表明MCLR可以激活PI3K/AKT信号通路。许鹏飞等[13]的结果显示MC-LR通过激活PI3K/AKT信号通路促进黑色素瘸细胞侵袭和肿瘤转移,同时又有实验发现PI3K/AKT信号通路的激活与肾脏损伤密切相关[14,15]。Hakim等[14]发现,多囊肾病和肾功能衰竭与PI3K/AKT信号通路的激活有关,Zhao等[15]的研究结果显示阿拉曼定通过下调PI3K/AKT信号通路,可以抑制炎症和细胞凋亡,从而改善肾功能,以此减轻脂多糖诱导的小鼠肾脓毒症。由此推测MC-LR可以通过激活PI3K/AKT信号通路,从而引起肾损伤。
本文通过饮水染毒MC-LR(0、1、60、120 μg/L)12个月,建立体内饮用水长期染毒动物模型,研究长期低剂量暴露MC-LR对肾脏损伤的作用。并利用体外MC-LR染毒与PI3K/AKT抑制剂联合染毒模型进一步地探讨PI3K/AKT信号通路在MC-LR致肾脏损伤中的作用及其分子机制。本研究可为预防和治疗MC-LR引起的慢性肾脏疾病提供科学理论依据。
1 材料和方法
1.1 试剂
MC-LR 标准品(北京伊普瑞斯技术开发有限公司);人正常胚胎肾细胞株HEK293细胞由中南大学冯湘玲老师赠送;胎牛血清、双抗和0.25%EDTA胰蛋白酶(Gibco);DMEM 培养基、PI3K 抑制剂LY294002(Sigma);血尿素氮(BUN)、血肌酐(SCr)、肌酐(Cr)(南京建成生物);RNA提取、逆转录试剂盒和qPCR试剂盒(南京诺唯赞);PCR引物(上海生工生物);PI3K抗体、AKT抗体、兔二抗、鼠二抗(三鹰);p-PI3K抗体、p-AKT抗体(Cell Signaling Technology)。
1.2 方法
1.2.1 小鼠分组与处理 选取健康6~8周龄C57BL/6小鼠20只,体质量为20~23 g,购自湖南省斯莱克实验动物公司,喂养于中南大学湘雅公共卫生学院动物中心(许可编号:XYGW-2018-41),所有实验通过伦理委员会审核(XYGW-2018-41号)。将20只小鼠随机平均分成4组,给予新配置的染毒水(0、1、60和120 μg/L),2次/周,小鼠MC-LR染毒时间持续12月。1次/月称取小鼠体质量。小鼠饲养满12月后,通过摘眼球取血法收集小鼠血液,引颈处死后取出肾脏,称量并记录肾脏的绝对质量和相对质量。
1.2.2 细胞培养及处理 将HEK293细胞置于5%CO2、37 ℃恒温饱和湿度条件下培养,培养液为含10%胎牛血清、1%双抗的DMEM 培养基,待细胞生长至对数期时进行实验。HEK293细胞分为对照组(Control)、10 μmol/L LY294002(PI3K 抑制剂)组、15 μmol/L MC-LR组和MC-LR+LY294002组。在MC-LR染毒处理前1 h加入LY294002,处理24 h后,收集细胞进行后续实验。
1.2.3 肾脏组织切片与HE染色 用生理盐水清洗肾脏后,用刀片划出厚度小于5 mm的肾脏组织,置于4%的多聚甲醛中室温固定1~2 d。将组织送至武汉谷歌生物科技有限公司制作HE染色切片。主要步骤为:制作石蜡切片—二甲苯/无水乙醇/75%酒精脱蜡—苏木素染色—酒精脱水—伊红染色—无水乙醇/二甲苯脱水—中性树胶封片。
1.2.4 试剂盒检测肾脏生化指标 按试剂盒步骤,吸取冻融血清和HEK293细胞上清液于洁净的200 μL EP管,分别用BUN试剂盒和SCr(Cr)试剂盒测定肾功能指标BUN和SCr(Cr)水平。
1.2.5 qPCR 检测相关炎症因子mRNA 的表达 使用Trizol试剂提取小鼠肾脏和HEK293细胞总RNA,用紫外分光光度计检测RNA浓度和A260/280比值,利用逆转录试剂盒将RNA逆转录为cDNA。Primer Premier 5.0软件中设计引物,然后将设计好的引物NCBI中进行验证,交由中国上海生工生物合成,引物序列见表1。进行三步法qPCR反应程序:预变性(95 ℃持续30 s),接着进行40个变性(95 ℃持续10 s)、退火(60 ℃持续30 s)、延伸(72 ℃持续25 s)循环。在扩增阶段完成后分析熔解曲线。用2-ΔΔCt法计算目的基因的相对表达量,使用GraphPad Prism 6.0软件绘图进行。

表1 引物序列Tab.1 Primer sequences used for qRT-PCR
1.2.6 Western blot检测蛋白表达情况 用含有蛋白酶抑制剂和磷酸酶抑制剂的RIPA裂解液提取小鼠肾脏、HEK293细胞蛋白,根据蛋白分子量大小将蛋白进行分离,之后通过转膜系统将其转移到固定载体,随后以转移到固定载体的蛋白质为抗原,与相关蛋白的抗体起免疫反应,最后与HRP标记的第二抗体反应,显影以检测p-PI3K、PI3K、p-AKT、AKT蛋白的表达,最终用Image J进行灰度值分析。
1.2.7 统计分析 利用SPSS 26.0软件进行数据的统计学分析,数值以均数±标准差表示,两组样本比较选用独立样本t检验分析,多组样本比较选用单因素方差分析。双侧检验水平α=0.05。
2 结果
2.1 小鼠的一般情况
实验小鼠在整个饲养周期内,生命体征平稳,未出现中途死亡等意外情况。在染毒后期,与对照组相比,60和120 μg/L染毒组小鼠出现毛发发黄暗淡,缺少光泽,自主活动度下降。各染毒组小鼠总体体质量变化趋势相近,无明显异常情况(图1)。

图1 MC-LR染毒12个月期间的小鼠体质量变化趋势Fig.1 Weight changes of the mice exposed to MC-LR for 12 months.
2.2 小鼠染毒后肾脏重量及肾脏指数
实验小鼠的肾脏系数计算公式为:肾脏指数(%)=(双肾质量/体质量)×100%MC-LR染毒12个月后,与对照组相比,不同浓度MC-LR组小鼠肾脏质量和肾脏指数变化无统计学意义(P>0.05,图2)
图2 小鼠双肾质量(A)和小鼠肾脏系数(B)Fig.2 Bilateral kidney weight(A)and kidney index(B)of the mice in each group.
2.3 MC-LR对小鼠肾脏组织学形态的影响
在肾皮质部分,与对照组相比,1 μg/L染毒组肾小体结构完整,60和120 μg/L染毒组肾小球结构改变,鲍曼空间压缩,血管球扩张(黄色长框),间质可观察到明显淋巴细胞浸润(红色细箭头),120 μg/L染毒组更为明显(图3A~D);在肾髓质部分,与对照组相比,1 μg/L染毒组肾小管结构完整,60和120 μg/L染毒组肾小管扩张(蓝色粗箭头),间质可观察到淋巴细胞浸润且随着染毒剂量升高而逐渐明显(图3E~H);在肾盂部分,随着染毒浓度的增加,肾盂淋巴细胞浸润程度逐渐增加(红色细箭头)(图3I~L)。

图3 MC-LR慢性染毒后小鼠肾脏切片病理学观察Fig.3 Pathological observation of the renal tissues of the mice with long-term MC-LR exposure(HE staining,original magnification:×200,scale bar=150 μm).A-D: Renal cortex.E-H: Renal medulla.I-L: Renal pelvis.The yellow boxes highlight baumann space compression,the red arrows indicate lymphocytic infiltration,and the blue arrows indicate dilated tubules.
2.4 MC-LR对小鼠血清肾功能指标的影响
MC-LR染毒12个月后,与对照组相比,血清BUN和SCr水平在60和120 μg/L染毒组中升高,且差异具有统计学意义(P<0.05,图4)。
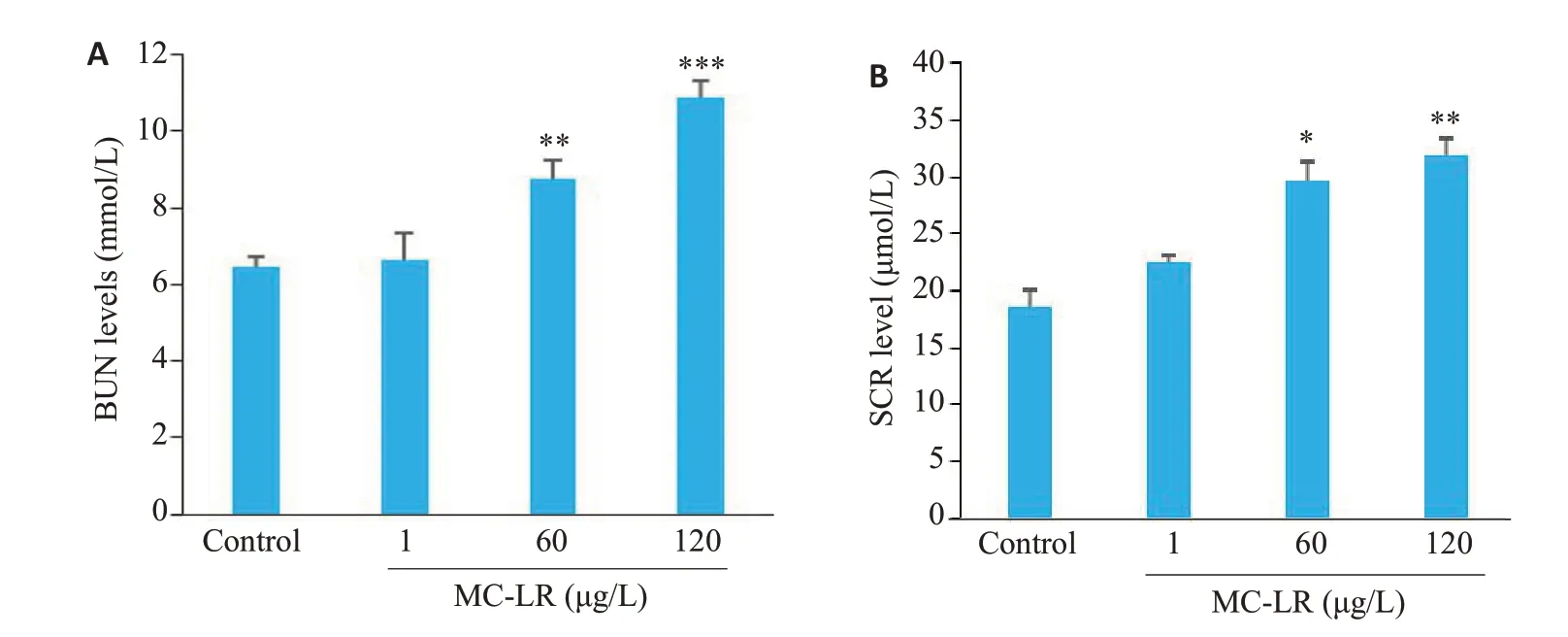
图4 MC-LR染毒12个月对小鼠血清肾功能指标的影响Fig.4 Effects of MC-LR exposure for 12 months on serum renal function indexes of the mice.A:BUN levels.B:SCr level.*P<0.05,**P<0.01,***P<0.001 vs control.
2.5 MC-LR对小鼠肾脏炎症的影响
与对照组相比,TNF-α和IL-6在60和120 μg/L染毒组中升高,且差异具有统计学意义(P<0.05,图5A、B)。IL-10在所有染毒组中的相对表达量显著降低,且差异具有统计学意义(P<0.05,图5 C)。
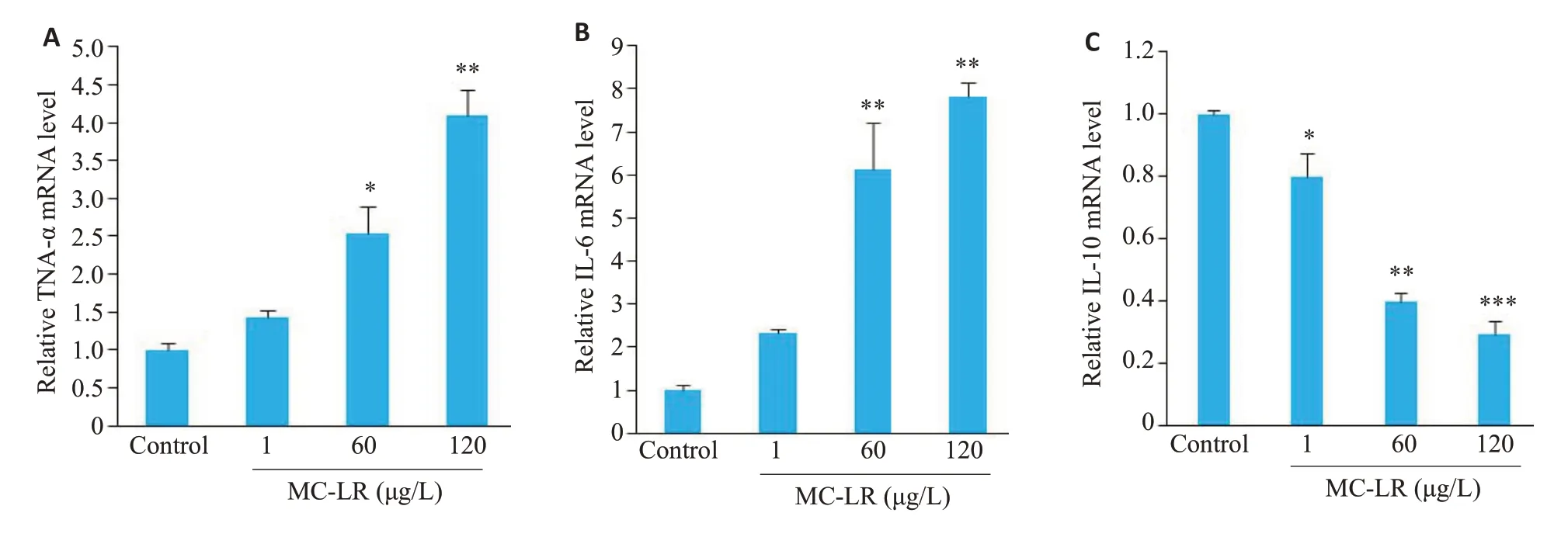
图5 MC-LR对小鼠肾脏炎症因子的影响Fig.5 Effects of MC-LR exposure on mRNA expression levels of TNF-α(A),IL-6(B)and IL-10(C)in the mice.*P<0.05,**P<0.01,***P<0.001 vs control.
2.6 MC-LR对小鼠肾脏PI3K/AKT通路的影响
与对照组相比,p-PI3K/PI3K、p-AKT/AKT的蛋白相对表达量在染毒组中上升,且差异均有统计学意义(图6)。
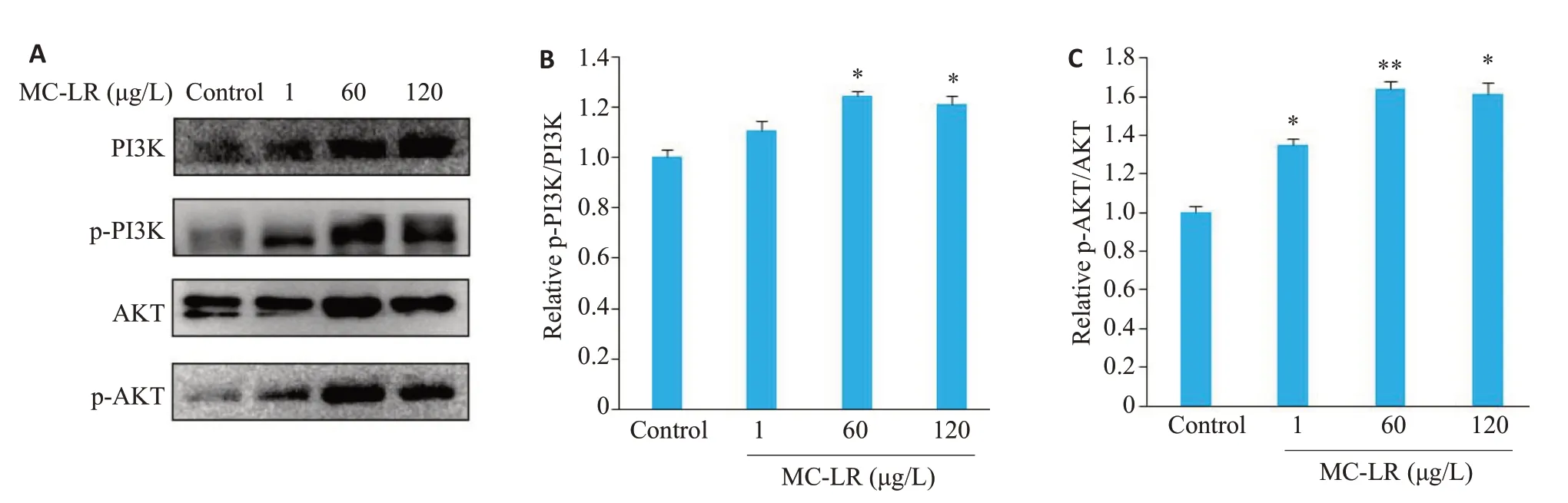
图6 MC-LR慢性染毒对小鼠肾脏相关蛋白的影响Fig.6 Effects of chronic MC-LR exposure on renal expressions of proteins in the PI3K/AKT pathway.A:Western blots of the proteins in the PI3K/AKT pathway.B,C: Quantitative analysis of the expression levels of P-PI3K/PI3K and PAKT/AKT proteins.*P<0.05,**P<0.01 vs control.,
2.7 PI3K/AKT通路对MC-LR染毒HEK293细胞肾损伤指标以及炎症因子的影响
与对照组相比,p-PI3K/PI3K、p-AKT/AKT的蛋白相对表达量在MC-LR 染毒组呈上升趋势。而在与PI3K抑制剂LY294002联合处理后,与MC-LR染毒组相比,以上蛋白相对表达量显著下降,且差异有统计学意义(图7)。与对照组相比,BUN和Cr在MC-LR染毒组中均表达上调,且差异具有统计学意义(P<0.05,图8)。与MC-LR染毒组相比,在PI3K抑制剂处理后的MCLR染毒组中,BUN和Cr的水平显著下调,且差异均具有统计学差异。与对照组相比,IL-6、TNF-a在MC-LR染毒组中均表达上调,IL-10在MC-LR染毒组中均表达下调,且差异具有统计学意义(图9)。与MC-LR染毒组相比,在PI3K抑制剂处理后的MC-LR染毒组中,IL-6、TNF-α的表达显著被抑制,而IL-10的表达被显著上调,且差异均具有统计学意义。

图7 干预PI3K/AKT信号通路后MC-LR对HEK293细胞蛋白表达量的影响Fig.7 Effect of MC-LR on expressions of the related proteins in HEK293 cells after intervention of the PI3K/AKT signaling pathway.A:Western blots of the proteins in the PI3K/AKT pathway.B,C:Quantitative analysis of the expression levels of PPI3K/PI3K and P-AKT/AKT proteins.***P<0.001 vs control;##P<0.01,###P<0.001 vs MC-LR.
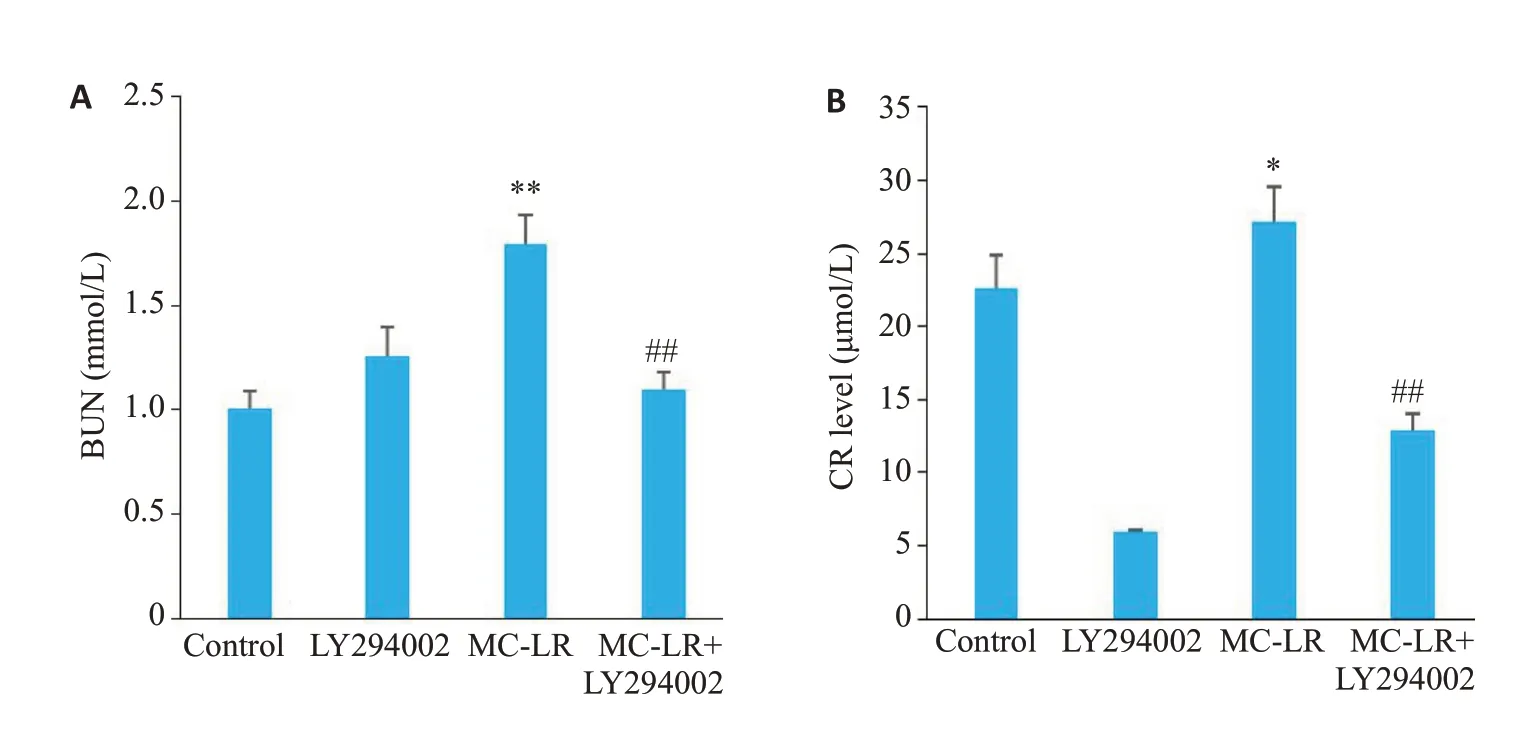
图8 干预PI3K/AKT信号通路后MC-LR对HEK293细胞肾功能指标的影响Fig.8 Effect of MC-LR on BUN and Cr levels in HEK293 cells after intervention of the PI3K/AKT signaling pathway.*P<0.05,**P<0.01 vs control;##P<0.01 vs MC-LR.

图9 干预PI3K/AKT信号通路后MC-LR对HEK293细胞炎症因子的影响Fig.9 Effect of MC-LR on mRNA expression levels of TNF-α(A),IL-6(B)and IL-10(C)in HEK293 cells after intervention of PI3K/AKT signaling pathway.**P<0.01 vs control;#P<0.05,##P<0.01 vs MC-LR.
3 讨论
慢性肾病被认为是多因素疾病,其发生与遗传因素、个人生活饮食行为习惯、病原体感染以及环境毒素暴露等因素有关[16],但现有对于MC-LR引起慢性肾损伤的作用及其分子机制研究有限。本研究旨在探讨MC-LR慢性染毒造成的肾脏损伤,以及PI3K/AKT信号通路在肾脏损伤中的作用。结果显示MC-LR可调控PI3K/AKT信号通路影响肾脏炎症反应发生。
在本研究中,为了模拟公众最常见的MC-LR暴露方式—饮水暴露,我们对40只清洁级的雄性C57BL/6小鼠给予含0、1、60和120 μg/L MC-LR的饮用水,慢性染毒12个月后观察MC-LR对肾脏毒作用的效果。Go等[17]通过检测太湖水体和水产品中的微囊藻毒素浓度,评估在太湖梅梁湾(污染区)长期生活的渔民对微囊藻毒素的环境吸收程度,估算出在动物模型的MC-LR染毒浓度大于100 μg/L。Fawell等[18]根据MC-LR亚慢性(13周)灌胃染毒实验发现MC-LR的未观察到有害作用水平(NOAEL)是40 μg/(kg·d),相当于250 μg/L的MC-LR 饮用水浓度[17]。关于MC-LR 慢性染毒的NOAEL数据亟需探讨,故本研究选择了120 μg/L(1/2的NOAEL)的浓度作为MC-LR的最高染毒剂量,选择60 μg/L(1/4的NOAEL)作为另一个染毒剂量。其次,在我国的《地表水环境质量标准》及《生活饮用水卫生规范》中分别规定了水源水、饮用水中的MC-LR最高浓度限值,即1 μg/L。因此,本研究的最低染毒剂量定为1 μg/L,观察1 μg/L的MC-LR慢性染毒是否对肾脏产生明显的损害作用。
3.1 MC-LR染毒对小鼠一般情况的影响
在对小鼠进行长期体质量监测的过程中发现,与对照组相比,各染毒组小鼠的体质量增长的整体趋势变化无明显差异。与我们前期研究结果相一致[2]。Zhao等[15]和Li等[19]均开展了MC-LR慢性染毒实验,在小鼠饮用水中加入不同剂量的MC-LR,在连续染毒12月的过程中未发现体质量明显改变。此外,本课题组的前期研究结果显示,与对照组相比,染毒6月后小鼠的肾脏质量和肾脏指数改变也无明显差异[2]。同时,Qin等[20]通过MCLR染毒小鼠21 d发现肾脏质量和肾脏指数也无明显改变。然而Lone等[21]发现染毒14 d后,小鼠的肾脏质量显著增加。这些结果表明MC-LR长期暴露可能对小鼠体质量以及肾脏质量影响较小,而短期暴露对小鼠体质量和肾脏质量影响较大。
3.2 MC-LR诱导肾脏损伤
MC-LR染毒后,小鼠肾脏HE结果显示,与对照组相比,在60和120 μg/L剂量组,肾小球结构发生改变,鲍曼间隙压缩、血管球扩张、间质可观察到明显淋巴细胞浸润;肾小管扩张,间质也可观察到明显淋巴细胞浸润,且随染毒剂量增加而逐渐明显;肾盂部分能观察到明显的淋巴细胞浸润。本课题组前期研究发现,通过不同浓度(1、30、60、90和120 μg/L)MC-LR饮水染毒实验,肾脏切片结果与本研究结果相近[2]。同时有研究等[22]通过腹腔注射染毒大鼠8个月,组织病理学检查显示肾小球塌陷、基底膜增厚、扩张的小管内充满嗜酸性管型。由此说明MC-LR可以导致肾脏结构的损伤,但由于个体差异以及染毒方式的不同,引起的损伤程度也不同。
血清生化检测发现肾功能指标发生改变,与对照组相比,60和120 μg/L剂量组中BUN和SCr呈上升趋势,同时在体外实验中发现MC-LR染毒组BUN和Cr同样呈上升水平。Germoush[23]和Lone等[23]开展了为期14 d的MC-LR染毒老鼠实验,前者研究发现大鼠血清BUN和SCr水平增高,后者也同样发现小鼠血清BUN水平升高。然而,在本课题组之前的研究中,小鼠MC-LR慢性染毒达6个月,随着染毒剂量的增加BUN表现出下降趋势,而SCr水平没有明显变化[2]。推测出现这种情况是因为急性暴露于MC-LR 后小鼠肾脏产生损伤,BUN和SCr水平上升。而慢性染毒时小鼠有自身保护机制,抑制BUN和SCr的上升并使其处于较低水平。但随着染毒时间的增加,这种保护机制发挥作用降低,小鼠肾脏BUN和SCr在高MC-LR染毒组中显著升高,肾脏损伤逐渐加重。
3.3 MC-LR诱导肾脏炎症
本研究在体内和体外染毒实验中发现炎症因子的转录水平发生改变,MC-LR 染毒能够上调促炎因子TNF-α和IL-6的mRNA表达水平,并抑制抗炎因子IL-10的mRNA表达水平。TNF-α是一种多功能细胞因子,广泛参与体内的病理生理过程,如:增殖、分化、凋亡、自噬等[24]。Guo等[25]研究表明小鼠发生急性肾脏损伤时,会上调肾脏TNF-α mRNA的表达。Al-Badrani和Arman等[26,27]研究也发现暴露MC-LR 后会引起TNF-α的上调。当机体发生炎症反应后,吞噬细胞会作用于凋亡和坏死细胞,其后分泌抗炎因子IL-10,抑制细胞因子和趋化因子。Arman等[27]也观察到暴露于MC-LR后会导致小鼠肾脏IL-10的表达水平的下调。Magno等[28]提到IL-6家族成员在糖尿病肾病、肾小球肾炎和梗阻性肾病等肾脏疾病患者的肾组织中上升。综上,MC-LR可以引起小鼠肾脏发生炎症反应,促炎因子和抗炎因子的失衡是肾脏炎症的重要因素。
3.4 MC-LR激活肾脏PI3K/AKT信号通路
目前没有对于MC-LR慢性染毒引起小鼠肾脏损伤的PI3K/AKT信号通路改变的研究。我们首次在体内MC-LR慢性染毒动物模型中发现,WB结果表明与对照组相比p-PI3K/PI3K、p-AKT/AKT的蛋白相对表达量在MC-LR染毒组中上升。在体外MC-LR染毒模型中以上蛋白表达量均升高,并激活了PI3K/AKT通路,而在PI3K抑制剂处理后,PI3K/AKT通路被明显抑制,同时也抑制了炎症反应。研究结果表明MC-LR的暴露激活了PI3K/AKT通路,与其他研究相一致。Miao等[29]提出,MC-LR激活PI3K/AKT诱导基质金属蛋白酶-13(MMP-13)过表达,导致结直肠癌DLD-1细胞和HT-29细胞迁移和侵袭。Chen等[30]指出MC-LR介导的PI3K/AKT通路激活会导致男性生殖功能障碍。Wen等[31]的KEGG 通路分析结果提示MC-LR 激活PI3K/AKT造成肝脏损伤。Zhou等[32]的实验结果表明PI3K/AKT信号通路的激活在MC-LR诱导的慢性睾丸毒性中起着重要的作用。有研究通过体外实验,发现了MCLR暴露激活PI3K/AKT通路诱导小鼠精原细胞恶性转化[33]。同时也有一些研究表明PI3K/AKT信号通路的激活可以导致肾损伤[34-40]。Pan等[34]的实验证实了氯化钆可以激活PI3K/AKT信号通路促进HEK293人胚胎肾细胞增殖。Wang等[35]进行了为期14 d的静脉注射牛血清白蛋白大鼠实验,其研究显示激活PI3K/AKT信号通路可以引起膜性肾炎,导致膜性肾病肾损伤。Bao等[36]探讨了增龄性肾血管硬化的影响因素,其实验结果提示激活PI3K/AKT信号通路引起肾脏血管内皮细胞的衰老和凋亡。Si等[37]开展了为期14 d的草酸钙结晶小鼠模型实验,结果显示抑制PI3K/AKT信号通路可以发挥抗氧化、抗炎、抗纤维化作用,减轻草酸所致大鼠肾脏损伤。Zhang等[38]在熊果苷对内毒素脂多糖诱导大鼠急性肾损伤作用的探讨中,发现抑制PI3K/AKT信号通路可以抑制细胞凋亡以及炎症反应,从而减轻急性肾损伤。Hu等[39]建立了糖尿病大鼠模型,其结果显示下调PI3K/AKT信号通路通过抑制细胞凋亡、炎症反应以及激活自噬,从而发挥改善糖尿病肾病的作用。Zhu[40]和Wang等[41]在体外实验中证明了PI3K/AKT信号通路的下调可以抑制人肾癌细胞的增殖和凋亡,发挥抗癌作用。因此,本文结果表明PI3K/AKT信号通路的激活与长期低剂量MC-LR暴露引起的肾脏损伤作用密切相关。
综上所述,本研究发现MC-LR可通过上调PI3K/AKT信号通路,激活肾脏炎症反应。MC-LR进入肾细胞后,激活PI3K/AKT信号通路,引起炎症因子改变,诱导肾细胞炎症损伤,最终导致肾脏损伤。我们的研究为预防及治疗MC-LR引起的肾损伤提供了理论依据和实验基础。

