空腹C肽联合胰岛素抵抗指数评估2型糖尿病患者非酒精性脂肪肝肝纤维化的价值
吴坚玲 朱扩中 许鑫
非酒精性脂肪肝(nonalcoholic fatty liver disease,NAFLD)是一种除酒精外,由代谢应激引起的肝脏损伤,其主要表现为肝细胞中脂肪累积超出5%以上[1]。随着近年来社会经济的发展和人们生活饮食习惯的改变,NAFLD 的发病率逐年升高,而其在2型糖尿病(type 2 diabetes mellitus,T2DM)人群中发病率更高[2]。既往有研究表明,糖尿病是预测NAFLD 患者病情加重与肝纤维化发展的最佳预测因子[3]。且有研究表明,NAFLD 患者肝纤维化的持续发展的同时,也会引发患者糖尿病微血管、肝全因死亡及肝癌等情况发生的风险上升[4]。既往的临床经验表明,早期诊断T2DM 合并NAFLD 患者的肝纤维化情况是减轻糖尿病慢性并发症、延缓肝纤维化发展的前提条件。空腹C 肽与胰岛素抵抗指数(Homeostasis model assessment of insulin resistance,HOMA-IR)均与肝纤维化进展有关[5],但鲜有利用两者联合测评T2DM 合并NAFLD 患者的肝纤维化情况报道。故本次研究探讨空腹C肽联合HOMA-IR 评估T2DM 合并NAFLD 患者肝纤维化的诊断价值。
1 资料与方法
1.1 一般资料 前瞻性选取2018 年2 月至2021 年6 月期间于东阳市横店文荣医院检查确诊为T2DM合并NAFLD 的患者,纳入标准为:①符合1999 年世界卫生组织修订的对于T2DM 的诊断标准[6];②符合中华医学会肝病学分会于2010 年发布的《非酒精性脂肪性肝病诊断指南》[7]中对于NAFLD的诊断标准;③患者年龄18~75 岁。排除标准为:①患者患有损伤肝功能的代谢性疾病;②患者既往有饮酒史(男性>140 g/周,女性>70 g/周);③患者为妊娠糖尿病、1 型糖尿病或其他类型糖尿病;④患者合并药物性肝病、肝胆道阻塞性或胆道感染类疾病;⑤患者合并甲减、甲亢、肿瘤或血液性等疾病;⑥患者近期服用影响胰岛素水平、C 肽分泌或血脂水平的药物;⑦肝脏组织硬度值(liver stiffness measurement,LSM)在5.8 kPa 以下的患者。共纳入246 例患者,其中男性136 例、女性110 例;年龄38~74 岁,平均年龄(53.47±12.66)岁。本研究已通过院内医学伦理委员会的审核与批准,患者及其家属均了解研究内容并签署知情同意书。
1.2 收集资料 收集患者的一般资料,包括患者的年龄、性别、体重指数(body mass index,BMI)、T2DM病程,测量患者静息半小时后的血管收缩压、舒张压,患者空腹8 h 后抽取其静脉血,测量患者空腹血糖(fasting plasma glucose,FPG)、空腹C 肽、空腹胰岛素(fasting insulin,FINS)、糖化血红蛋白(glycosylated hemoglobin,HbA1c)、尿酸(uric acid,UA)、三酰甘油(triglyceride,TG)、高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)、低密度脂蛋白胆固 醇(low density lipoprotein cholesterol,LDL-C)、天冬氨酸转移酶(aspartate transferase,AST)、丙氨酸转移酶(alanine transferase,ALT)、γ -谷氨酰转肽酶(γ-glutamyl transpeptidase,γ-GGT)。计算HOMA-IR。
HOMA-IR=FINS×FPG/22.5[8]
1.3 统计学方法 采用SPSS21.0 软件进行数据分析,计数资料使用例(%)表示,组间比较采用χ2检验;对于符合正态性分布的计量资料采用均数±标准差()表示,组间比较采用独立样本t检验,非正态分布的计量资料采用中位数和四分位数[M(P25,P75)]表示,组间比较采用非参数检验;并采用多因素logistic回归分析影响T2DM 合并NAFLD 患者肝纤维化的独立影响因素;采用受试者工作特征(receiver operating characteristic,ROC)曲线评估空腹C 肽联合HOMA-IR 的预测价值。设P<0.05 为差异有统计学意义。
2 结果
2.1 单因素分析 根据患者FibroScan 测得的LSM值,将LSM 值为5.8~7.9 kPa 的患者纳入非进展性肝纤维化组(n=211),将LSM 值在7.9 kPa 以上的患者纳入进展性肝纤维化组(n=35)。两组患者的相关因素比较见表1。
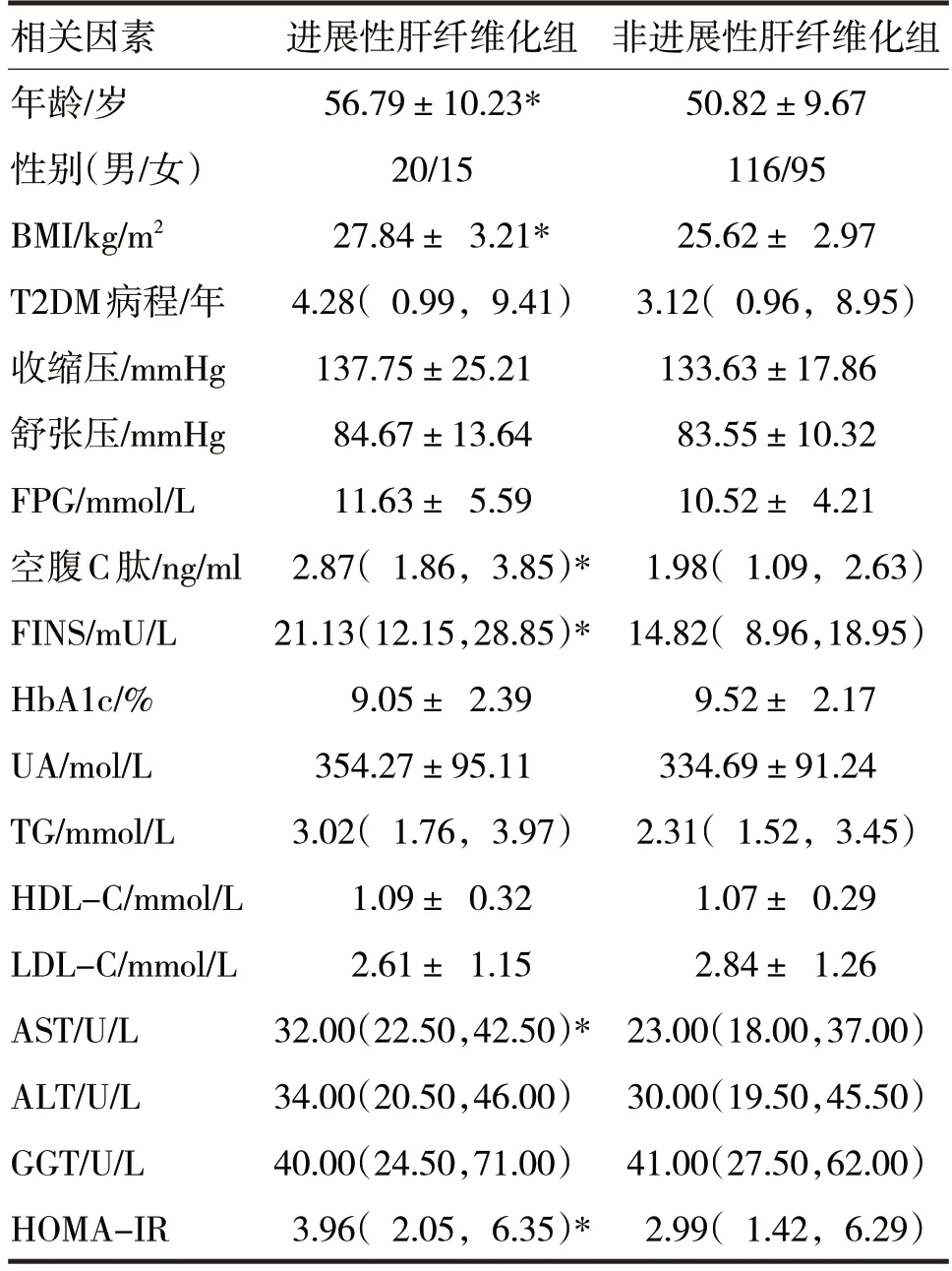
表1 两组患者的相关因素比较
由表1 可见,进展性肝纤维化组患者的年龄、BMI、空腹C肽、FINS、AST、HOMA-IR 均明显高于非进展性肝纤维化组患者(t分别=3.36、4.26,Z分别=2.15、3.11、2.95、2.75,P均<0.05),而患者的性别、收缩压、舒张压、FPG、HbA1c、UA、HDL-C、LDL-C、T2DM 病程、TG、ALT、GGT 在两组间比较,差异均无统计学意义(χ2=0.06,t分别=1.19、0.57、1.37、1.17、1.17、0.37、1.01,Z分别=0.93、0.43、0.62、0.45,P均>0.05)。
2.2 影响患者肝纤维化进展的多因素分析见表2
由表2可见,患者的年龄、BMI、空腹C肽、FINS、AST、HOMA-IR 均为影响T2DM合并NAFLD 患者肝纤维化的危险因素(P均<0.05)。
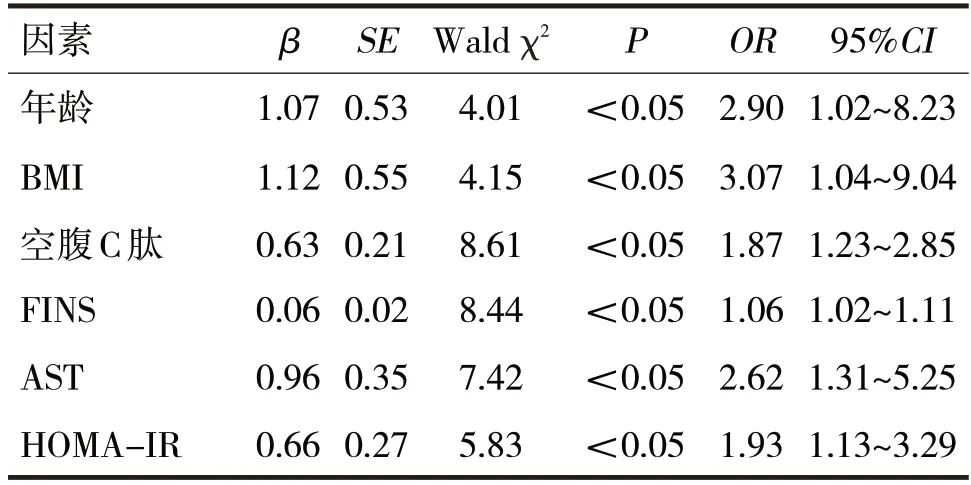
表2 影响T2DM合并NAFLD患者肝纤维化进展的多因素分析
2.3 空腹C 肽、HOMA-IR 及两者联合对患者发生进展性肝纤维化的预测效能见图1
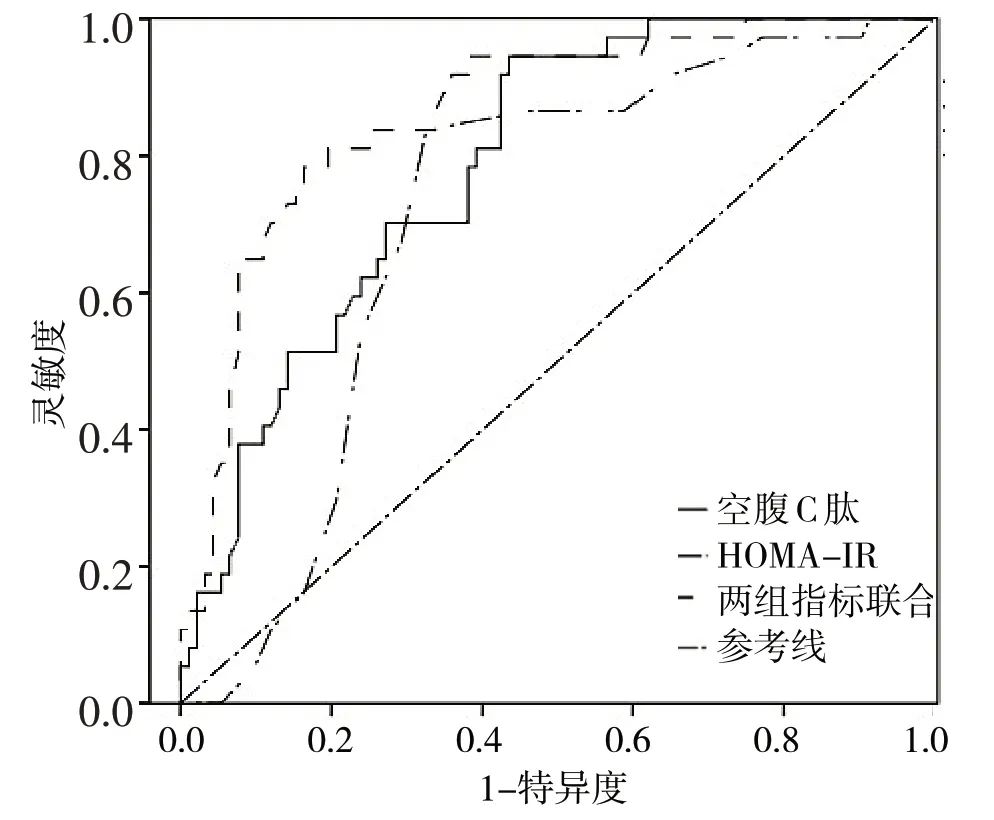
图1 空腹C肽、HOMA-IR及两者联合对预测T2DM合并NAFLD患者肝纤维化的ROC曲线
由图1 可见,利用ROC 曲线评估空腹C 肽、HOMA-IR 及两者联合后的预测效能,结果显示空腹C 肽AUC 为0.79(95%CI0.71~0.87),截断值为2.56 ng/ml,诊断灵敏度为70.34%,特异度为78.82%,准确度为81.54%;HOMA-IR 的AUC为0.71(95%CI0.62~0.80),截断值为4.48,诊断灵敏度为65.43%,特异度为74.67%,准确度为78.65%;两组指标联合的AUC 为0.86(95%CI0.79~0.93),诊断灵敏度为78.59%,特异度为83.68%,准确度为85.96%。
3 讨论
T2DM 患者易出现NAFLD,有研究表明,T2DM是NAFLD 出现病情进一步恶化的独立危险因素,且T2DM 人群中检出患有NAFLD 概率达到70%以上,而其中大约有17%~37%的患者发生进展性肝纤维化,其发生概率为正常人群的2~4倍以上[9]。本次研究T2DM 合并NAFLD 患者中检出有14.23%的患者有进展性肝纤维化,与既往研究结果较为一致。本次研究通过前瞻性选取已确诊为T2DM 同时合并NAFLD 的患者,根据其肝纤维化检查结果、患者临床资料及临床经验,探究空腹C 肽联合HOMA-IR对T2DM 合并NAFLD 患者的肝纤维化的评估价值,为早期诊断患者肝纤维化程度诊断提供相应依据。
本次研究中患者的肝纤维化检查采用FibroScan瞬时弹性成像检查,因为肝组织穿刺活检虽是肝纤维化检查的金标准,但因其有创性,临床中不适用于对患者肝纤维化程度的早期检查,而FibroScan 是目前临床常用的检查技术,被临床认为将来可能替代肝组织活检的检查方式[10]。故本次研究以此作为评估T2DM 合并NAFLD 患者肝纤维化进展的标准是可行的。本次研究多因素分析结果显示,患者的年龄、BMI、空腹C 肽、FINS、AST、HOMA-IR 均为影响T2DM 合并NAFLD 患者肝纤维化的危险因素(P<0.05)。随着患者年龄的增长,其机体代谢能力下降,肝脏发生纤维化的概率增加。患者BMI 值越高,其肝脏脂肪含量、肝脏僵硬程度、胰腺脂肪含量更高,其与NAFLD 患者肝纤维化的发展呈正相关[11,12]。C 肽为人体胰岛素原分子发生分裂水解时,与等摩尔的胰岛素同时释放的肽类激素,故其可以用来测定胰岛素的分泌,评估残留的胰岛β 细胞活性度[13]。目前,人们关于空腹C 肽对NAFLD 患者肝纤维化的发展的影响结论不一。有研究认为,C 肽与肝纤维化进展呈负相关,与肝脂肪变性的炎症发展呈正相关[14];同时有研究认为,C 肽对于T2DM 患者并发症的发生情况起到延缓作用[15]。本次研究结果显示,C 肽是T2DM 合并NAFLD 患者肝纤维化的进展的危险因素。其原因可能为,C 肽代表了人体自发分泌的胰岛素水平,早期NAFLD 患者的胰岛素若分泌过多,即会导致高胰岛素血症的产生,而过高的胰岛素则会刺激肝细胞分泌基质过量,进而加快肝纤维化发展[16,17]。同时C 肽是一种信号调节酶,其可调节NF-KB-JNK 神经酰胺途径,增加人体对于糖原异生蛋白的转录表达,调节细胞凋亡、细胞核分裂和促炎性细胞因子的产生,加速肝细胞进行凋亡裂解[18]。AST 为表示机体肝功能的常用指标,其通常存在于线粒体中,当肝细胞发生炎症,造成肝细胞被破坏、坏死时,其水平则会升高[19]。高胰岛素血症和胰岛素抵抗可增加胰岛素样生长因子1的表达和胰岛素升高,而胰岛素样生长因子1水平的增高会激活Wnt/β 联蛋白信号级联反应,进而造成肝纤维化和癌变的发生[20]。本次研究ROC 结果显示,空腹C 肽联合HOMA-IR 预测T2DM 合并NAFLD 患者肝纤维化具有较好的效能,其AUC 为0.86,诊断灵敏度为78.59%,特异度为83.68%,准确度为85.96%。单纯的空腹C 肽AUC 为0.79,诊断灵敏度为70.34%,特异度为78.82%,准确度为81.54%;HOMA-IR 的AUC 为0.71,诊断灵敏度为65.43%,特异度为74.67%,准确度为78.65%。刘佼等[21]的研究结果同样显示,空腹C 肽是影响T2DM合并NAFLD 患者肝纤维化进展的独立危险因素,其AUC 为0.814,诊断敏感度为64.2%,特异度为89.7%。
综上所述,患者的年龄、BMI、空腹C 肽、FINS、AST、HOMA-IR 均为影响T2DM合并NAFLD 患者肝纤维化的危险因素,而利用空腹C肽联合HOMA-IR对T2DM 合并NAFLD 患者肝纤维化具有较好的预测效能,对临床诊断具有一定的价值。但本次研究为单中心研究,所选取研究对象均为同一医院所得,其结果具有一定限制,且选取的患者样本量较少、大规模诊断无法使用肝组织活检,均对结果具有一定影响,后续或可规避上述因素做进一步研究。

