基于蛋白质组学的肝癌复发预警模型的构建及应用
陈成 项萧楠 刘治坤 王建国 徐骁
(1 浙江大学医学院附属湖州医院肝胆胰外科,浙江 湖州 313000;2 浙江大学医学院;3 浙江大学医学院附属第一医院肝胆胰外科;4 浙江省肿瘤融合研究与智能医学重点实验室;5 浙江大学医学院附属杭州市第一人民医院肝胆胰外科)
肝细胞癌(hepatocellular carcinoma,HCC)具有高发病率、高死亡率的特点,5年总体生存率不足20%[1]。手术切除是HCC的主要治疗手段[2],但术后5年复发率高达70%,严重影响患者预后生存。准确预测HCC术后患者预后并及时早期干预,可以有效延长HCC患者的生存时间。微血管侵犯(MVI)是HCC主要转移方式之一[3-4],是HCC患者术后复发的重要危险因素,常常与预后不良相关[5-6]。研究发现FAM123B可通过Akt信号通路诱导上皮-间质转化,从而促进HCC转移[7]。另有研究显示CR1和NFκB/p65可形成促进HCC侵袭的正反馈环[8],这些因子也许可以作为预测切除术后HCC复发的生物标志物,但目前仍缺乏具有较高灵敏度和特异度的MVI分子标志物的报道,因此探索新型HCC的MVI标志物,对其术后复发的预警具有重要意义。蛋白质组学分析借助于串联质谱标记及同位素标记相对和绝对定量技术,目前已广泛用于新的肿瘤生物标志物研究探索之中[9-10]。本研究通过蛋白质组学技术分析MVI相关的蛋白标志物,探讨基于蛋白质组学的HCC复发预警模型对HCC患者预后预测的临床价值。
1 材料与方法
1.1 HCC患者肿瘤组织样本的收集和蛋白质组学分析
收集浙江大学医学院附属第一医院术后病理确诊为HCC患者的肿瘤组织样本6例,其中MVI阳性患者3例,MVI阴性患者3例,MVI的诊断依据术后病理报告结果。样本的蛋白质组学检测和分析委托北京博奥生物科技有限公司进行,按照串联质谱标签试剂盒(90064,Thermo公司,美国)的说明进行样品制备和标记。采用液相色谱串联质谱技术分析获得肿瘤组织中蛋白的平均表达水平,将P<0.05及Log2差异倍数>1.20或<0.83蛋白质定义为MVI阳性与阴性肿瘤组织的显著差异表达蛋白。
1.2 显著差异表达蛋白与HCC患者预后相关性的分析
HCC患者临床信息和肿瘤组织与癌旁组织的mRNA表达谱数据通过TCGA数据库(https://cbioportal.org/)[11]下载,随后使用GEPIA数据库(http://gepia.cancer-pku.cn/)[12]分析显著差异表达蛋白在基因表达水平与HCC患者生存预后的相关性。
1.3 HCC组织芯片制作
收集浙江大学医学院附属第一医院2015年1月—2018年10月病理确诊为HCC患者的肿瘤组织及其癌旁正常组织样本200例,委托上海芯超生物科技有限公司制作组织芯片并命名为TMA-1,同时收集这200例HCC患者的生存信息。
1.4 显著差异表达蛋白的免疫反应评分测定及其与HCC患者预后的相关性分析
采用免疫组织化学方法检测显著差异表达蛋白在TMA-1中的表达情况,按照免疫组织化学染色试剂盒的操作要求对TMA-1进行染色。将4 μm组织芯片TMA-1彻底脱蜡,并在适当的缓冲液中进行热抗原修复。然后在室温下采用0.5%过氧化氢孵育20 min以阻断内源性过氧化物酶。用正常山羊血清在37 ℃下阻断40 min,然后与适当稀释的一抗在4 ℃下孵育18 h。抗体孵育后,用TBST缓冲液冲洗3次(每次5 min)。然后,用HRP偶联二抗(购买自中国ZSGB-Bio公司)在37 ℃下孵育30 min。TBST彻底清洗后,对载玻片进行DAB染色和苏木精重新染色。用相同稀释倍数的鼠或兔IgG替代一抗获得阴性对照切片。
通过半定量方法对肿瘤细胞进行免疫反应评分(IRS)[13]。IRS为细胞染色强度(0~3分)与阳性百分比(0~4分)的乘积[14]。IRS大于6分被定义为蛋白高表达,采用电话随访获取200例HCC患者预后信息,采用Kaplan-Meier方法分析显著差异表达蛋白与HCC患者预后相关性。
1.5 复发预警列线图模型构建及临床验证
对TMA-1中200例HCC患者的临床病理特征基线和显著差异表达蛋白进行单因素Cox回归分析,对单因素分析中P<0.05的因素进行多因素COX回归分析,获得HCC患者术后复发的独立危险因素。采用所有独立危险因素构建复发预警列线图,并根据列线图计算风险评分,以风险评分中位数为截断值将患者分为高风险组和低风险组,比较两组的生存预后情况。采用自助抽样验证方法对复发预警模型进行临床验证。
1.6 统计分析
应用R软件(版本3.6.3)和SPSS 21.0软件进行分析。采用Kaplan-Meier进行生存分析。采用COX比例风险回归模型进行单因素和多因素分析。采用一致性指数(C-index)评价列线图的预测能力,校准曲线评价列线图的预测符合度,采用受试者工作特征(ROC)曲线评价列线图模型的预后预测效能。以P<0.05为差异有统计学意义。
2 结 果
2.1 HCC患者肿瘤组织样本的蛋白质组学分析
蛋白质组学分析结果显示,与MVI阴性肿瘤组织对比,MVI阳性肿瘤组织中显著上调蛋白16个,显著下调蛋白23个。
2.2 显著差异表达蛋白与HCC患者预后的相关性分析
通过TCGA数据库下载HCC患者数据,采用GEPIA数据库分析上述39个显著差异表达蛋白在HCC组织与癌旁组织中基因表达水平的差异,并进一步分析这些显著差异表达蛋白的基因表达水平与HCC患者预后相关性。结果显示在HCC组织中共7个蛋白表达基因(U2SURP、RFC4、NUTF2、BCAP31、CRELD2、EEF1E1和GBA2)显著上调,3个蛋白表达基因(ADH4、HRG、FABP1)显著下调。进一步生存分析的结果显示,HCC组织之中ADH4和HRG高表达的患者的总生存率(OS)显著高于低表达的患者(P<0.05),而HCC组织中U2SURP、RFC4以及NUTF2高表达的患者OS显著低于低表达的患者(P<0.05),上述5个显著差异性表达蛋白的基因表达水平与患者的预后具有密切相关。
2.3 显著差异表达蛋白的IRS及其与HCC患者预后的相关性分析
采用免疫组织化学方法在TMA-1中对上述5个显著差异表达蛋白进行染色,结果显示(表1),U2SURP、RFC4和NUTF2在肿瘤组织中表达显著高于癌旁组织(t=7.17~15.18,P<0.001),而ADH4的表达显著低于癌旁组织(t=-19.18,P<0.001)。HRG在肿瘤组织和癌旁组织中阳性百分比较低,分别为5%和4%,故后续没有对其进行进一步分析。
采用Kaplan-Meier方法对上述4个显著差异表达蛋白与HCC患者预后进行相关性分析。结果显示,肿瘤组织中ADH4高表达患者的OS和无复发生存率(RFS)显著高于ADH4低表达患者,肿瘤组织中U2SURP低表达患者的OS和RFS显著高于U2SURP高表达患者(P<0.05)。而NUTF2和RFC4的表达与患者预后无显著相关性(P>0.05)。
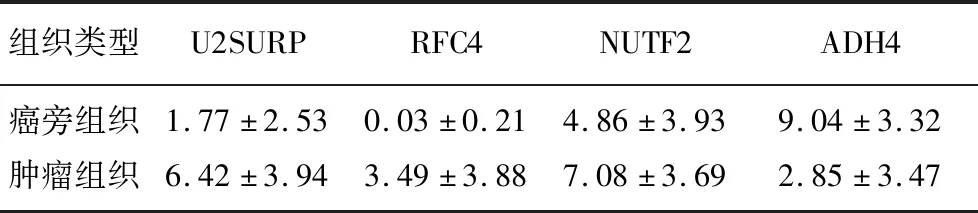
表1 显著差异表达蛋白的IRSTab.1 IRS of significantly differentially expressed proteins
2.4 复发预警列线图模型构建及临床验证
对TMA-1中200例HCC患者的临床病理特征基线指标和显著差异表达蛋白进行单因素COX回归分析,结果表明肿瘤直径≥5 cm(HR=2.214,95%CI=1.342~3.653),年龄>50岁(HR=1.095,95%CI=1.016~1.227),AFP≥20 μg/L(HR=2.347,95%CI=1.575~3.499),MVI阳性(HR=2.044,95%CI=1.434~2.916),肿瘤分化程度为中-低分化(HR=1.709,95%CI=1.200~2.433),U2SURP高表达(HR=1.880,95%CI=1.307~2.706)以及ADH4低表达(HR=2.225,95%CI=1.442~3.442)是HCC术后复发的危险因素(P<0.05),性别和肿瘤数目对HCC术后的复发无显著影响(P>0.05)。将上述因素纳入多因素COX回归分析并用森林图展示,结果显示U2SURP高表达、ADH4低表达、肿瘤直径≥5 cm和AFP≥20 μg/L是HCC患者术后复发的独立危险因素(P<0.05),详见图1A。以这4个参数构建列线图模型并在HCC患者(n=200)中验证(图1B),结果显示,HCC患者RFS预测值一致性指数(C-index)为0.71(95%CI=0.67~0.76),见图2A、B。高风险组和低风险组的预后生存分析结果显示,低风险组的RFS和OS显著高于高风险组(P<0.05)(图2C和D)。ROC曲线显示,列线图预测HCC患者术后1、3年RFS的曲线下面积(AUC)分别为0.75(95%CI=0.68~0.81)和0.76(95%CI=0.69~0.83),见图3。上述结果显示该复发预警列线图模型可以预测HCC复发情况。

A:风险比森林图,B:HCC复发预警列线图图1 HCC复发预警列线图Fig.1 Recurrence warning nomogram of hepatocellular carcinoma

A、B分别为HCC患者1年和3年RFS预测的校准曲线,C、D分别为HCC患者RFS和OS的Kaplan-Meier分析图2 HCC患者的Kaplan-Meier分析Fig.2 Kaplan-Meier analysis of hepatocellular carcinoma
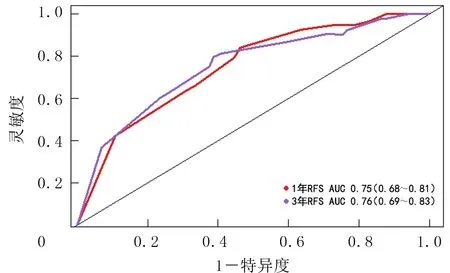
图3 HCC患者的ROC分析Fig.3 ROC analysis of hepatocellular carcinoma
3 讨 论
HCC是原发性肝癌中最常见的一种病理类型,约占原发性肝癌的75%~85%[15]。由于HCC早期诊断困难且术后复发率高,患者的预后生存情况普遍不理想[16]。以往研究表明,HCC患者的MVI阳性与预后不良显著相关[17],但是目前尚无理想的MVI分子标志物可应用于临床实践。蛋白质组学研究可比较不同细胞、组织间蛋白质表达的异同,有助于探索疾病诊断标志物和治疗靶点,具有重要应用价值。
本研究运用蛋白质组学技术揭示了MVI阳性的HCC中差异表达的蛋白分子标志物,共筛选出16个上调的差异表达蛋白和23个下调的差异表达蛋白。初步采用TCGA数据库去验证上述39个差异表达蛋白的基因表达水平,发现其中有10个差异表达蛋白在基因水平存在显著差异,其中ADH4、U2SURP等5个差异表达蛋白与患者生存预后显著相关,并进一步进行了免疫组织化学验证和预后生存分析。
ADH4是ADH家族成员,可作为多种底物的代谢酶。ADH4在卵巢癌、喉癌、食管癌等恶性肿瘤中异常表达,并且参与了大部分癌症相关生理过程[18-19]。有研究报道,与正常肝脏相比,HCC组织中ADH4的表达显著下调[20-22],提示ADH4和乙醇代谢失调可能参与了HCC的发生,HCC组织中ADH4低表达与患者较低的OS相关,ADH4表达水平可以作为患者OS的独立预测因子[20]。然而,HCC中ADH4与MVI的相关性尚无研究报道。本研究结果显示,ADH4低表达与MVI阳性显著相关,并且ADH4高表达HCC患者OS和RFS显著高于低表达患者。
研究示U2SURP是U2 snRNP相关蛋白[23],其与RBM17以及CHERP相互作用,调节彼此的稳定性,并调控下游RNA结合蛋白[24]。在癌症研究领域,U2SURP参与了结肠癌和乳腺癌的发生发展,并对患者的预后有重要影响[25]。然而,尚无研究报道U2SURP与HCC之间关系。本研究发现U2SURP高表达与MVI阳性相关,且U2SURP低表达HCC患者OS和RFS显著高于高表达患者,提示U2SURP可能是HCC术后复发预警的分子标志物。
本研究进一步建立了包含U2SURP、ADH4、肿瘤直径以及AFP值4个参数的列线图模型,并在HCC肝切除队列中进行验证,结果显示低风险组患者的RFS和OS显著高于高风险组患者。近年来,关于HCC患者的预后相关特征和生存风险模型已有相关研究报道。如,有研究通过多组学分析建立了一个8基因模型(ACADS、HSD17B13、PON3、AMDHD1、CYP2C8、CYP4A11、SLC27A5以及CYP2E1)来预测HCC患者的预后情况,该模型之中基因的高表达与较低的HCC分期/风险评分相关[26]。LI等[27]亦建立了基于年龄、性别、分期和6个基因特征等4个独立因素的列线图模型来预测HCC术后患者的OS。上述研究可能有助于临床医生对HCC术后患者的个体化治疗方案进行选择。然而,这些预测预后的模型在很大程度上都是依赖于从公共数据库中检索得到的数据,这些模型是否能够应用于临床尚无定论。因此,本研究所建立的预后模型可能成为HCC术后患者OS和RFS预测的可靠工具,或有助于临床医生筛选HCC术后高危复发患者并选择合理的个性化治疗方案。
本研究中也存在着一定的局限性:①ADH4和U2SURP两个蛋白标志物在HCC的MVI中的具体机制尚需进一步探究;②本研究构建的复发预警列线图模型采用了内部验证,后续需收集多中心大样本的数据进一步进行验证。
综上,本研究建立的模型整合了MVI相关的蛋白标志物(ADH4和U2SURP)、肿瘤直径和AFP值,经HCC肝切除队列验证后具有良好的预后预测效果,对HCC术后患者的复发预警和早期干预可能具有重要的参考价值。
利益冲突声明:所有作者声明不存在利益冲突。
ConflictsofInterest: All authors disclose no relevant conflicts of interest.
作者贡献:陈成、王建国、徐骁参与了研究设计;陈成、项萧楠、刘治坤、王建国、徐骁参与了论文的写作和修改。所有作者均阅读并同意发表该论文。
Contributions: The study was designed byCHENCheng,WANGJianguo, andXUXiao. The manuscript was drafted and revised byCHENCheng,XIANGXiaonan,LIUZhikun,WANGJianguo, andXUXiao. All the authors have read the last version of the paper and consented submission.

