血清葡萄糖-6-磷酸异构酶在类风湿关节炎疾病活动及骨侵蚀中的作用
陈亚林,张丽卿,张进荣
类风湿关节炎(rheumatoid arthritis, RA)是一种以持续性关节软骨及骨破坏为特征的自身免疫病,具有一定的遗传性[1],全球患病率为0.46%[2]。目前该病机制不明,尚无根治方法。临床上主要以达标治疗来控制疾病活动,延缓病情进展。葡萄糖-6-磷酸异构酶(glucose-6-phosphate isomerase, GPI)是一种糖酵解酶。最初在动物实验中被发现具有促关节炎作用,症状类似人类RA,并高表达于RA患者血清和关节液中。GPI及其衍生物诱导的关节炎模型为RA研究提供了重要的工具,有助于进一步探索RA的发病机制[3]。多项研究表明,RA患者血清中GPI滴度明显高于其他风湿病患者及健康者,并与RA其他自身抗体联合检测能显著提高诊断率,具有明确的辅助诊断价值[4, 5]。GPI与RA疾病活动的相关性有不同报道,对骨侵蚀的作用研究尚不多见。本研究旨在探讨血清GPI在RA疾病活动及骨侵蚀中的作用。
1 对象与方法
1.1 研究对象 选择2019-08至2021-02就诊于山西省汾阳医院风湿免疫科的RA患者105例。纳入标准:所有患者均符合2010年美国风湿病学会/欧洲抗风湿病联盟的RA分类标准。排除标准:合并其他风湿病、严重心功能不全、 肝肾衰竭者;孕妇、哺乳期、精神异常者等。用酶联免疫吸附(enzyme-linked immunosorbent assay, ELISA)法检测所有患者血清GPI值,试剂盒购自上海北加生化试剂有限公司,滴度≥0.20 mg/L为阳性,根据检测结果分为GPI阳性组和GPI阴性组。
1.2 研究方法
1.2.1 GPI抗原检测 采用ELISA法检测,具体步骤如下:将GPI校准品以及血清样品100 μl加入包被抗体聚乙烯微孔板中,置37 ℃恒温箱内孵育1 h,用自动洗涤机洗涤5次,加入酶标记抗体100 μl,再次37 ℃恒温箱内孵育1 h,配置显色液,配置比例为显色剂1片/显色缓冲剂6 ml,每孔加入显色液100 μl,室温避光储存15 min,加入终止液50 μl。以GPI 0.0 mg/L校准,用酶标仪(主波长492 mm, 副波长630 mm)测定各孔吸光度值,根据标准曲线得出结果。
1.2.2 28个关节计数法疾病活动度(28-joint disease activity score, DAS28)评分 DAS28=[0.56sqrt (TJC28)+0.28 sqrt(SJC28)+0.7×ln(ESR)]×1.08+0.16。sqrt 开平方根,ln取自然对数。
1.2.3 Sharp评分[6]所有RA患者行双手正位片检查,由1名中级以上放射科技师和1名风湿科医师共同阅片,对手和腕的17个区域进行骨侵蚀评分:无骨侵蚀0分;广泛骨侵蚀和骨丢失 5分;介于两者之间 2~4分;对手和腕的18个区域进行关节间隙狭窄评分:无狭窄 0分;局部狭窄 1分;弥漫狭窄但面积<50% 2分;弥漫狭窄但面积≥50% 3分;强直 4分。总分即为Sharp评分。
1.2.4 骨密度测定 采用双能X线骨密度仪对所有患者腰椎、单侧髋关节、单侧上肢进行检查,记录腰椎L1-L4、股骨颈、股骨全部、桡骨33%四组骨密度值。
1.2.5 治疗及随访 根据指南[7]推荐给予所有患者改善病情抗风湿药物治疗,病情严重者联合非甾体抗炎药和(或)糖皮质激素药物治疗积极控制病情活动。每隔3个月进行定期随访,根据病情及时调整治疗方案。
2 结 果
2.1 GPI与RA疾病活动的关系
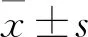
2.1.1 两组一般资料和疾病活动相关指标的比较 共入选RA患者105例,其中GPI阳性组40例,年龄24~72岁;GPI阴性组65例,年龄24~78岁。两组在性别、年龄、病程、RF、抗CCP抗体方面差异无统计学意义,GPI阳性组SJC、TJC、ESR、CRP、DAS28评分高于GPI阴性组,差异有统计学意义(P<0.05,表1)。
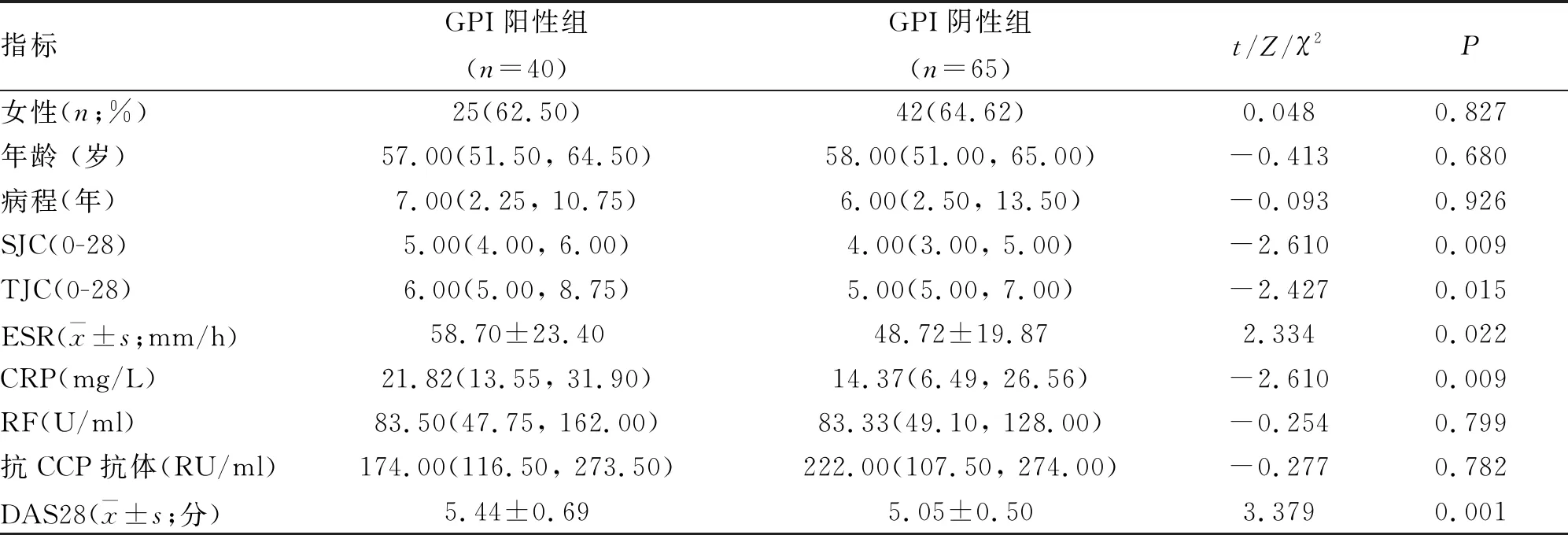
表1 两组类风湿关节炎患者的基线资料比较 [M(P25,P75)]
2.1.2 GPI与疾病活动性指标的相关性 Spearman相关分析表明,血清GPI水平与SJC、TJC、ESR、CRP、DAS28评分呈正相关(P<0.05,表2),与RF、抗CCP抗体无明显线性相关。
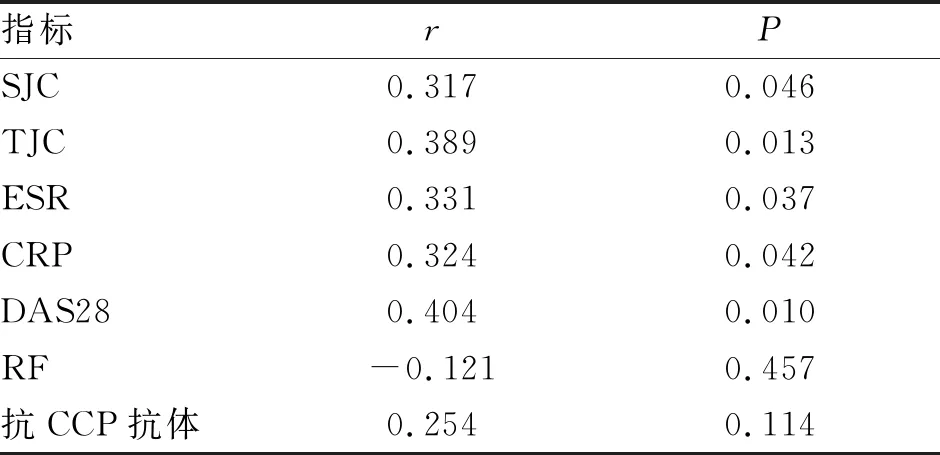
表2 类风湿关节炎患者GPI水平与疾病活动性指标的相关性
2.1.3 两组患者治疗前后DAS28评分变化情况 治疗后DAS28评分均呈下降趋势,与治疗前比较差异有统计学意义(P<0.05)。治疗3个月后,GPI阳性组DAS28评分高于GPI阴性组(P<0.05);治疗6、9、12个月后两组患者DAS28评分差异无统计学意义(表3)。
表3 两组类风湿关节炎患者治疗前后DAS28评分变化情况 分)
2.2 GPI与骨侵蚀的关系
2.2.1 两组患者治疗前后Sharp评分的比较 治疗前及治疗1年后Sharp评分组间及组内比较差异均无统计学意义(表4)。

表4 两组类风湿关节炎患者治疗前后Sharp评分比较 [M(P25,P75);分]
2.2.2 两组患者治疗前后骨密度比较 两组患者治疗前及治疗1年后腰椎L1-L4、股骨颈、股骨全部、桡骨33%组间以及组内骨密度比较差异均无统计学意义(表5)。
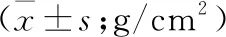
表5 两组类风湿关节炎患者治疗前后骨密度比较
3 讨 论
RA是一种受遗传和环境因素影响的炎症性自身免疫性疾病,关节炎症持续反复发作会导致软骨和骨质侵蚀及关节畸形。RA还可累及皮肤、血管、眼部、心脏、肺部等关节外组织与器官,引起严重的功能损伤甚至死亡[8]。RA的长期性及反复性导致患者并发焦虑、抑郁等心理疾病风险增加,进一步加重患者的心理及经济负担[9]。因此,早期诊断、正确评估病情和治疗是当前诊治RA的重点。
GPI是一种分子量为132 ku的二聚酶,参与糖酵解中的第二步D-葡萄糖-6-磷酸和D-果糖-6-磷酸的相互转化,是能量循环中必需的胞质酶。最初在动物实验中发现类似人RA的关节炎症状,与GPI存在明显的联系,并在RA患者血清以及滑膜中检测到了高滴度的GPI抗原。随后研究证实GPI对RA具有辅助诊断价值[4, 5]。国内外多名研究者用人重组GPI抗原以及单一或者混合肽段GPI衍生物诱导出多种GPI相关性RA动物模型,极大地简化了RA的研究,帮助研究者探索涉及RA炎症、免疫耐受的复杂自身免疫系统[3,10, 11]。
多项研究表明,缺氧促进RA滑膜细胞的增殖,RA患者关节腔中低氧微环境可促进糖酵解酶GPI的表达;GPI在RA滑膜成纤维样细胞(fibroblast-like synoviocytes, FLS)中含量丰富,是FLS的自分泌因子,可刺激RA-FLS的增殖并抑制细胞凋亡,增加炎性细胞因子的分泌[12, 13]。同时在GPI诱导的小鼠关节炎中发现,GPI可上调小鼠激活转录因子-3(activatingt ranscription factor 3, ATF-3)的表达,进而对感觉神经元产生早期和持续的影响,使得关节疼痛症状早于关节炎发生,未经治疗者出现更严重的热痛觉过敏[14]。
RA患者中关节肿胀、压痛数目多,以及炎性指标如ESR、CRP水平升高均反映疾病活动。本研究结果表明,GPI阳性组SJC、TJC、ESR、CRP、DAS28评分高于GPI阴性组,并与血清GPI滴度呈正相关,这与之前的研究结果一致[15],提示GPI是反映疾病活动的一项指标。然而Soleimani等[16]对此持不同观点。可能与二者GPI检测试剂盒不同,检测步骤存在明显差异,可能会影响滴度,另一个原因是疾病活动度评估方法不同,进而结论不一致。给予所有患者规范治疗并定期随访,发现两组患者治疗后DAS28评分均明显下降。但治疗3个月后GPI阳性组DAS28评分高于阴性组,差异有统计学意义,进一步证实GPI和疾病活动相关,并提示GPI可能具有评估病情预后的作用。根据患者病情予调整治疗方案,在治疗6、9、12个月后,两组患者DAS28评分差异无统计学意义。表明经过积极规范治疗,两组患者活动度均可得到有效控制,两组间无差异。
RA是骨质疏松的危险因素,出现骨侵蚀的患者更容易发生骨量丢失,且高疾病活动度与骨质疏松性骨折显著相关,而有效控制疾病活动与较高的骨矿物度有关[17-19]。研究发现,治疗后缓解持续时间越长、放射学损伤越少,对功能的影响越小[20]。双手正位片目前仍然是RA影像学检查的首选方法,其中简化Sharp评分是最为常用评估骨侵蚀的方法[6]。骨密度检查是诊断骨质疏松最为可靠的方法,可反映RA患者骨丢失的情况,常规检查腰椎、髋关节,而RA最常累及双手腕、掌指关节、近端指间关节等小关节,因此骨密度检查时我们加做上肢更能准确反映RA患者骨密度情况。
既往很少针对GPI阳性的RA患者进行治疗前后骨密度及Sharp评分的研究。本课题在治疗前对所有RA患者行双手正位片检查并进行Sharp评分,同时完善了腰椎、单侧上肢、单髋骨密度检查并记录腰椎L1-L4、股骨颈、股骨全部、桡骨33%四组骨密度值,并在治疗1年后予以复查。结果表明两组患者治疗前Sharp评分比较差异无统计学意义,与Xu等[21]的研究结果一致,表明GPI与骨侵蚀无关。两组患者治疗前骨密度比较差异无统计学意义,支持上述结论。在治疗1年后,两组患者放射学指标均无明显进展,考虑与积极治疗控制炎症及病情活动有关,从而抑制骨侵蚀进展。
综上所述,GPI可作为反映RA疾病活动度的指标,具有一定程度的评估预后作用,对骨侵蚀无预测价值。鉴于本研究放射学观察周期短,且治疗方案存在异质性,可继续延长观察周期,在相同治疗方案下进一步观察两组影像学进展情况可能会有不同的发现。

