Monaco系统中高密度介质的剂量学研究
许六军,张建英,李婷婷,张玉洁
(复旦大学附属中山医院放疗科,上海 200032)
0 引言
处理电离辐射在介质中的能量沉积时,通常有2种剂量计算方法,分别是“基于水”和“基于介质”的剂量计算方法[1-2]。传统的治疗计划系统(treatment planning system,TPS)多采用“基于水”的剂量计算方法,将人体组织视为各种密度的水进行处理[3-4]。由于历史原因,临床试验中靶区及危及器官的剂量均“基于水”计算,而这些剂量标准被沿用至今。但近20 a的研究表明,相比“基于水”的剂量计算方法,蒙特卡罗(Monte Carlo,MC)方法中固有的“基于介质”的剂量计算方法更为准确。该方法通过描述粒子间相互作用的过程,将人体组织视为不同密度的不同元素进行处理。“基于介质”的剂量计算比传统经验中使用的“基于水”的剂量计算具有更多的临床相关性,更接近沉积在人体中的真实剂量[5-6]。由于这2种剂量计算方法具有各自的意义,临床上使用哪种方法仍然存在着争议[7]。
Monaco系统是临床中常用的TPS,它可以同时提供“基于水”和“基于介质”的剂量计算方法。出于剂量准确性的考虑,Monaco系统推荐采用“基于介质”的计算方法[5],但是一般临床中应用的危及器官剂量约束却以“基于水”的剂量计算方法为基础[7]。如果“基于介质”的剂量以“基于水”的标准来评估,则可能对临床结果造成影响。这是因为“基于水”的剂量计算方法直接将高密度介质视为高密度的“水”,与真实的“基于介质”的剂量计算方法处理方式不同,可能对剂量计算结果产生影响。本研究随机选取涉及5个肿瘤部位的50例患者,研究相对电子密度(relative electron density,RED)与2种剂量计算方法计算结果之间差异的关系,评估高密度介质可能引起的剂量差异。再利用所得差异设计保护高密度介质的治疗计划,提出保证高密度介质剂量安全的计划方案。
1 资料与方法
1.1 临床资料
回顾性分析2019—2021年在本科室采用VersaHD直线加速器治疗的50例患者的临床资料。纳入标准:(1)为尽可能保证病例的多样性,所选病例涵盖头颈部、胸部、腹部、盆腔部和骨组织5个不同的肿瘤部位;(2)病例的放疗影像、靶区及危及器官勾画、放疗计划和剂量分布信息完整。排除标准:(1)CT影像采集条件和分辨力不符合本研究标准;(2)放疗计划计算网格不符合本研究标准;(3)放疗影像或者剂量文件无法以标准DICOM格式导出。最终纳入头颈部、胸部、腹部、盆腔部和骨组织5个不同部位的肿瘤患者各10例。
1.2 图像采集和RED的获得
图像由西门子大孔径CT采集,网格大小为0.977 mm×0.977 mm,层厚为3 mm。每层CT上的每个网格对应的CT值可用HU表示,根据HU与RED的关系曲线,可以得到每个网格点的RED值。所有CT图像均以DICOM格式导出,并在自主编写的Python程序中提取HU和RED的值,完成直方图统计。
1.3 计划设计与剂量获取
计划的优化过程与最终计算均在Monaco系统中完成。所有计划均采用“基于介质”的剂量计算方法进行优化,得到“基于介质”的剂量分布。在不改变其他参数的情况下,将吸收剂量计算方法从“基于介质”改为“基于水”,不进行优化,直接重新计算得到“基于水”的剂量分布。剂量信息以DICOM格式导出,并在自主编写的Python程序中进行分析。
计划优化的其他参数如下:采用调强放疗(intensity-modulated radiation therapy,IMRT)或者容积旋转调强放疗(volumetric modulated arc therapy,VMAT)技术,算法为MC方法,剂量计算网格为2 mm×2 mm×2 mm,统计不确定性为1%,最小子野宽度为0.6 cm。VMAT计划最多使用4个弧,每个弧最多150个控制点,IMRT计划每个射野的最大子野数为45。
病例的CT图像网格大小为0.977 mm×0.977 mm×3 mm,而剂量网格大小为2 mm×2 mm×2 mm,两者不一致。在统计剂量差异与RED的关系时,为方便处理,采用线性插值将网格大小统一为0.977 mm×0.977 mm×2 mm,并排除剂量小于处方剂量5%的低剂量。人体组织的RED范围为0~2,将其分成100个区间,取中间值为RED区间,将对应像素点的剂量差异取平均,作为该区间的剂量差异。
在设计保护高密度介质的计划中,选用的高密度介质为下颌骨。以10例头颈部肿瘤患者的临床计划为初始计划。利用RED与剂量差异的定量关系和下颌骨临床剂量要求,对下颌骨全部体积添加优化条件:最大剂量Dmax<62.95 Gy。采用“基于介质”的剂量计算方法得到剂量分布,然后转为“基于水”的剂量计算方法重新计算得到新的剂量分布。评估保护下颌骨的计划与原计划的靶区剂量和下颌骨剂量。头颈部肿瘤一般有多个不同处方剂量的计划靶区(planning target volume,PTV),本研究中的靶区为所有PTV的体积叠加,得到新结构PTV_ALL。所有计划剂量均归一至最低处方剂量覆盖PTV_ALL的95%体积。
1.4 计划评估
靶区评估使用适形性指数(conformity index,CI),其计算公式如下:
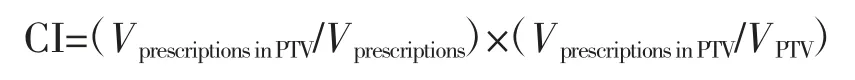
式中,VPTV为PTV体积;Vprescriptions为处方剂量所包绕的体积;VprescriptionsinPTV为PTV中处方剂量包绕的体积。头颈部肿瘤的多阶梯处方对使用CI评估靶区适形度有影响。如PTVnx(通常指鼻咽原发病灶外扩形成的PTV)处方剂量为69.96 Gy、PTVnd(通常指颈部可见淋巴结外扩形成的PTV)处方剂量为66.00 Gy时,PTVnd的Vprescriptions会包含PTVnx引起的66.00 Gy剂量线,使得CI严重变小。故在实际评估中,使用最低处方剂量评估PTV_ALL的适形度。此时CI依然可能因为高处方靶区的剂量跌落而略微偏低。下颌骨的评估则使用Dmax。
1.5 统计学方法
采用SPSS 22.0进行数据分析。评估保护高密度介质的计划时,对靶区CI和下颌骨Dmax进行配对t检验,P<0.05表示差异有统计学意义。
2 结果
2.1 “基于介质”和“基于水”的剂量计算方法间的剂量分布差异
将5个肿瘤部位“基于介质”和“基于水”的剂量计算方法计算的剂量分布记为Dm和Dw,其绝对剂量差异和相对剂量差异如图1所示。每种肿瘤以1个病例为例,5个肿瘤部位结果近似。对于相对剂量差异(第四列),在低密度介质中差异很小,而在盆腔肿瘤患者的耻骨,骨组织肿瘤、胸部肿瘤患者的椎骨以及头颈部肿瘤患者的下颌骨等高密度介质中差异较大,其中骨皮质的相对剂量差异最大。对于绝对剂量差异(第三列),头颈部肿瘤病例需特别注意,头颈部肿瘤最高处方剂量达70 Gy,“基于介质”和“基于水”的剂量计算方法计算的剂量差异在下颌骨中可高达8 Gy。
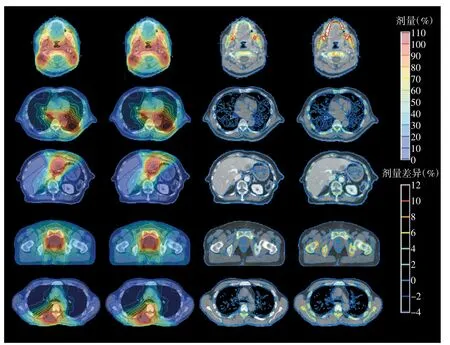
图1 5个肿瘤部位的剂量分布
2.2 相对剂量差异与RED的关系
5个肿瘤部位的相对剂量差异与RED的关系曲线如图2(a)所示,不同肿瘤部位的曲线基本一致,均呈凹形。在RED为0.01时,Dw比Dm高约1.5%;RED约等于0.27时,Dw和Dm相当;当RED为0.8时,Dw和Dm的相对剂量差异约为-2%。而后随着RED的增大,相对剂量差异减小,并在RED等于1.0时相对剂量差异接近于0。随着RED的继续增大,相对剂量差异持续增加,当达到极限值1.99时,头颈部和骨组织肿瘤的Dw比Dm高约13%。
图2(b)~(f)详细地显示了5个肿瘤部位的情况。在每个曲线中,计数最高的RED区间像素点往往是计数最小的几千倍,而较少的计数可能会导致较大的统计误差。最典型的情况即图(d)中黑色圆圈圈出的部分,当RED为1.77时,对应像素点计数为13,腹部肿瘤的相对剂量差异与其他部位肿瘤的差别较大。对于头颈部肿瘤,下颌骨骨皮质对应的RED为1.8,Dw与Dm的相对剂量差异约为11.2%。
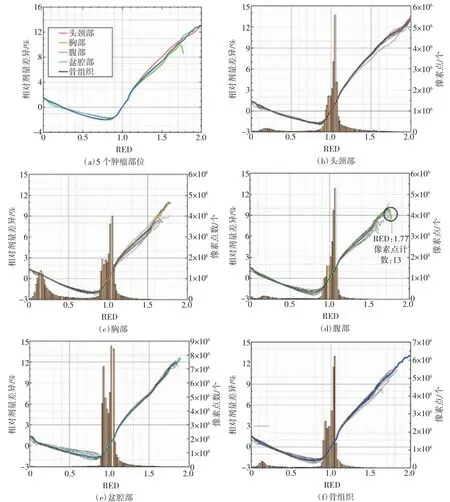
图2 5个肿瘤部位的相对剂量差异与RED的关系曲线
2.3 保护高密度介质计划的评估
将临床计划和保护下颌骨的计划分别记为Plan_C和Plan_M,PTV的CI和下颌骨Dmax的配对t检验结果详见表1。2种计划的PTV_ALL的CI差异无统计学意义;对于下颌骨Dmax,Plan_M较Plan_C平均低5.23 Gy(P<0.05)。这表明保护下颌骨的计划可以在不影响靶区适形性的情况下有效降低下颌骨Dmax。
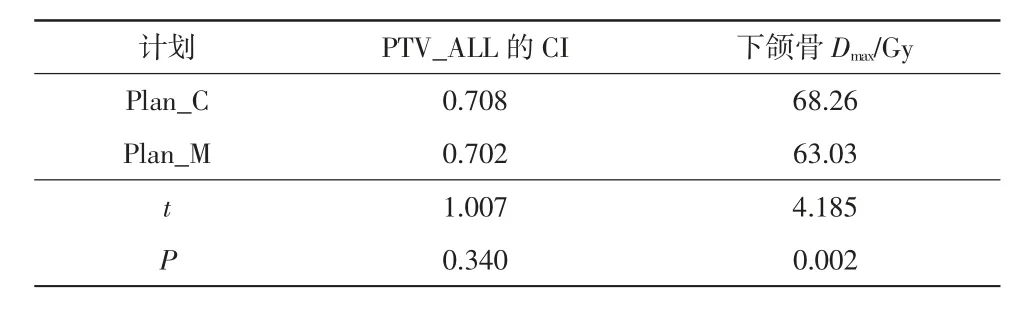
表1 2种计划的靶区CI和下颌骨Dmax的配对t检验结果
3 讨论
美国医学物理学会(The American Association of Physicists in Medicine,AAPM)在TG-329[8]报告中指出,“基于水”和“基于介质”的剂量计算方法计算的剂量存在差异是因为不同介质由不同元素组成,而不同元素的电子密度不一样,导致它们的相互作用截面有差异。对人体而言,元素组成的差异(如软组织、骨皮质和肺等)会导致各种粒子间相互作用(光电效应、康普顿散射和电子对效应等)的反应截面不同。在宏观上,相互作用截面的差异表现为阻止本领的差异,该差异在密度较大的介质中不可忽略[9-12]。
相比传统“基于水”的剂量计算方法,“基于介质”的剂量计算能够更准确地评估沉积在人体中的真实剂量。比如在Monaco系统中,厂商推荐使用“基于介质”的剂量计算,因为该方法在计算粒子输运时,同时考虑了介质的密度和元素组成[13],将人体中不同组织的密度映射到不同的电子密度,更符合实际的剂量沉积情况。但是目前的肿瘤放疗中靶区的处方剂量和危及器官剂量的限量均以“基于水”的剂量计算方法计算的剂量为基础,而简单地直接将“基于介质”的剂量计算方法计算的剂量用以评估“基于水”的剂量计算方法计算的剂量,将产生剂量学上的偏差。
如何在满足剂量准确性的同时,确保高密度介质符合传统剂量标准是本研究的出发点。随着TPS计算能力的提升,一些商业化TPS,如Monaco和Eclipse系统可以同时实现“基于介质”和“基于水”的剂量计算[5]。本研究基于Monaco系统研究5种不同部位的肿瘤病例,研究“基于水”和“基于介质”的剂量计算方法计算的相对剂量差异与RED的关系,评估不同介质中2种剂量计算方法计算的剂量差异。该差异在密度接近水的介质中很小,而在高密度介质中,Dw与Dm的相对剂量差异约为11.2%,该结论对多种肿瘤适用,特别是头颈部肿瘤患者的下颌骨,“基于介质”和“基于水”的剂量计算方法计算的剂量差异可能高达8 Gy。因此,应用“基于水”或者“基于介质”的剂量计算方法,可能对放疗计划中正常组织的受量评估产生影响。
以往一些研究也报道了不同TPS中“基于水”和“基于介质”的剂量计算方法计算的剂量差异。总体而言,对于兆伏级光子束,在密度与水接近的人体组织中,这2种方法计算的剂量差异可以忽略不计[14]。但是对于高密度介质(例如皮质骨),2种方法计算的剂量差异高达15%[5,13,15]。Yu等[16]的研究表明,在Eclipse计划系统中,采用“基于水”的剂量计算方法计算的下颌骨的剂量比“基于介质”的剂量计算方法高10%。Radojcˇic'等[12]的研究结果指出,在Monaco 系统中,采用“基于水”和“基于介质”的2种剂量计算方法,在下颌骨和内耳中也得到相似的剂量分布差异。这些结果与本文的研究结果类似。因此在临床应用中,如果靶区附近有高密度介质,“基于水”的剂量计算结果通常会偏大,对高密度介质采用“基于水”的剂量评估会更“安全”;如没有,则建议采用“基于介质”的剂量计算,评估结果更接近真实情况。
“基于介质”和“基于水”的剂量计算方法计算的剂量差异主要体现在高密度介质中,针对如何才能既保证剂量沉积的准确性,又保证危及器官受量符合相关临床试验的约束条件,本研究以下颌骨为例,设计了一种针对高密度介质的计划方案。在计划优化中考虑了下颌骨的高密度可能引起的剂量差异后,有效地降低了下颌骨的Dmax,并且靶区适形度和原临床计划没有显著性差异。这一计划设计方案有效保证了在使用“基于介质”的方法进行剂量计算时下颌骨达到临床试验的剂量约束要求,为临床工作提出了可行方案。
本研究也有一些局限性,比如设计保护下颌骨的计划时所添加的优化条件为Maximum Dose,该条件在Monaco系统中非常严格,对靶区剂量影响较大,特别是当靶区与下颌骨有重叠时。这种情况下,可酌情将最高剂量约束值提高,或者约束1 cm3体积对应的剂量,并参考AAPM TG-105[5]中的建议,同时出具“基于介质”和“基于水”2种剂量计算方法的计划报告。另一方面,本研究只针对头颈部的下颌骨设计了保护计划,该结论对其他高密度介质是否适用有待进一步研究。
综上所述,对于高密度介质,“基于水”和“基于介质”的2种方法计算剂量会产生不可忽略的剂量学差异。设计保护高密度介质下颌骨的计划,可在不影响靶区适形性的情况下有效降低下颌骨的最大剂量。

