体外RhE试验应用于医疗器械皮肤刺激检测的可行性研究
范春光,刘 佳,侯 丽,刘成虎,李春令,汪晓飞,施燕平,刘 斌
(山东省医疗器械和药品包装检验研究院,国家药品监督管理局生物材料器械安全性评价重点实验室,山东省医疗器械生物学评价重点实验室,济南 250101)
0 引言
医疗器械中的某些材料及其可沥滤物在与人体接触时可能会对人体产生危害,所以在相关医疗器械上市前须进行生物学评价试验[1-2],以确保其安全性。皮肤刺激试验是医疗器械生物学评价试验的基础项目。
目前,医疗器械皮肤刺激试验共分三大类:人体试验、体内动物试验和体外试验[3]。其中,最常用的是体内动物试验中的家兔Draize皮肤刺激试验。此试验先将医疗器械浸提液和浸提介质对照分别置于白兔去毛后背部完好的皮肤上,用半封闭或封闭敷料包裹一定时间后清理试验部位,然后在规定的时间点对试验部位的红斑和水肿情况通过肉眼观察进行记分,将浸提液记分结果与浸提介质对照的记分结果进行比较和计算,最后判定反应类别。
近年来,随着人们动物保护意识的不断增强,替代、减少和优化的3R原则逐渐深入人心,各种体外替代试验发展起来。体外重建人表皮(reconstructed human epidermis,RhE)刺激试验就是其中的一种。体外RhE模型是采用人正常角蛋白细胞体外培养形成的三维皮肤模型,其包括基底层、棘层、颗粒层和有功能的角质层,是为检测纯化学物皮肤刺激性而研发的[4-6]。经一定的调整,体外RhE模型也被用于检测医疗器械的皮肤刺激性[5,7-11]。而体外RhE试验是将医疗器械浸提液和介质对照分别置于体外RhE模型表面孵育一定时间后清除,再检测模型中细胞的相对活性,根据相对活性判定医疗器械皮肤刺激性。
本研究选取一种典型的接触皮肤的医疗器械及2种浓度的阳性物质,分别采用体外RhE试验和体内动物试验检测该医疗器械和阳性物质的皮肤刺激性。通过比对体外、体内试验结果,分析2种方法的利弊,探讨体外RhE试验应用于医疗器械皮肤刺激检测的可行性及其在我国替代动物试验的可能性。
1 仪器与材料
1.1 试验样品及材料
本研究选用某医疗器械生产企业提供的水胶体敷料作为试验样品1(记为T1),选用皮肤刺激阳性物质乳酸(Fluka,分析纯,500 mL,货号:69785)作为试验样品2(记为T2)。27块SkinEthicTMRHE模型(批号:20ChRHE060511)购于上海斯安肤诺生物科技有限公司。12只新西兰白兔[许可证号:SCXK(鲁)20180006]购于济南金丰实验动物有限公司。
1.2 仪器设备
本研究使用的仪器设备主要包括生物安全柜(山东博科,BSC-1100ⅡB2-X)、细胞培养箱(Thermo,Heracell VIOS 160i)、酶标仪(Thermo,Multiskan MK3)、水平摇床(上海智诚,ZHWY-100B)、移液器(Eppendorf,3122000.060)和涡旋振荡器(IKA,MS3)等。
1.3 试剂及耗材
本研究使用的试剂及耗材主要包括组织培养基(上海斯安肤诺,批号:20ChRHE060511)、杜氏磷酸盐缓冲溶液(Gibco,1×,1 000 mL,货号:2085604)、0.9%氯化钠注射液(山东辰欣,500 mL,货号:190823 2162)、芝麻油(ACROS,250 mL,货号:A0409661)、20%十二烷基硫酸钠水溶液(Sigma,500 mL,货号:BCBZ7807)、噻唑兰(Sigma,1 g,货号:M5655)、异丙醇(上海沪试,500 mL,货号:20180530)、吸水纸、棉棒等。
2 试验方法
2.1 样品制备
2.1.1 试验样品的制备
T1:取30 cm2水胶体敷料(双面),按1 cm×1 cm大小进行裁剪,置于玻璃瓶中,按照3 cm2/mL的比例加入10 mL极性浸提介质(0.9%氯化钠注射液),额外加入5.5 mL吸收量(预实验中测得在下述样品制备条件下30 cm2双面水胶体敷料可吸收5.5 mL 0.9%氯化钠注射液),确保极性浸提介质完全覆盖样品,于(37±1)℃、60 r/min的振荡条件下浸提(72±2)h制备极性浸提液[12],记为T1a;另取30 cm2水胶体敷料(双面),按1 cm×1 cm大小进行裁剪,加入10 mL芝麻油,在相同条件下制备非极性浸提液,记为T1b。
T2:取30μL乳酸母液与1 970μL 0.9%氯化钠注射液经涡旋振荡充分混匀配制体积分数为1.5%的乳酸溶液,记为T2a;另取80μL乳酸母液与1 920μL 0.9%氯化钠注射液经涡旋振荡充分混匀配制体积分数为4%的乳酸溶液,记为T2b。
2.1.2 对照样品的制备
介质对照(VC)样品:将0.9%氯化钠注射液置于浸提容器中,并与试验材料同时进行相同的浸提过程制备介质对照样品,记为VCa;采用相同的方法制备芝麻油介质对照样品,记为VCb。
阴性对照(NC)样品:杜氏磷酸盐缓冲溶液不作处理,作为阴性对照,记为NC。
阳性对照(PC)样品:取500μL 20%十二烷基硫酸钠水溶液与9.5 mL 0.9%氯化钠注射液涡旋振荡充分混匀,制备体积分数为1%的十二烷基硫酸钠水溶液极性阳性对照样品,记为PCa;使用芝麻油在相同方法下制备体积分数为1%的非极性阳性对照样品,记为PCb。
2.2 体外RhE试验方法
2.2.1 体外RhE模型预孵育
样品制备完成前1 d,接收体外RhE模型。在无菌条件下,取出盛有表皮组织的小室,用吸水纸小心除去黏附在小室外侧缘的残留琼脂,将小室置于预先加入1 mL配套培养基的6孔板中,再将6孔板置于(37±1)℃、(5±1)%CO2、相对湿度为95%的细胞培养箱中孵育过夜。
2.2.2 加样
将孵育后的小室转移至预先加入1 mL培养基的6孔板中,吸取100μL试验样品或对照样品覆盖小室中表皮组织表面(每个样品设3个重复),确保完全接触。加样完成后,将6孔板转移至细胞培养箱中孵育(24±2)h。
2.2.3 冲洗
孵育后,使用无菌杜氏磷酸盐缓冲溶液冲洗小室内的表皮组织25次,去除残留样品。冲洗后排干小室内水分,转移小室至预先加入培养基的24孔板(0.3 mL/孔)中,准备进行噻唑兰孵育。
2.2.4 噻唑兰测定组织活性
用培养基将5 mg/mL的噻唑兰母液稀释至1 mg/mL。取24孔板,每孔加入300μL的噻唑兰工作液。从24孔板中移出小室,拭干小室底部,然后转移至预先加入噻唑兰的24孔板中,再将其置于细胞培养箱中孵育3 h±5 min。孵育后,吸干小室内及底部残留的噻唑兰溶液,转移至预先加入750μL异丙醇的24孔板中,并密封24孔板防止蒸发。用水平摇床于120 r/min、室温条件下轻轻振荡萃取甲臜2 h±5 min。孵育后,充分混匀萃取液,取200μL萃取液至平底96孔板中(设3个复孔)。将异丙醇溶液作为空白对照,设6个复孔。使用酶标仪选择570 nm波长滤光片读取光密度(optical density,OD)。
2.2.5 数据计算
计算6个空白对照孔OD的均值,其余各孔OD均扣除空白均值得到修正OD值,计算每块组织3个修正OD的均值。将NC样品接触的3块组织的均值设为100%活性,每块组织修正OD的均值除以3块组织OD的均值可以得到每块组织的相对活性,计算各样品接触的3块组织的相对活性均值作为各样品接触的组织的相对活性。
2.2.6 试验接受准则
NC样品和VC样品:3块组织OD的均值≥0.8~<2.8;3块组织相对活性的标准差(standard deviation,SD)≤20%;VC样品接触的组织的相对活性为80%~120%。PC样品:相对活性<40%;3块组织相对活性的SD≤20%。试验样品:3块组织相对活性的SD≤20%。
2.2.7 结果判定标准
试验样品接触的组织相对活性≤50%即表示刺激反应阳性。医疗器械/材料的2种浸提液中至少一种显示阳性结果(相对活性≤50%且SD≤20%),则认为此医疗器械/材料有皮肤刺激性(阳性)。
2.3 体内动物试验
2.3.1 动物准备
试验前24 h,除去新西兰白兔背部脊柱两侧被毛(约10 cm×15 cm的区域),用作试验和观察部位。每个试验样品、每种介质浸提液使用3只动物。本动物试验经实验室实验动物伦理委员会批准。
2.3.2 试验样品的应用
将500μL试验样品或相应介质对照样品滴到2.5 cm×2.5 cm纱布块上。在动物背部左上和右下部位放置试验样品纱布,右上和左下部位放置对照样品纱布。用绷带覆盖敷贴部位至少4 h。接触期结束后取下纱布,用温水清洗除去残留试验样品或对照样品并小心拭干,同时标记接触部位。
2.3.3 结果观察
在除去敷贴片后(1±0.1)、(24±2)、(48±2)和(72±2)h,根据皮肤反应记分系统记分,详见表1。

表1 皮肤反应记分系统记分细则
2.3.4 结果评价
分别将每只动物试验样品和对照样品接触部位在(24±2)、(48±2)和(72±2)h的全部红斑和水肿情况的记分相加,将记分之和除以6(2个试验/观察部位,3个时间点),计算出某一动物的原发性刺激记分。将3只动物原发性刺激记分相加后除以3得出试验样品或对照样品的原发性刺激记分。将试验样品原发性刺激记分减去对照样品原发性刺激记分,即得出试验样品原发性刺激指数。刺激指数为0~0.4,反应分级为极轻微;刺激指数为0.5~1.9,反应分级为轻度;刺激指数为2.0~4.9,反应分级为中度;刺激指数为5.0~8.0,反应分级为重度。
3 试验结果
3.1 体外RhE试验
NC样品和VC样品接触的3块组织OD的均值≥0.8~<2.8;VCa样品和VCb样品接触的组织相对活性为80%~120%;PCa和PCb样品接触的组织相对活性<40%;阴、阳性对照样品及试验样品接触的3块组织相对活性的SD均<20%。数据符合试验接受准则,试验成立。T1a、T1b和T2a接触的组织相对活性均>50%,表明均无皮肤刺激性(阴性);T2b接触的组织相对活性<50%,表明有皮肤刺激性(阳性)。体外RhE试验结果如图1所示。
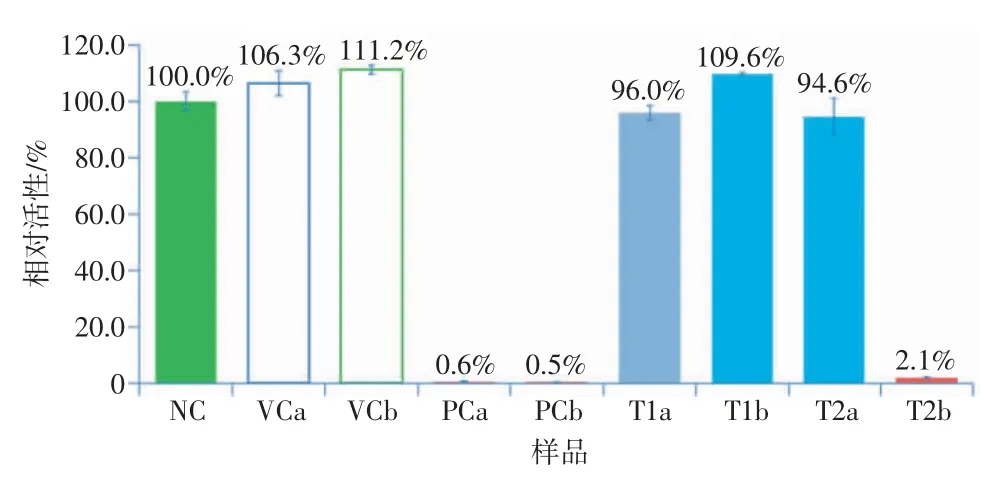
图1 体外RhE试验结果
3.2 体内动物试验
每只动物试验样品位点在(24±2)、(48±2)和(72±2)h的红斑和水肿情况记分均为0,每只动物对照位点在上述3个时间点的红斑和水肿情况记分也均为0,可计算出各试验样品原发性刺激指数均为0,对应反应分级均为极轻微(阴性),详见表2。去除敷贴片(24±2)h后各样品试验位点及相应对照位点皮肤表现如图2所示。
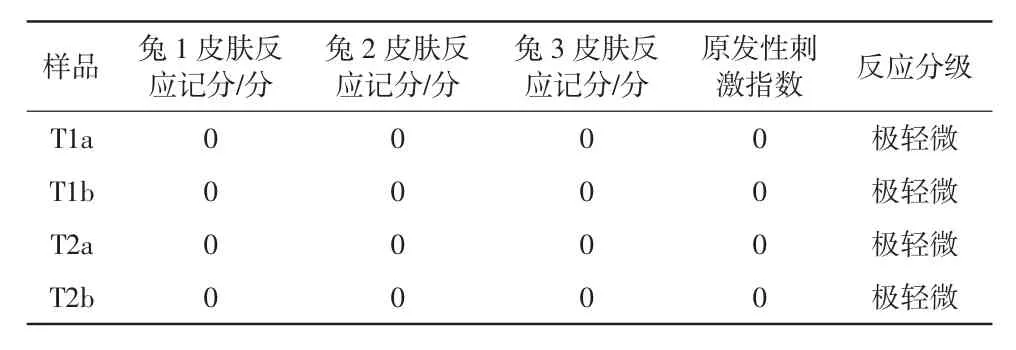
表2 体内动物试验结果

图2 去除敷贴片(24±2)h后各样品试验位点及相应对照位点皮肤表现
4 讨论
本研究分别采用体外RhE试验和体内动物试验检测一种典型医疗器械及一种阳性物质的皮肤刺激反应,探讨体外RhE试验应用于医疗器械皮肤刺激性检测的可行性。体外RhE试验结果显示,试验样品T1a、T1b和T2a均无皮肤刺激性(阴性),而T2b有皮肤刺激性(阳性)。体内动物试验结果显示,各试验样品的皮肤刺激性均为阴性(极轻微)。这表明体外RhE试验相较于体内动物试验更敏感。以往研究结果显示,4%的乳酸溶液在人体斑贴试验中显示为皮肤刺激物[6,13-14],与本研究中体外RhE试验结果是一致的。众所周知,人体试验的结果最为客观,2种试验方法结果的一致性表明体外RhE试验能够更加准确地反映试验样品对人体皮肤产生的刺激性。
综合试验过程与结果,与体内动物试验相比,采用体外RhE试验检测医疗器械皮肤刺激性具有以下优势:(1)不使用家兔等动物,符合替代、减少、优化的3R原则;(2)体外RhE模型是人源三维皮肤模型,与人无种属差异,而且具有皮肤组织结构,能最大程度地模拟人体反应,试验结果能更准确客观地反映人体实际情况;(3)体外RhE模型间差异小,与动物个体差异较大不同,其结果更稳定;(4)对试验设施及设备要求不高,易于满足,相较于体内动物试验,省去了动物房设施运行及动物饲喂等人力、物力等资源的消耗;(5)试验步骤操作简便、易于掌握,适用于医疗器械浸提液的检测;(6)为半定量试验,结果显示为数值,相较于体内动物试验通过肉眼观察进行记分判断更为客观和准确。
经济合作与发展组织试验导则439(Organization for Economic Cooperation and Development Test Guideline 439,OECD TG 439)中收录了6种体外RhE模型,这些模型均已通过验证试验证明其能够有效区分多种已知的典型刺激及非刺激化学物。近年来,经验证与调整,这类模型也被用来检测医疗器械的皮肤刺激性[5,7-11]。其中,EpiDermTM(EPI-200)和SkinEthicTMRHE 2种模型已被列入最新发布的ISO 10993-23:2021医疗器械生物学评价刺激试验中。这2种模型分别是美国MatTek公司和法国EpiSkin公司研发的同类产品。在一项大型国际比对试验中,使用医疗器械浸提液对EpiDermTM(EPI-200)模型和SkinEthicTMRHE模型进行验证,结果表明2种模型均能正确识别几乎所有的刺激聚合物样品,其检测结果的准确性、实验室内变异性及实验室间变异性均等同[7]。因此,根据逐步评价的基本原则,最新国际标准中要求首先采用化学表征、文献检索的方法对试验材料的刺激性风险进行评估。若无法实现,则采用体外RhE试验进行检测和评估[3]。当不能采用以上方法获取的信息进行风险评估时,才考虑进行体内动物试验[3],这就为体外RhE试验替代体内动物试验奠定了标准基础。随着相关条件的不断成熟,此国际标准未来将被转化为我国的国家标准。本研究采用的SkinEthicTMRHE模型产地在上海,采用保温措施通过邮寄可在1~2 d内送达国内大多数城市,该模型易于获取且运输过程不会对模型质量产生影响。据了解,国内也有多家企业正在或已经研发出此类体外RhE模型,在通过相关验证试验后[3-4,15],也可用于医疗器械皮肤刺激性检测。
本研究尚存在以下不足:研究仅限于现象描述,未涉及机制研究,下一步将深入探讨医疗器械体外RhE试验皮肤刺激反应的分子机制。
总之,本研究表明体外RhE试验能应用于医疗器械皮肤刺激性检测,且相较于体内动物试验有更多优势。随着国内相关条件的不断成熟,体外RhE试验有望在不远的将来替代体内动物试验。

