鹿红方对缺血缺氧心肌细胞SDF-1/CXCR4信号通路的影响*
徐基杰 戴 健 朱彦华 陈 松 卓德华 李 檫 周 华
(上海市宝山区中西医结合医院,上海 201999)
急性心肌梗死(AMI)后缺血缺氧的环境是导致心肌细胞凋亡的主要原因。减少梗死区域心肌细胞的凋亡对防止左室不良重构和保留心脏功能具有重要意义[1]。虽然介入治疗能开通大的冠脉分支,挽救梗死的心肌,但是仍存在无复流、微循环障碍等问题[2]。因此,通过药物治疗,提高缺血缺氧心肌细胞的抗凋亡能力,对于改善AMI预后具有重要意义。在本研究中,拟探索中药鹿红方对缺血缺氧模型下心肌细胞抗凋亡能力的影响,并进行初步的机制探讨。
1 材料与方法
1.1 实验药物
鹿红方由宝山区中西医结合医院制剂室提供,由鹿角15 g,红花9 g,桂枝 9 g,黄芪30 g,党参15 g和葶苈子30 g组成。鹿红方水提物制备:将药材加水浸泡1 h,先大火煮沸后再用小火煎煮1 h,18层纱布过滤,滤液备用;另外再加适量水同法再煎煮1次,18层纱布滤过,合并2次药液,于60℃旋转蒸发仪减压浓缩至干,在60℃真空干燥,干膏称重,再研为均匀细粉,备用。
1.2 细胞株
心肌细胞购自Lonza公司。
1.3 试剂与仪器
DMEM/F12培养基、IMDM培养基、胎牛血清、无血清培养基均购自美国GIBCO公司;CCK-8试剂盒购自上海易色公司;AMD3100,购自美国Sigma公司;GAPDH antibody购自天津三箭公司;SDF-1兔抗、CXCR4兔抗、Bcl-2兔抗购自英国abcam公司;Bax兔抗,购自美国Proteintech公司。三气培养箱购自日本松下公司;水浴恒温摇床购自上海汉诺公司;CO2细胞培养箱,购自美国Thermo公司;超净台,购自美国BioX公司;多功能酶标仪T0-3型,购自瑞士Tecan公司;-80℃冰箱,购自日本Sanyo公司。
1.4 模型制备
缺血缺氧模型的制备参考Wohnsland等的报道[3]并加改进。取1 mL冻存心肌细胞(1~10×107),常规复苏后转移至无血清培养基,并置于37℃三气培养箱中,设置气体比例:氮气95%、二氧化碳5%。将混合气体以流速10 L/Min通过三气培养箱,至测氧仪检测箱中氧气体积分数为3%时停止通气。培养时间设0.5、1、1.5、2、2.5、3 h共6个点,分别用CCK-8检测细胞活性,以此确定缺血缺氧和药物干预时间。发现氧糖剥夺时间在1.5 h时即见大量细胞凋亡,提示造模成功,故本研究将氧糖剥夺和药物干预时间设为1.5 h。见图1。

图1 不同缺血缺氧时间下心肌细胞OD值
1.5 鹿红方干预浓度的确定
鹿红方中剂量浓度根据临床使用剂量换算,参照《细胞培养》[4]公式:试验药物质量浓度(μg/mL)=(药物临床常用剂量×平均体表面积/平均体质量)×(100÷60)。平均体质量按60 kg,平均体表面积按1.6 m2计算,鹿红方临床用常用剂量为4.5 g/(kg·d),代入公式得鹿红方细胞实验中剂量约200 μg/mL,设立低剂量组为100 μg/mL,高剂量为500 μg/mL及1 000 μg/mL,加药时根据各分组(表1)的干预要求,配成相应质量浓度,以考察量效关系。
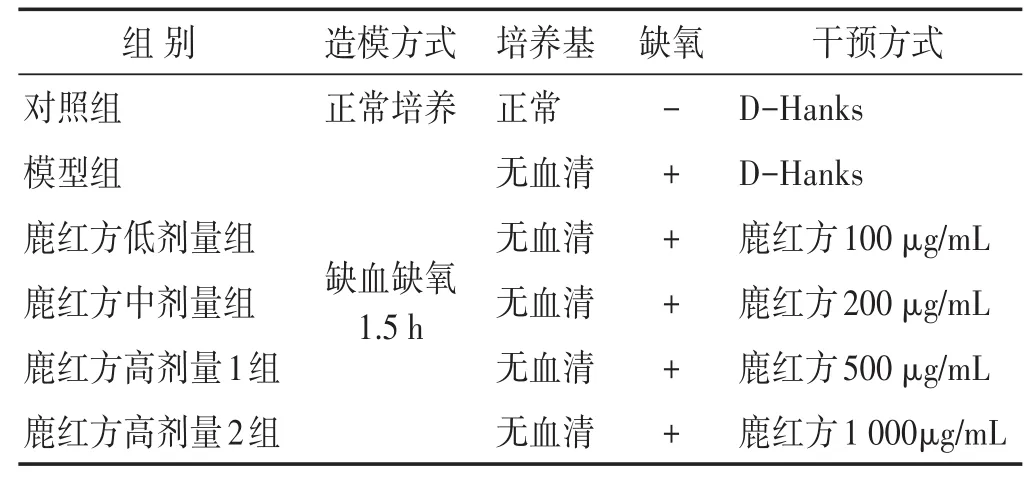
表1 鹿红方对心肌细胞抗凋亡能力影响的干预分组
1.6 分组及干预
首先探讨不同浓度的鹿红方处理,对缺血缺氧模型下心肌细胞抗凋亡能力的影响,分组和干预方式如表2所示。然后从SDF-1/CXCR4信号通路探讨鹿红方作用机制,分组和干预方式如表2所示。

表2 鹿红方对心肌细胞抗凋亡能力影响机制研究的干预分组
1.7 检测指标
1.7.1 CCK-8法测定活细胞数目 待测心肌细胞悬液接种于96孔培养板中(104细胞/孔),按分组加入干预药物;然后加入10 μL CCK-8试剂,混匀后37℃,5%CO2培养箱中孵育1.5 h,测定450 nm处OD值;酶标仪读取待测样品和空白参照在450 nm处的OD值,将各待测样本的OD值记为测量值,空白参照的OD值记为空白值,终值=测量值-空白值;通过判定OD值的高低反映活细胞数量。
1.7.2 Western blotting检测心肌相关蛋白的表达 各组心肌细胞表达SDF-1、CXCR4、Bax以及Bcl-2蛋白的水平采用Western blotting法进行测定。测定方法按照我们之前的研究进行[5]。简述如下:蛋白用SDSPAGE提取分离,然后转膜至聚乙烯二氟膜上。孵育一抗,稀释比如下:SDF-1 1∶1 000;CXCR4 1∶100;Bax 1∶3 000;Bcl-2 1∶500;过夜,室温下孵育二抗1 h。最后采用灰度值半定量法分析蛋白表达量。
1.8 统计学处理
采用SPSS22.0统计软件。计量资料以()表示,组间比较采用ANOVA单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 各组心肌细胞OD值比较
对照组与各造模组OD值差异有统计学意义(P<0.001),各造模组OD值显著降低(P<0.001);鹿红方低剂量组和模型组比较,差异无统计学意义(P>0.05);鹿红方中剂量组、鹿红方高剂量1组及高剂量2组和模型组及鹿红方低剂量组比较,OD值显著升高,差异有统计学意义(P<0.001);鹿红方中低剂量组、鹿红方高剂量1组与高剂量2组之间OD差异无统计学意义(P>0.05),提示鹿红方200 μg/mL即可达到良好的抗凋亡效果,继续提高质量浓度并未显示出疗效的增强,因此,在后续机制研究中将鹿红方的质量浓度定为200 μg/mL。见表3。
表3 各组心肌细胞OD值比较(%,±s)

表3 各组心肌细胞OD值比较(%,±s)
注:与对照组比较,#P<0.001;与模型组比较,*P<0.001。下同。
组别对照组模型组鹿红方低剂量组鹿红方中剂量组鹿红方高剂量1组鹿红方高剂量2组心肌细胞存活率0.89±0.01 0.21±0.02#0.20±0.03#0.46±0.02#*0.48±0.02#*0.45±0.01#*
2.2 各组心肌细胞SDF-1、CXCR4蛋白表达量比较
模型组与对照组比较,SDF-1和CXCR4的表达显著升高(P<0.001);AMD中剂量组与模型组比较,SDF-1和CXCR4表达显著升高(P<0.001);鹿红方中剂量组与模型组比较,SDF-1和CXCR4的表达显著升高(P<0.001)。见表4,图2~图3。

图2 各组SDF-1蛋白表达量比较
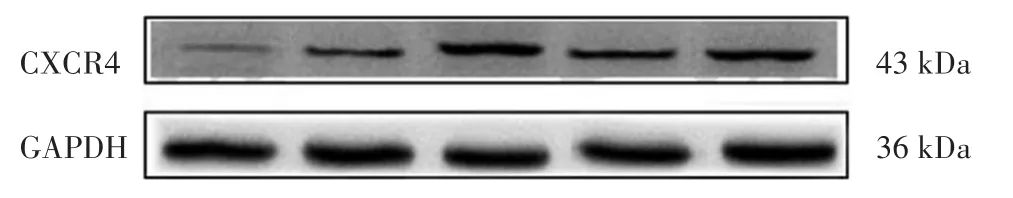
图3 各组CXCR4蛋白表达量比较
表4 各组心肌细胞SDF-1、CXCR4蛋白表达量比较(±s)

表4 各组心肌细胞SDF-1、CXCR4蛋白表达量比较(±s)
组别对照组模型组AMD3100组鹿红方中剂量组鹿红方+AMD3100组SDF-1/GAPDH 0.04±0.01 0.41±0.05#0.85±0.01#*0.68±0.02#*0.87±0.01#*CXCR4/GAPDH 0.05±0.01 0.37±0.07#0.76±0.04#*0.65±0.04#*0.79±0.08#*
2.3 各组心肌细胞Bax及Bcl-2蛋白表达量比较
Western blotting结果显示:模型组与对照组比较,Bax的表达量显著升高(P<0.001);AMD3100组与模型组比较,Bax表达量显著升高(P<0.05),Bcl-2表达量有降低趋势(P=0.061),Bax/Bcl-2值显著升高(P<0.001);鹿红方中剂量组与模型组比较,Bax表达显著降低,Bcl-2表达量显著升高,Bax/Bcl-2值显著降低(P<0.001);鹿红方+AMD3100组与鹿红方中剂量组比较,Bax表达量显著升高,Bcl-2表达量显著降低,Bax/Bcl-2值显著升高(P<0.001)。见表5,图4~图5。
表5 各组心肌细胞Bax及Bcl-2蛋白表达量比较(±s)
表5 各组心肌细胞Bax及Bcl-2蛋白表达量比较(±s)
注:与鹿红方中剂量组比较,★P<0.001。
组别对照组模型组AMD3100组鹿红方中剂量组鹿红方+AMD3100组Bax/GAPDH 0.02±0.01 0.69±0.08#0.78±0.05#*0.35±0.05#*0.61±0.04#★Bcl-2/GAPDH 0.12±0.01 0.29±0.03#0.23±0.04#0.57±0.05#*0.34±0.04#★Bax/Bcl-2 0.17±0.03 2.3±0.23#3.4±0.6#*0.62±0.14#*1.78±0.13#★
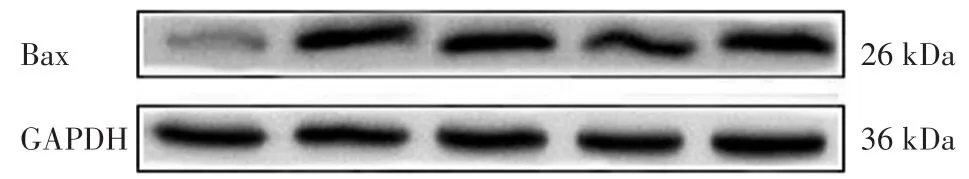
图4 各组Bax蛋白表达条带

图5 各组Bcl-2蛋白表达条带
3 讨论
心肌梗死预后的改善有赖于更多心肌细胞的存活。及时的冠脉介入治疗能挽救大部分心肌,但无复流、慢血流和微循环梗死等问题仍然导致了一部分心肌细胞的凋亡[2]。研究显示,SDF-1/CXCR4信号通路在心肌细胞抗凋亡方面起着重要作用[6]。SDF-1属于CXC趋化因子亚家族成员,分为SDF-1α和SDF-1β,两者的差别在于前者比后者少4个氨基酸。CXCR4是SDF-1最主要的受体,为7次跨膜的G蛋白偶联受体,表达于多种细胞表面[7]。SDF-1与CXCR4结合后,可以通过后者的二聚变构和内在化激活下游多条信号通路,参与提高细胞在缺血缺氧环境下的抗凋亡能力[8]。
在本研究中,我们以SDF-1/CXCR4信号通路为研究靶点,研究鹿红方提高心肌细胞抗凋亡能力的部分机制。鹿红方中鹿角温补肝肾、补益精血,使肾气有根,阳气上通于心,红花活血化瘀通经,兼凉血解毒,共为君药;桂枝温通心阳;黄芪、党参益气扶正;葶苈子泻肺平喘。诸药合用,共奏温补心肾阳气、活血利水之功效。心肌梗死后,罪犯血管堵塞,心梗区域缺氧无灌注的状态当属中医学“心血瘀阻”证范畴[9],鹿红方益气活血的功效切合该病机。鹿红方长期在临床应用,在改善心衰,尤其是冠心病心衰临床症状和预后方面,疗效显著。前期的临床研究结果也提示,鹿红方有确切的抗心衰临床疗效[10-12],而其作用机制研究正不断深入开展。
现代药理研究表明,组成本方的6味药物均有不同程度的细胞保护和增强抗凋亡能力的作用:黄芪中的黄芪甲苷、红花中的羟基红花黄色素A有明确抗心肌细胞凋亡的作用[13-14],葶苈子有效成分能显著改善缺氧心肌细胞氧化应激失衡状态[15];桂枝有效成分肉桂酸具有保护心肌梗死后心肌细胞损伤的作用[16];鹿角蛋白具有保护急性缺血时心肌微循环血管内皮细胞的作用[17];党参内酯可通过作用于胰岛素样生长因子Ⅱ受体减少心肌细胞凋亡[18]。
本研究结果显示,模型组SDF-1和CXCR4蛋白表达水平显著上升。这是因为在缺血缺氧环境下,缺氧诱导因子(HIF)家族成员激活,后者可直接调控一些生长因子的转录,如血管内皮生长因子(VEGF)、血小板源性生长因子(PDGF)、生长因子(HGF)等,其中还包括化学趋化因子如SDF-1的转录[19-21]。在缺血、缺氧时,SDF-1的表达在HIF-1的作用下得到上调;而CXCR4也在HIF-1的介导下表达增加,从而使SDF-1与CXCR4结合增加,激活下游信号通路发挥抗缺血缺氧效应[19]。本研究结果显示的缺血缺氧激发心肌细胞分泌SDF-1和CXCR4的效应与前期研究报道一致[22]。
用CXCR4受体拮抗剂AMD3100阻断SDF-1/CXCR4通路后,Bax的表达显著升高,Bcl-2的表达显著降低,Bax/Bcl-2数值升高,表明凋亡程度加重,从反面验证了SDF-1/CXCR4信号通路激活对心肌细胞在缺血、缺氧应激下的抗凋亡效应。同时,我们注意到AMD3100组SDF-1和CXCR4的表达显著上升,这可能是因为阻断两者结合后,信号通路的下游关键蛋白的磷酸化受阻,细胞内可能存在某种反馈系统,刺激SDF-1和CXCR4的分泌,值得进一步研究。鹿红组与模型组比较,SDF-1/CXCR4表达显著上升,同时Bax的表达显著降低,Bcl-2的表达显著升高,Bax/Bcl-2数值降低,提示鹿红方可通过上调SDF-1/CXCR4轴的表达,提高心肌细胞的抗凋亡能力。在用AMD3100拮抗SDF-1/CXCR4信号通路后,鹿红方提高心肌细胞抗凋亡能力的作用受到抑制,从反面说明鹿红方发挥作用的机制部分是通过上调SDF-1/CXCR4信号通路的表达实现的。
综上所述,鹿红方可提高缺血缺氧状态下心肌细胞的抗凋亡能力,其机制与上调SDF-1/CXCR4信号通路有关。本研究的结果为鹿红方的临床应用提供了一定的生物学依据,但进一步的作用机制有待更深入的研究。

