载锶纳米钛表面促进骨质疏松大鼠骨髓间充质干细胞成骨分化的体外研究
Shahrzad Hosseinijenab, 王静文, 苏俭生, 张 磊
(上海牙组织修复与再生工程技术研究中心,同济大学口腔医学院,同济大学附属口腔医院口腔修复教研室,上海 200072)
近年来,随着人民生活水平的提高和口腔种植技术的不断普及,中老年人对种植修复的需求持续增长。骨质疏松症作为一种退行性和代谢性疾病,在中老年人群中高发。由于患者成骨能力的下降及成骨细胞和破骨细胞的失衡,种植修复的效果常常不理想[1]。而种植体与周围骨形成稳定的骨整合是种植成功的核心和关键[2]。因此,如何有效促进骨质疏松条件下种植体周围的骨整合,成为该人群中亟待解决的问题[3]。
课题组前期对钛种植体表面改性进行了相关研究,发现纳米结构可以促进大鼠骨髓间充质干细胞(BMSCs)的增殖和成骨分化,且钙离子的负载能够显著促进种植体周围成骨[4]。有研究表明,锶能够通过抑制破骨细胞吸收和刺激成骨细胞形成的双重机制发挥促进成骨的作用[5-6]。Li等[7]通过凝胶涂层的方法引入锶离子,证实其具有促进种植体周围成骨的能力。
因此,本实验拟通过水热法制备钛表面载锶纳米结构,探究其对骨质疏松大鼠BMSCs成骨分化的作用。
1 材料和方法
1.1 材料
1.1.1 实验试剂及设备 氢氧化钠和氢氧化锶(生工生物工程(上海)股份有限公司,中国);α-MEM培养液、胰蛋白酶和青霉素-链霉素(双抗)(Hyclone公司,美国);胎牛血清(fetal bovine serum,FBS;Gibco公司,美国);磷酸盐缓冲溶液(phosphate buffered saline,PBS;Hyclone公司,美国);CCK-8试剂盒(碧云天公司,中国);TRIzol总RNA提取试剂盒、逆转录试剂盒(TaKaRa公司,日本);扫描电子显微镜(SEM,Hitachi公司,日本);实时荧光定量PCR仪(罗氏公司,瑞士)。
1.1.2 实验动物SD大鼠由同济大学实验动物中心提供,饲养于上海牙组织修复与再生工程技术研究中心SPF级实验动物房中。
1.2 实验方法
1.2.1 材料制备及表征 本实验所用钛片为机械加工纯钛片(Φ15 mm×2 mm),将其置于丙酮、无水乙醇、去离子水中依次超声清洗后,于60℃下烘干待用。将清洗后的纯钛片作为对照组(control-Ti组);将纯钛片放在聚四氟乙烯内衬的反应釜中,加入25 mL 0.5 mol/L NaOH水溶液,于180℃下处理12 h,取出钛片用去离子水超声振荡清洗15 min,烘干后得到纳米组(nm-Ti组);将纯钛片置于25 mL 2 mmol/L Sr(OH)2水溶液中,于180℃下处理12 h,取出后清洗烘干得到载锶纯钛组(Sr-Ti组);将纯钛片置于25 mL 0.5 mol/L NaOH水溶液中,于180℃下处理12 h,烘干后再次放入反应釜内,加入25 mL 2 mmol/L的Sr(OH)2水溶液,于180℃下处理12 h,取出后清洗烘干得到载锶纳米组(nm/Sr-Ti组)。所有钛片经高温高压灭菌后备用。
使用SEM观察各组钛片表面结构,通过X射线光电子能谱(XPS)分析各组钛片表面元素组成及含量,通过X射线衍射(XRD)进一步分析各组钛片表面构成。
1.2.2 细胞培养 选取2~3周龄的雄性SD大鼠,将大鼠颈椎脱臼处死后分离其股骨和胫骨,浸泡在含10%双抗的PBS中,转入无菌操作台。用镊子小心夹持股骨,无菌器械剪去两端骨骺,用1 mL无菌注射器吸取适量培养液 (含10%FBS、1%双抗的α-MEM培养液),将骨髓冲入10 cm培养皿中,用同样方法将同一侧胫骨内的骨髓冲入同一培养皿中,各培养皿共加入8 mL培养液,将骨髓均匀吹散后放入恒温培养箱(5%CO2、37℃)中培养,每3 d换液,待BMSCs密度达80%~90%时,使用含2.5%乙二胺四乙酸 (ethylene diamine tetraacetic acid,EDTA)的胰酶消化后传代培养,取第2代BMSCs进行实验。
选取2~3周龄的雌性SD大鼠,采用双侧卵巢切除术(OVX)建造骨质疏松大鼠模型,10周后建模完成。用相同方法提取OVX大鼠的BMSCs,培养至第2代待用。
1.2.3 细胞增殖 当第2代BMSCs密度达80%~90%时,使用含2.5%EDTA的胰蛋白酶消化,以1×104/孔(24孔板)的密度接种于各组钛片表面,每3 d换液。分别于接种后第1、4、7天弃去孔板中的原培养液,使用PBS清洗3次,使用CCK-8试剂盒,将CCK-8原液与培养液以1∶10的比例配制成CCK-8工作液,按550 μL/孔加入各孔板内,37℃下避光孵育3 h。使用酶标仪在波长450 nm下检测其吸光度值,比较各组钛片表面细胞增殖情况。各组重复3次实验,消除样本和操作误差。
1.2.4 各组钛片表面BMSCs成骨相关基因的表达 当第2代BMSCs密度达80%~90%时,使用含2.5%EDTA的胰蛋白酶消化,以1×104/孔(24孔板)的密度接种于各组钛片表面,每3 d换液。分别于接种后第3、7、10天弃去原培养液,使用PBS清洗2次,用TRIzol法提取细胞总RNA,参照逆转录试剂盒说明书对获得的总RNA进行逆转录,得到各组cDNA。根据实时定量聚合酶链反应(RT-qPCR)试剂盒说明书,按一定的反应体系,以β-actin作为内参基因,通过实时荧光定量PCR仪进行RT-qPCR。
对各组钛片表面的正常组和骨质疏松组的BMSCs的成骨相关基因表达进行RT-qPCR检测。
1.3 统计学处理
通过SPSS 20.0软件对实验数据进行处理分析,数据均采用均数±标准差()表示。组间比较采用单因素方差分析,以P<0.05表示差异有统计学意义。
2 结果
2.1 材料表征
2.1.1 SEM观察 各组钛片表面形貌图像如图1,control-Ti组表面平整,无微纳结构;Sr-Ti组表面与control-Ti组相似,未见特殊纳米形态;nm-Ti组和nm/Sr-Ti组表面呈现出成簇片状纳米结构。

图1 各组钛片表面SEM图像Figure 1 SEM images of each titanium sheets surface
2.1.2 XPS分析 各组钛片表面元素分析如表1所示。各组钛片表面均可检测到C、O和Ti元素。与control-Ti组相比,Sr-Ti组和nm/Sr-Ti组表面均有较高浓度的Sr离子,且nm/Sr-Ti组含量约为Sr-Ti组的2倍。

表1 XPS分析各组钛片表面元素组成(%)Table 1 Elements composition of each titanium sheets surface by XPS analysis(%)
2.1.3 XRD检测 各组钛片表面XRD结果如图2所示,除了Ti峰外,Sr-Ti组表面可见Sr峰,nm-Ti组表面可见Na2Ti6O13峰,而nm/Sr-Ti组表面可以看到Sr2TiO4峰的存在。

图2 各组钛片表面XRD 分析图谱Figure 2 XRD analysis graphics of each titanium sheets surface
2.2 细胞增殖
细胞增殖结果如图3所示,随着时间增加,正常大鼠BMSCs在各组钛片表面的细胞数量不断增加,nm/Sr-Ti组表面细胞增殖较为活跃。而OVX大鼠组的CCK-8结果显示,nm/Sr-Ti组和nm-Ti组细胞增殖在第4天和第7天时显著高于control-Ti组(P<0.05)。
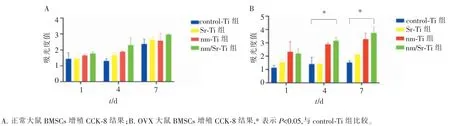
图3 BMSCs 在各组钛片表面增殖能力Figure 3 Proliferation capacity of BMSCs on each titanium sheets surface
2.3 各组钛片表面BMSCs成骨相关基因的表达
BMSCs成骨相关基因表达结果如图4所示,各组钛片表面BMSCs 的成骨基因表达量随时间推移持续增加。 在正常大鼠中,BMP-2 和 OPN 在第 7 天时表达最高,OCN 在第 10 天时表达最高;nm-Ti 组和nm/Sr-Ti 组成骨基因表达高于control-Ti 组和Sr-Ti 组,以 nm/Sr-Ti 组表达量最多(P<0.05)。 OVX 大鼠BMSCs 结果与正常大鼠BMSCs 趋势一致, 但与control-Ti 组相比,Sr-Ti 组 OPN 的表达明显升高,且差异较正常大鼠组OPN 结果显著。且第3 天时,nm/Sr-Ti 组BMP-2 的表达量显著高于其他组, 差异具有统计学意义(P<0.05);第 7 天时,nm-Ti 组和 nm/Sr-Ti 组BMP-2 表达量与另外两组相比, 其差异较正常大鼠组BMP-2 结果也更为显著。

图4 成骨相关基因表达Figure 4 Expression levels of osteogenesis related genes
3 讨论
骨质疏松症是中老年人群中的常见疾病,据文献报道,尽管种植义齿总体成功率较高,但在骨质疏松症患者中,种植修复的临床效果不如预期[8]。骨质疏松症会影响颌面部的骨质和骨量, 在无牙区尤为明显[3]。 有研究发现,在大鼠骨质疏松模型中,下颌骨量的减少和骨转换率的降低会导致植入物与骨组织的接触面积减少,从而降低骨组织对植入物的支撑能力,以及植入物的初始稳定性[1,9]。 因此,学者们通过对种植体表面改性来促进局部细胞成骨活性,从而实现促进骨质疏松症患者种植体周围成骨[10]。
研究表明,具有纳米形态的钛种植体表面可有效促进骨质疏松大鼠的骨整合[11]。 表面的纳米结构可以促进成骨细胞的黏附、增殖和分化,实现促进骨整合的目的[12]。 同时,有研究证明,钛种植体表面负载功能性锶离子可以显著提高其表面活性和细胞生物学行为[13],能有效促进骨-种植体结合,缩短临床愈合周期, 从而实现种植体术后即刻功能负荷。 课题组前期通过水热法成功制备出钛表面载钙纳米形态, 增加其表面亲水性的同时, 实现了功能性钙离子负载,并通过体内外实验证明了这种结构对成骨细胞的黏附、增殖和成骨分化等生物学活性均有显著的促进作用[4]。 因此,本实验拟通过水热法制备钛表面载锶纳米结构,实现纳米结构的同时负载锶离子,以大鼠BMSCs 为研究对象,探究锶离子的负载能否与纳米结构协同发挥以促进成骨作用。
在本实验中,SEM 图像验证了nm/Sr-Ti 表面成簇的片状纳米结构,XPS 和XRD 结果表明钛表面成功负载了锶离子,上述表征结果说明已成功构建钛表面载锶纳米结构。且XPS 分析结果表明,nm/Sr-Ti 组表面锶浓度(4.12%)约为 Sr-Ti 组(2.04%)的2 倍。 二者表面形貌的主要区别在于nm/Sr-Ti 组为纳米结构, 提示纳米结构可能通过增加其比表面积,从而在相同反应条件下提高了钛表面的吸附能力, 促进锶离子的负载。 体外细胞增殖实验表明,nm-Ti 组和nm/Sr-Ti 组均具有良好的促细胞增殖能力,且在第 4 天和第 7 天时,OVX 大鼠的 BMSCs 在nm-Ti 组和nm/Sr-Ti 组的增殖细胞数显著高于其他组。 RT-qPCR 结果表明,各组钛片表面成骨相关基因表达均随时间推移而增加。 在正常大鼠中,与control-Ti 组相比,Sr-Ti 组成骨基因表达结果无显著差异,而 nm-Ti 组和 nm/Sr-Ti 组的 BMSCs 在第 7 天时高表达 BMP-2 和 OPN, 在第 10 天时,OCN 表达量最多,且nm/Sr-Ti 组在第7 天时的BMP-2 表达量最高,说明钛表面纳米结构与纳米载锶结构均能促进大鼠BMSCs 的成骨分化。 OVX 大鼠组结果整体趋势与正常大鼠组一致,但与control-Ti 组相比,Sr-Ti 组OPN 的表达明显升高, 且差异较正常大鼠组OPN 结果显著,说明锶离子的负载对骨质疏松大鼠的BMSCs 成骨分化有促进作用。 同时,OVX 大鼠组的 RT-qPCR 结果表明, 在第 3 天时,nm/Sr-Ti 组BMP-2 表达量显著高于其他组;第 7 天时,nm-Ti 组和nm/Sr-Ti 组BMP-2 表达量与另外两组相比,其差异较正常大鼠组BMP-2 结果也更为显著,进一步表明锶离子的负载对骨质疏松大鼠BMSCs 的成骨分化有促进作用,同时提示锶离子负载与钛表面纳米结构可能存在协同作用,共同促进了骨质疏松大鼠BMSCs 的成骨分化。
综上所述,本实验成功构建了钛表面载锶纳米结构, 体外实验结果表明该结构对骨质疏松大鼠BMSCs 的增殖和成骨分化均有促进作用,其中锶离子与纳米结构可能存在某种协同作用,为促进骨质疏松大鼠骨整合提供了思路。 但本实验仅局限在体外实验,缺乏体内实验结果,且锶离子与纳米结构促进成骨的作用机制尚不清楚。 因此,还需要行进一步实验深入探究其对骨质疏松大鼠的促成骨作用机制,从而为缩短骨愈合期并增强种植体骨整合提供实验基础。

