PhJAZ1蛋白对毛竹中抗虫相关代谢物和SPL家族基因的影响
黄锦鹏, 李玉红, 朱腾飞, 任慧波, 苏 军
(福建农林大学海峡联合研究院基础林学与蛋白质组学研究中心,福建 福州 350002)
毛竹(Phyllostachysheterocycla)是我国重要的经济和生态资源,存在特殊的大小年现象,在同一片竹林中同时存在大年和小年两类竹叶有利于竹林抵抗虫害[1].而我国大部分的毛竹林为经营强度极大且竹叶类型单一的大年竹林,虫害发生频繁,给毛竹产业造成极大的经济损失[2].
在受到昆虫取食时,植物体内会通过内源激素含量等的变化实现对昆虫的防御[3],这也是植物感受和细胞间传递损伤信号的基础.茉莉酸(jasmonate, JA)已被证实与植物响应咀嚼式口器昆虫的危害有直接关系[4].在模式植物拟南芥(Arabidopsisthaliana)中,JAZ1(jasmonate ZIM-domain 1)属于高效的转录抑制因子,能抑制JA信号途径下游相关抗虫基因的表达[5].JAZ1蛋白在未被降解时通过与髓细胞组织增生蛋白(myelocytomatosis proteins, MYC)类转录因子MYC2结合抑制下游抗虫基因的表达,该蛋白被降解后MYC2与MED25(mediator 25)结合,使得下游抗虫基因得以表达,进而大量合成可以直接毒害昆虫的次生代谢物质,包括黄酮类和单宁类等物质[6-9].研究表明,竹叶在被昆虫取食后体内的次生代谢物质(包括黄酮、生物碱和单宁等)的含量极显著上升,且这些物质在小年竹叶中的积累量显著大于大年竹叶[1,10-12].
SPL(squamosa promoter-binding protein-like)属于植物年龄依赖性发育的重要调节转录因子[13-14].SPL在植物幼年期间呈现低水平表达,随着植物的生长和发育,SPL表达水平会逐渐升高.SPL广泛调节植物的进化过程,包括开花[15-16]、次生代谢产物生产[17-18]和抗逆反应[19-20].研究表明,拟南芥中的SPL9可以在蛋白水平上直接抑制JAZ3的降解,导致随着年龄的增长,植物的JA信号响应逐渐减弱[5].本团队前期通过体外的酵母单杂交试验与HEK-293T细胞中的双荧光报告系统,证明PhSPL17能够直接结合PhJAZ1的启动子区,并在转录水平上抑制PhJAZ1的表达[21-22].然而,PhJAZ1在毛竹体内如何通过调节下游PhSPL家族基因的表达影响次生代谢物质的积累进而影响抗虫性尚不明确.本试验通过探究PhJAZ1对毛竹中次生代谢物质及下游抗虫相关PhSPL家族基因表达的影响,为深入研究毛竹JA信号通路的抗虫机制提供参考,并为基因工程在毛竹遗传育种方面的应用提供依据.
1 材料与方法
1.1 材料
本研究所用野生型拟南芥及毛竹均采自福建农林大学海峡联合研究院林学中心人工气候室;JAZ1功
能缺失型突变体拟南芥jaz1订购自拟南芥资源中心(ABRC, The Ohio State University Rightmire Hall 1060 Carmack Road Columbus, OH43210USA),编号为SALK_011957,该突变体是在野生型拟南芥Col-0中以T-DNA插入方式,使jaz1基因缺失,从而使JAZ1功能缺失;棉铃虫(Helicoverpaarmigera)由福建农林大学教育部生物农药与化学生物学重点实验室提供.
1.2 毛竹PhJAZ1基因的获得
在毛竹基因组数据库Bamboo GBD(http://www.bamboogdb.org/)中对拟南芥、水稻和毛竹中JAZ家族蛋白进行同源基因序列比对[22],选取同源性最高的基因(PH01000360G1030)为模板,利用Primer5软件设计PCR引物:正向引物F为5′-ATGGAGATGTCTGCGTCCGCGA-3′,反向引物R为5′-TTGGCTGCATTCTGTGTTCAAGC-3′.
毛竹PhJAZ1基因以毛竹cDNA为模板,用KOD-Plus-Neo高保真酶通过PCR扩增获得PhJAZ1基因.扩增体系(50 μL):10×Buffer 5 μL,dNTPs 5 μL,上、下游引物各1.5 μL,MgSO43 μL,模板1 μL,ddH2O 33 μL.
反应条件:
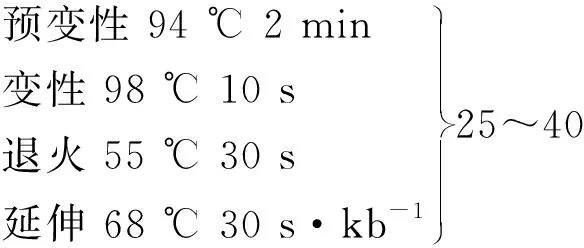
保温 16 ℃ +∞.
1.3 PhJAZ1过表达载体的构建
将扩增获得的PhJAZ1基因和携带绿色荧光蛋白(green fluorescent protein, GFP)标签的载体pFGFP分别用BamH>Ⅰ特异性核苷酸酶进行酶切,再利用Infusion连接酶(In-Fusion®HD Cloning Kit)将PhJAZ1基因连接到pFGFP载体上.之后转化大肠杆菌DH5α,37 ℃摇床培养1 h后涂布于含有终浓度为50 ng·μL-1卡那霉素的LB固体培养基上,37 ℃培养箱过夜培养后,挑取阳性单克隆菌经PCR鉴定后送测序公司测序.测序结果正确的阳性菌在含有终浓度为50 ng·μL-1卡那霉素的LB液体培养基中于37 ℃摇床过夜培养,利用质粒小提试剂盒(DP103, TIANGEN)提取质粒,获得PhJAZ1基因过表达载体ACT2∷GFP-PhJAZ1.PhJAZ1载体构建的引物序列:正向引物F为5′-TCCAGCTCCAGGATCCATGGAGATGTCTGCGTCCGCGA-3′,反向引物R为5′-GAGAAAGCTTGGATCCTTGGCTGCATTCTGTGTTCAAGC-3′.
1.4 PhJAZ1过表达拟南芥和毛竹的获得
采用农杆菌介导的浸花法将PhJAZ1过表达载体转入拟南芥[23].先将构建好的过表达载体ACT2∷GFP-PhJAZ1通过冻融法转入农杆菌AGL0中,再将携带过表达载体ACT2∷GFP-PhJAZ1的农杆菌AGL0通过浸花法侵染jaz1突变体,共侵染2次,间隔1周.收获转化植株的种子,以除草剂Basta为筛选标记进行筛选,获得转化子植株PhJAZ1/jaz1.以野生型拟南芥Col-0为阳性对照,以携带jaz1突变体的拟南芥为阴性对照,以GFP-PhJAZ1融合蛋白为目的条带,通过Western Blotting验证拟南芥叶片,得到阳性植株.采取细胞穿透肽(cell-penetrating peptides, CPPs)介导的瞬时转化体系对幼年毛竹植株进行瞬时转化[24].将10 μg构建好的过表达载体ACT2∷GFP-PhJAZ1与CPPs(1 mg·μL-1)等体积混合于15 mL离心管中,加入300 μL 1×PBS溶液,于37 ℃孵育30 min,之后加入超纯水定容至5 mL,放入幼年毛竹植株至浸没,持续5 min抽真空后,在人工温室内避光存放3 d.以野生型幼年毛竹植株WT为对照,以GFP-PhJAZ1融合蛋白为目的条带,通过Western blotting验证毛竹幼苗全株,得到阳性植株.
1.5 突变体的鉴定
纯合体鉴定引物序列:LB1.3为5′-ATTTTGCCGATTTCGGAAC-3′;LP为5′-AGGTAAATGCGGAGAGAGAGG-3′;RP为5′-AGGCACCGCTAATAGCTTAGC-3′;PS1为LP+RP; PS2为LB1.3+RP.使用2×Easy Taq酶通过PCR扩增鉴定所用材料jaz1突变体为纯合体.扩增总体系为25 μL:2×Easy Taq Mix 12.5 μL,上、下游引物各1 μL,ddH2O 9.5 μL,模板1 μL.
反应条件:

保温16 ℃ +∞.
1.6 棉铃虫的饲养
选取棉铃虫的2龄幼虫,饲喂不同处理的3周龄拟南芥叶片,每组15头棉铃虫,每个处理3组重复,共45头棉铃虫.从饲喂第1天开始记录幼虫的体重和存活率[22],持续45 d.饲养条件:温度25 ℃,相对湿度70%,光周期为14 h光照∶10 h黑暗.
1.7 拟南芥和毛竹中次生代谢物质含量的测定
单宁含量的测定使用Solarbio公司生产的单宁含量检测试剂盒(BC1390);黄酮含量的测定使用格锐思生物科技有限公司的总黄酮(TF)试剂盒(G0118W);生物碱含量的测定使用格锐思生物科技有限公司的总生物碱含量测定试剂盒(G0150W).
1.8 PhJAZ1过表达毛竹中PhSPL家族基因表达量的测定
使用总RNA提取试剂盒(RC401-01, Vazyme)对野生型毛竹植株WT与PhJAZ1过表达阳性毛竹植株全株进行总RNA的提取.分别取1.0 μg各样品的RNA,使用cDNA Synthesis SuperMix(11141ES60, YEASEN)进行反转录得到cDNA.
根据已鉴定的15个拟南芥及19个水稻的SPL蛋白序列,在毛竹基因组数据库Bamboo GBD(http://www.bamboogdb.org/)中对拟南芥、水稻和毛竹SPL家族基因的氨基酸序列进行同源性比对[21],获得PhSPL基因家族序列,不同PhSPL基因实时荧光定量PCR的引物利用Primer3网站(http://primer3plus.com)设计(表1),以TIP41作为内参基因,使用Hieff®qPCR SYBR Green Master Mix(Low Rox Plus)(11202ES08, YEASEN)进行实时荧光定量PCR检测.每个样本做3个生物学重复、3个技术性重复.
使用log22-ΔΔCt法对实时荧光定量PCR的数据进行计算分析[25].ΔCt(实验组)=Ct(实验组目的基因)-CT(实验组内参基因),ΔCt(对照组)=Ct(对照组目的基因)-CT(对照组内参基因),ΔΔCt=ΔCt(实验组)-ΔCt(对照组),表达水平差异倍数Fold Change=2-ΔΔCt.
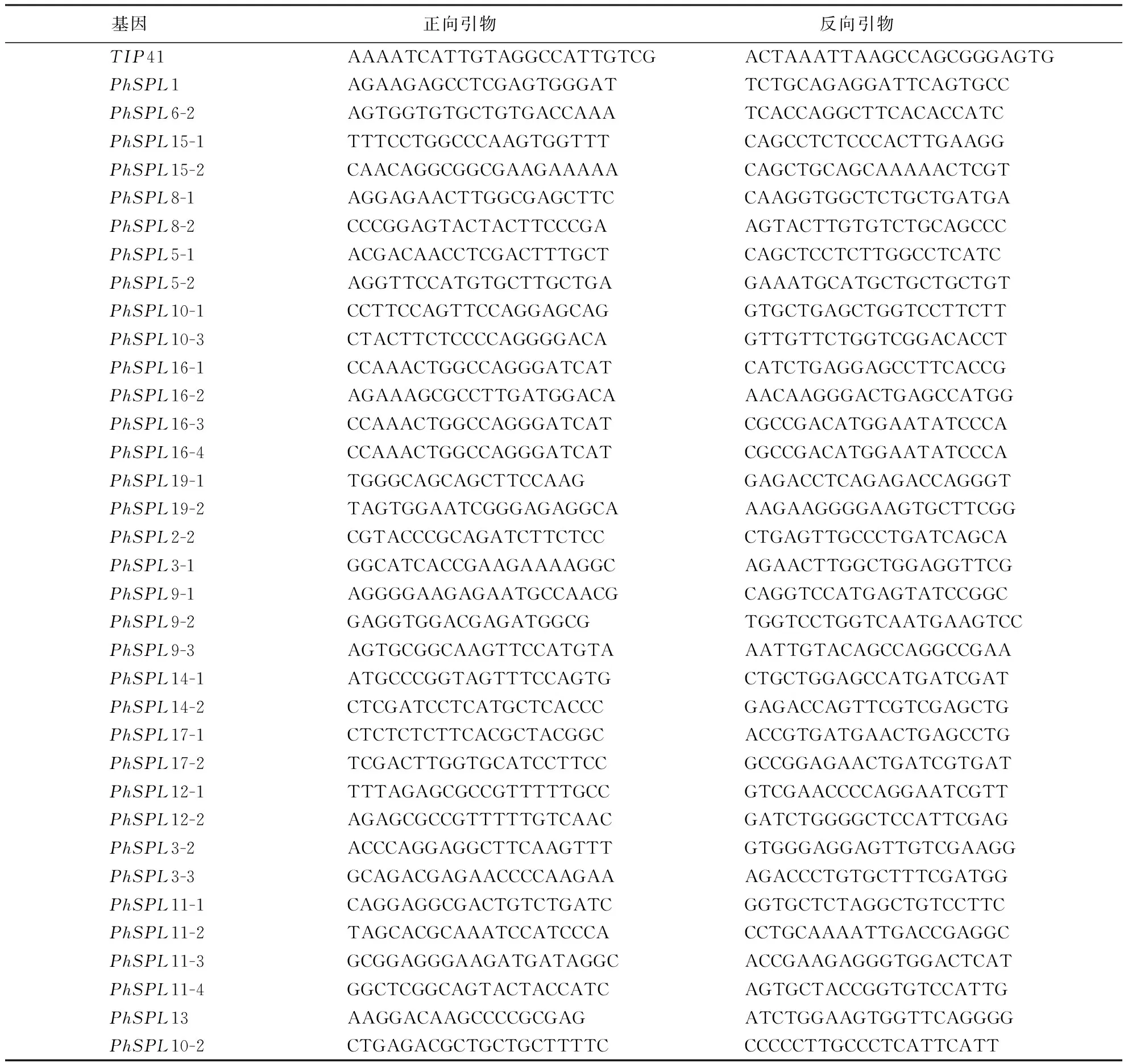
表1 毛竹实时荧光定量PCR引物序列Table 1 Primer sequences of real-time fluorescence quantitative PCR for moso bamboo
1.9 数据统计分析方法
数据的采集与整理使用Excel 2022软件,数据的分析与制图使用GraphPad Prism 8软件,采用t检验进行差异显著性分析.
2 结果与分析
2.1 PhJAZ1/jaz1拟南芥植株的鉴定
在拟南芥中,JAZ家族表现抑制植物抗虫性的作用[5].本研究选择在拟南芥jaz1突变体的背景下过表达AtJAZ1的同源基因PhJAZ1,以检测其是否能够提高jaz1突变体植株对昆虫危害的耐受性.通过Basta筛选得到T1代,收集T2代种子后,继续通过Basta筛选,对T2代的植株进行Western Blotting(图1),鉴定过表达植株中是否存在目的蛋白GFP-PhJAZ1,发现在众多T2植株中PhJAZ1/jaz1#5的蛋白表达量最多,因此,后续的试验均使用PhJAZ1/jaz1#5.
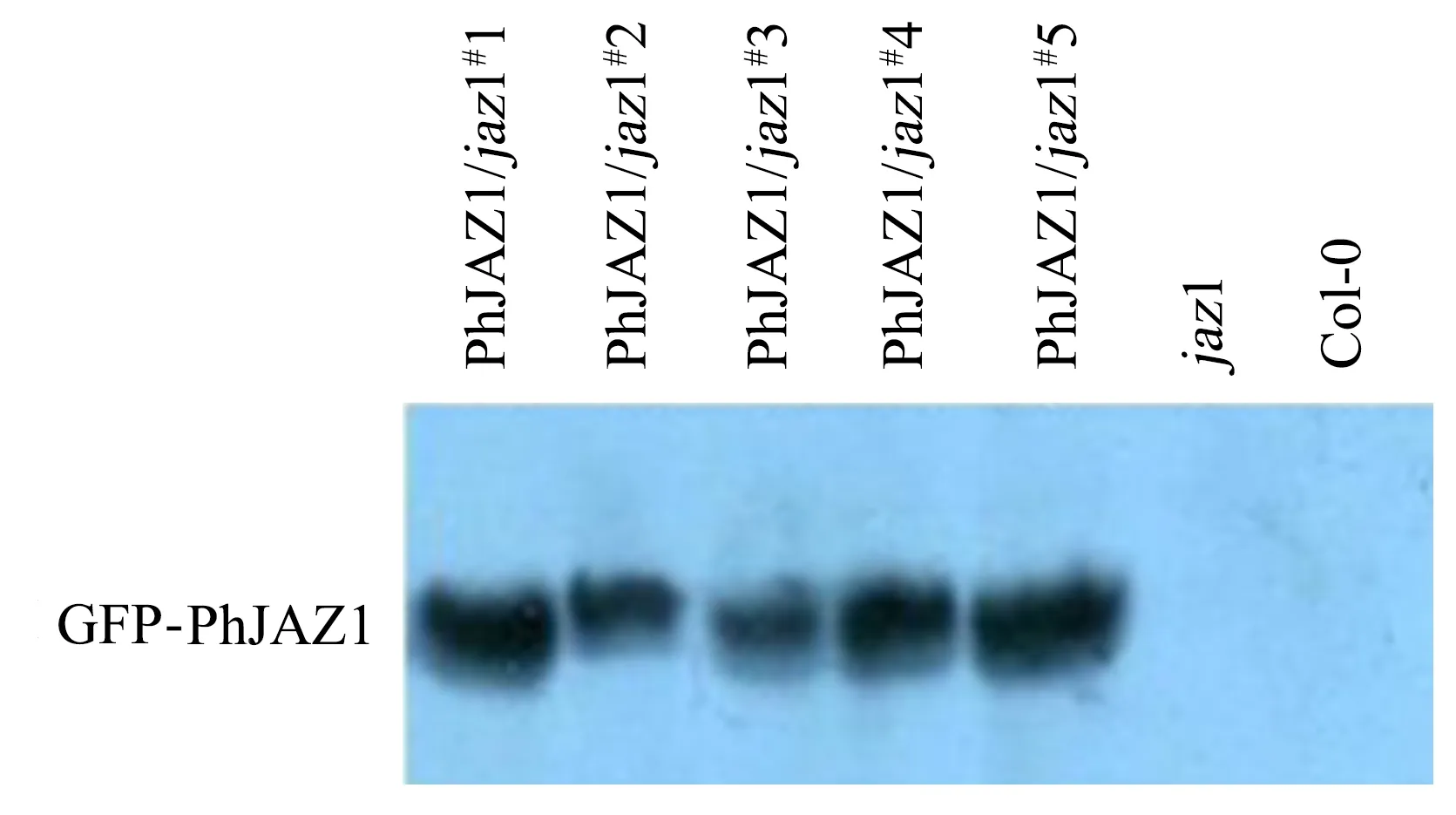
图1 PhJAZ1过表达拟南芥植株的Western blotting鉴定Fig.1 Western blotting verification of PhJAZ1 overexpression Arabidopsis
2.2 PhJAZ1对棉铃虫体重和存活率的影响
与取食携带jaz1突变体的拟南芥相比,取食PhJAZ1过表达拟南芥(PhJAZ1-OX/jaz1)的棉铃虫幼虫的体重和存活率分别提高了195.8%和36.7%(P<0.01),取食野生型拟南芥Col-0的棉铃虫幼虫的体重和存活率分别提高了97.5%和41.6%(P<0.01)(图2).

不同大写字母表示差异极显著(P<0.01).图2 PhJAZ1对棉铃虫幼虫体重和存活率的影响Fig.2 Effect of PhJAZ1 on weight and survival rate of H.armigera larvae
2.3 PhJAZ1对拟南芥中次生代谢物质含量的影响
如图3所示,携带jaz1突变体的拟南芥中黄酮含量与野生型拟南芥Col-0差异不显著,但前者单宁和生物碱含量分别比后者提高了62.7%和103.8%(P<0.01).相比于携带jaz1突变体的拟南芥,PhJAZ1过表达拟南芥(PhJAZ1-OX/jaz1)中的黄酮含量变化不显著;而单宁含量极显著减少(P<0.01),与野生型的单宁含量相当;生物碱含量也极显著减少(P<0.01),且低于野生型的生物碱含量.

不同大写字母表示差异极显著(P<0.01).图3 PhJAZ1对拟南芥中次生代谢物质含量的影响Fig.3 Effect of PhJAZ1 on secondary metabolites contents in Arabidopsis
2.4 PhJAZ1瞬时表达毛竹的鉴定
毛竹中的PhJAZ1为拟南芥AtJAZ1的同源基因,对PhJAZ1瞬时转化的毛竹幼苗全株进行Western blotting验证,结果表明PhJAZ1瞬时表达毛竹中存在目的蛋白GFP-PhJAZ1(图4).
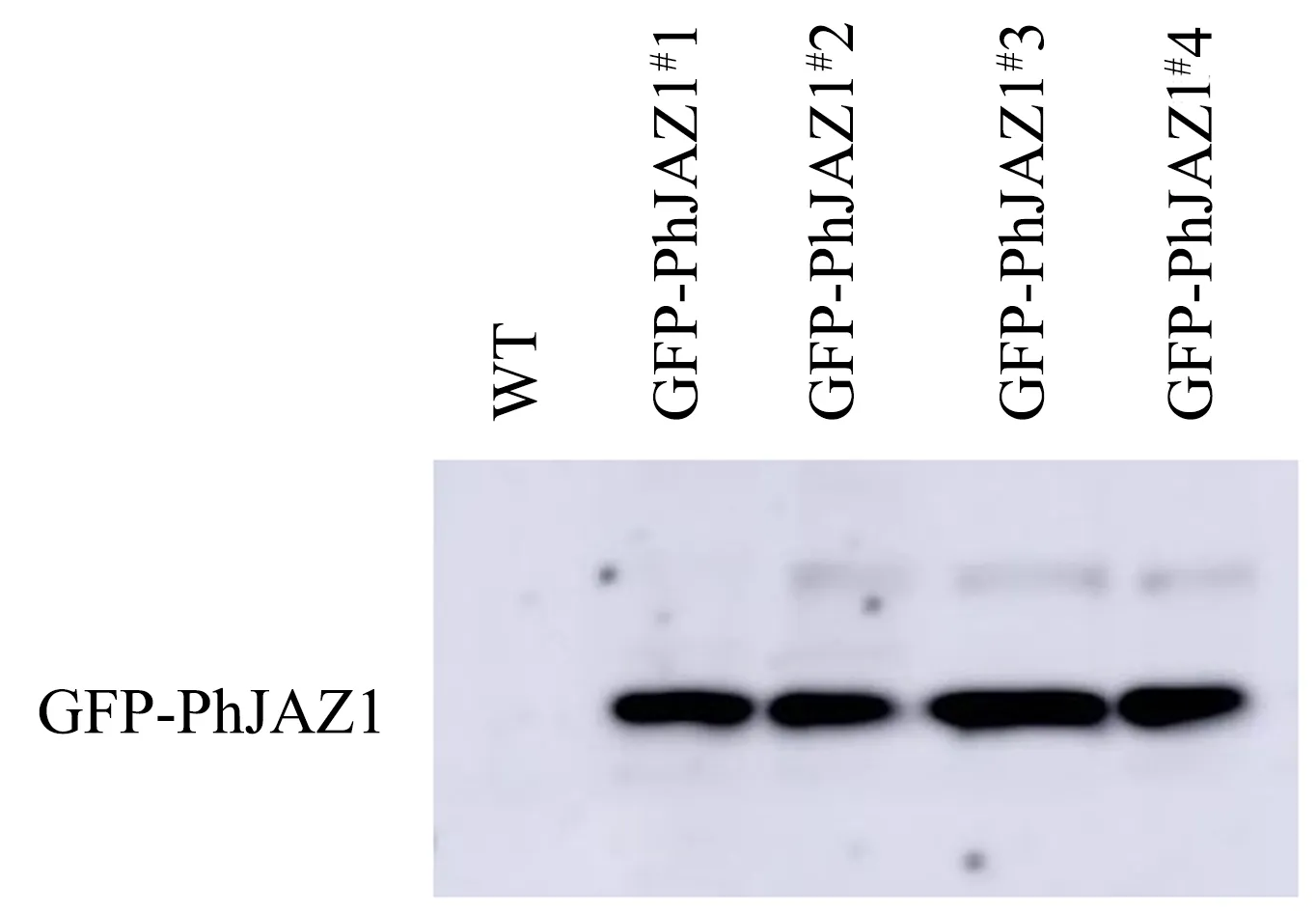
WT为野生型毛竹植株(全株),GFP-PhJAZ1#1、GFP-PhJAZ1#2、GFP-PhJAZ1#3及GFP-PhJAZ1#4均为PhJAZ1瞬时转化的毛竹植株(全株).图4 PhJAZ1过表达毛竹植株的Western blotting验证Fig.4 Western blotting verification of PhJAZ1 overexpression moso bamboo
2.5 PhJAZ1对毛竹中次生代谢物质含量的影响
由图5可以看出,与野生型毛竹WT相比,PhJAZ1过表达毛竹中单宁的含量降低了11.7%(P<0.05),而黄酮和生物碱含量的差异不显著(P>0.05).
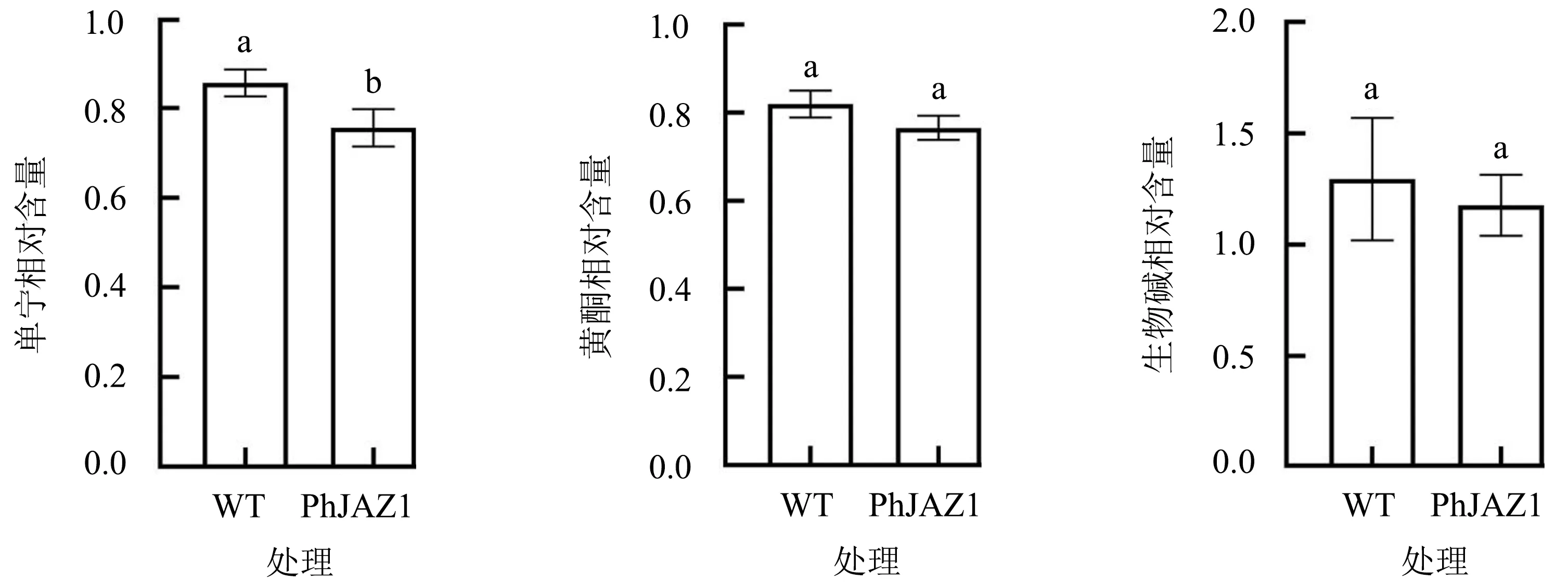
不同小写字母表示差异显著(P<0.05).图5 PhJAZ1对毛竹中次生代谢物质含量的影响Fig.5 Effect of PhJAZ1 on secondary metabolites contents in moso bamboo
2.6 PhJAZ1过表达毛竹中PhSPL家族基因的表达量
通过定量分析(图6)发现:相比于野生型毛竹,内源PhJAZ1过表达材料中PhSPL6-2的相对表达量上调最高,接近5倍;PhSPL3-3、PhSPL9-1和PhSPL9-2的相对表达量均上调近4倍;PhSPL12-1、PhSPL11-1、PhSPL3-1、PhSPL10-1、PhSPL15-1的相对表达量均上调约3倍;而PhSPL19-1、PhSPL17-1、PhSPL17-2、PhSPL16-2、PhSPL11-2、PhSPL3-2、PhSPL16-1、PhSPL16-4、PhSPL2-2、PhSPL11-4、PhSPL16-3的相对表达量呈下调趋势.
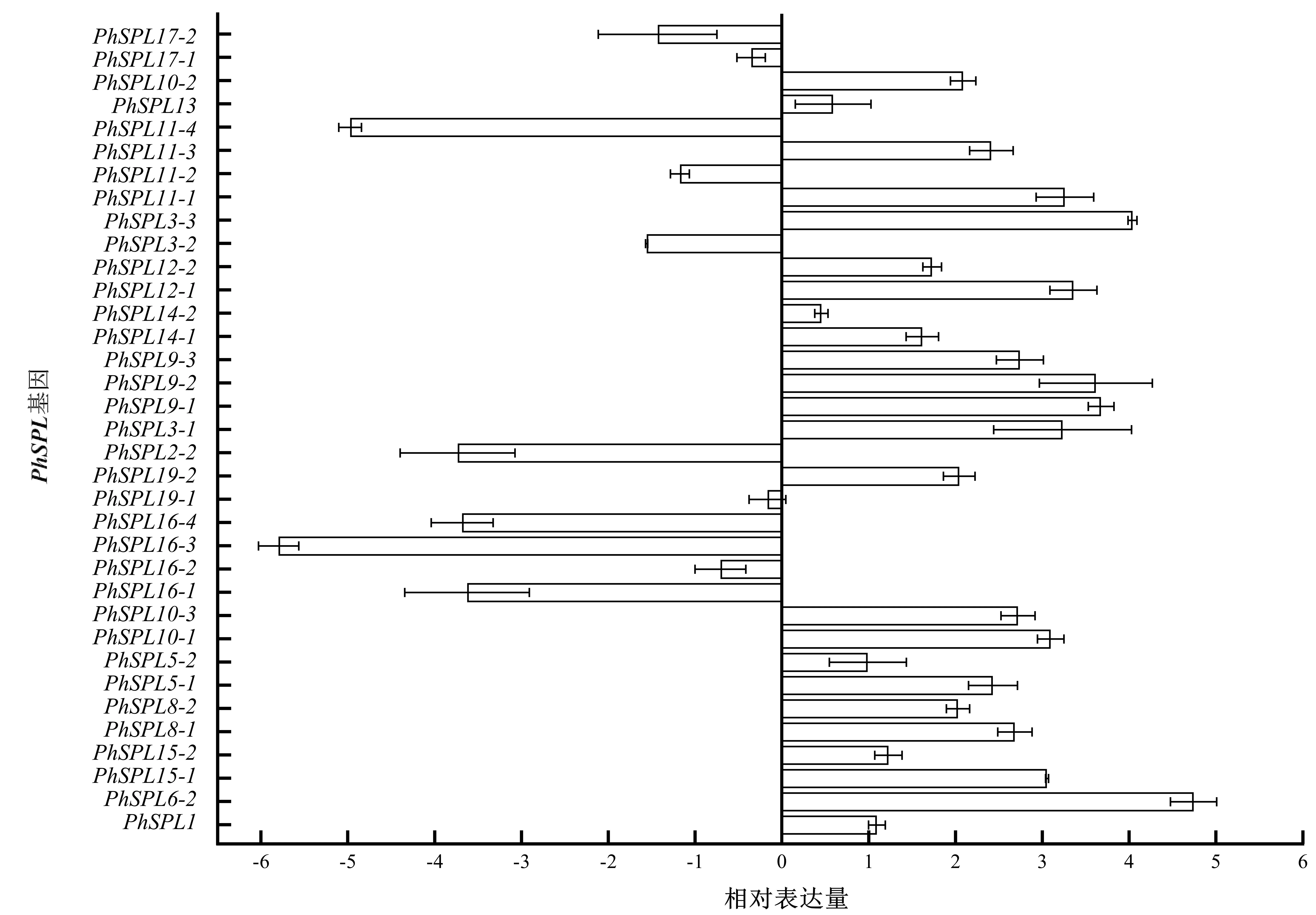
图6 PhJAZ1过表达毛竹植株中PhSPL家族基因的相对表达量Fig.6 Relative expression of PhSPL family genes in PhJAZ1 overexpression moso bamboo
3 讨论
有研究证明,植物体内次生物质含量的变化是抗虫性变化的基础[8].拟南芥中JAZ1蛋白能够负调控下游靶基因的表达,抑制次生物质的产生,进而平衡植株生长发育与免疫之间的关系[5].本研究发现,与饲喂jaz1基因缺失突变体相比,饲喂PhJAZ1过表达拟南芥(PhJAZ1-OX/jaz1)能够显著提高棉铃虫幼虫的体重和存活率,表明PhJAZ1基因对jaz1突变体拟南芥的抗虫性有显著抑制效果,能够弥补jaz1突变体拟南芥中缺失的JAZ1的功能.这说明就抗虫性而言,PhJAZ1与拟南芥的同源基因AtJAZ1的功能相似,能够在一定程度上抑制拟南芥的抗虫性.此外,PhJAZ1过表达能极显著降低拟南芥中单宁和生物碱的含量,以及显著降低毛竹中单宁的含量,这表明PhJAZ1对部分次生物质的合成存在抑制作用,从而调节植物的抗虫性.然而,PhJAZ1对毛竹中次生代谢物质含量的影响与对拟南芥中次生代谢物质含量的影响不同,可能是由于PhJAZ1过表达毛竹的构建是采用瞬时表达的方式,且PhJAZ1对次生代谢物质的表达起抑制作用,故次生代谢物质在短期内不会有明显的变化,也可能是由于拟南芥与毛竹中的下游靶标基因有差异,具体原因有待进一步研究.
在毛竹中构建PhJAZ1瞬时转化体系,并对抗虫相关PhSPL家族基因进行实时荧光定量PCR发现,相对于野生型毛竹,PhJAZ1瞬时转化毛竹中的部分PhSPL基因相对表达量呈上调趋势,说明PhJAZ1对部分PhSPL基因的表达存在调控作用.基于拟南芥、水稻和毛竹SPL基因的同源性分析表明,PhSPL9-1和PhSPL3-1属于类拟南芥AtSPL9/15基因,PhSPL12-1和PhSPL11-1属于类拟南芥SPL2/6基因[21].在拟南芥中,SPL9、SPL15可以对黄酮类化合物(如花青素)的合成进行负调控[14];花青素能响应低温、生物、干旱和盐胁迫,保护植物免受损害[25];同时,SPL9可以结合到JAZ蛋白的N端,通过阻止其降解维持对JA信号途径的负调控,从而降低植株的抗虫性[19].本试验结果表明:在毛竹中构建瞬时转化PhJAZ1体系后,类拟南芥SPL9/15基因PhSPL9-1和PhSPL3-1的表达上调,可以防止PhJAZ1降解,从而持续对JA信号途径进行负调控.而结合对毛竹次生代谢物质含量的测定发现,类拟南芥SPL9/15基因PhSPL9-1和PhSPL3-1对黄酮类化合物合成的调控作用与拟南芥SPL9的作用[14]存在差异,这有待进一步验证.另外,SPL6可以正调控拟南芥的免疫反应[26],而在毛竹中过表达PhJAZ1后,类拟南芥SPL2/6基因PhSPL12-1和PhSPL11-1的表达呈上调趋势,说明这两个基因的作用可能与拟南芥SPL2/6基因的作用存在差异.
综上所述,毛竹在受到食叶害虫为害时能够触发JA信号通路调节抗虫相关PhSPL家族基因的表达以抵御虫害,而PhJAZ1是其中的关键调节因子,可在转录水平上对下游PhSPL家族基因的表达进行调控,进而间接影响次生代谢物质的表达,最终达到调节毛竹抗虫性的目的.

