循环肿瘤细胞与肿瘤精准医学*
张天然,高正良,邓丹
①上海大学医学院 附属南通医院(南通第六人民医院) 老年病研究所,江苏 南通 226011;②同济大学医学院 附属上海市养志康复医院基础研究中心,上海 201619;③复旦大学 基础医学院,上海市重大传染病和生物安全研究院,上海 200032;④上海交通大学医学院 附属新华医院 皮肤科,上海 200092
*国家自然科学基金面上项目(82173396)
†通信作者,研究方向:发育、干细胞生物学、再生医学及肿瘤精准医学。E-mail: zhengliang_gao@shu.edu.cn††通信作者,研究方向:皮肤肿瘤的治疗与临床,脂肪干细胞与组织工程/再生医学。
E-mail: dengdan1234567@126.com
循环肿瘤细胞(circulating tumor cells, CTCs)自从1869年由澳大利亚病理学家托马斯·阿什沃思(Thomas Ashworth)首次在转移癌症患者血液中发现、报道并命名以来,历经百余年的发现和再发现,尤其是在近20多年来,伴随CTCs生物学研究不断深入,相关技术不断进展,在肿瘤精准和个体化医学中开始展现出巨大的应用潜力。
1 CTCs基础生物学
1.1 CTCs与肿瘤转移
肿瘤转移和散播是癌症相关死亡的主要原因。CTCs是从原发或转移肿瘤中脱落并进入血液、淋巴循环的癌细胞,包括具有转移和散播潜力的前体细胞,是肿瘤转移和散播的主要载体,对疾病进展至关重要[1]。肿瘤转移和散播是一个复杂的、多阶段的过程,转移种子细胞(CTCs)需要获得多种特性,并从原发肿瘤中分离、脱落,而后可以通过多种方式浸润、侵入肿瘤周围的血管或淋巴系统,参与循环,以主动或被动的方式到达远端组织[2]。概括而言,CTCs的形成和转移过程主要包括癌细胞释放、免疫逃逸以及与血管或淋巴管黏附、渗出和向远端转移。在这个过程中,肿瘤血管、淋巴管被诱导生成,细胞外基质被消化和重塑,细胞黏附分子下调或者丧失,肿瘤细胞经历上皮-间质转化,细胞微环境也随之改变[3]。一旦CTCs离开循环后在远端组织中定植、存活和增殖,就可能发展成新的病灶,造成肿瘤转移和散播[4-5](图1)。
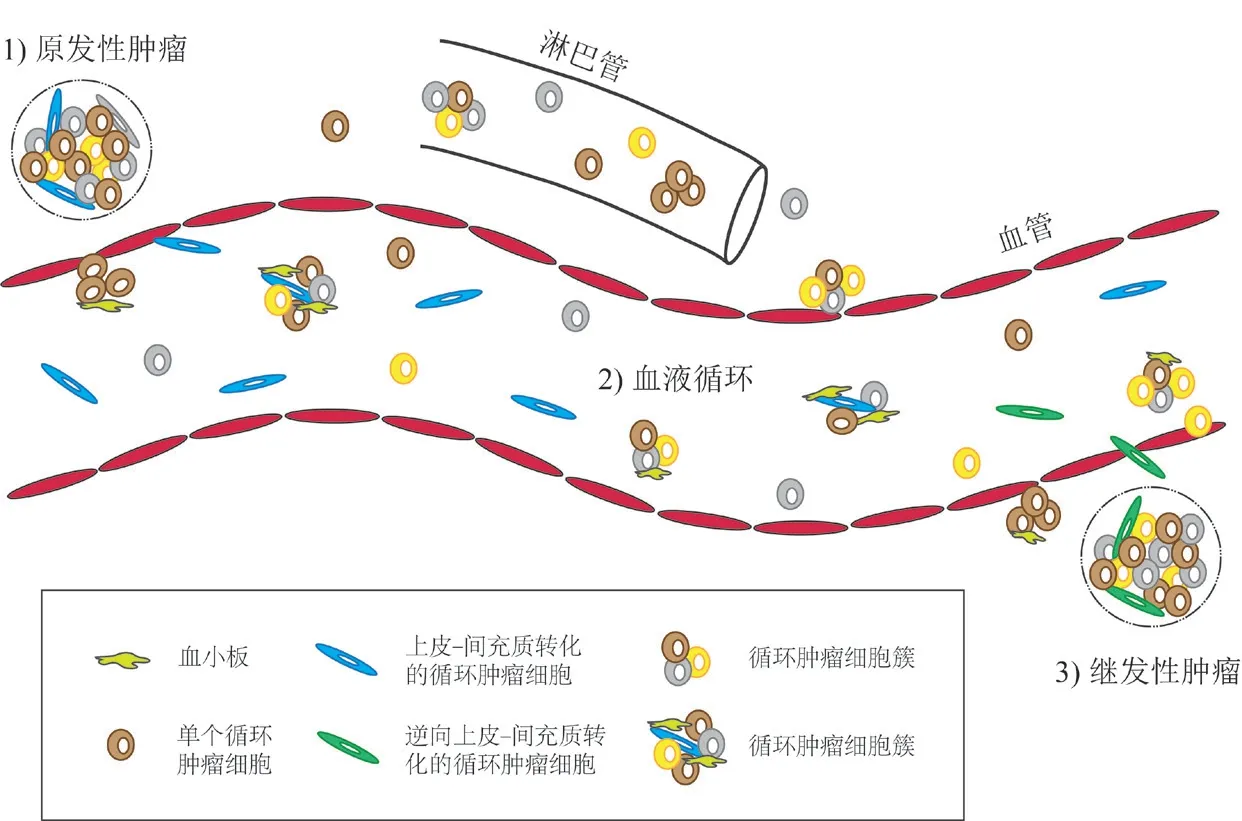
图1 CTCs与肿瘤转移
显然,CTCs是肿瘤转移的中间阶段和载体,但是具有肿瘤干细胞特征和起始能力的CTCs只是少数,最终形成克隆、造成转移和散播新病灶的则更罕见。即便是在肿瘤高度扩散的情况下,单个患者的转移病灶通常也不超过数百个,不是每个CTC都能够起始新的病灶,导致肿瘤转移和散播[6-7]。相反,在外周循环中,大多数CTCs由于受到物理压力、氧化应激、免疫攻击以及生长因子和细胞因子的饥饿或者刺激,而死于循环和转移过程[8-9];少部分CTCs成功进入远端组织,在新的微环境中暂停细胞分裂,以休眠状态存在,从而逃避免疫系统和全身疗法的攻击,获得存活定植、保留其转移病变的能力。当环境条件适宜或接收到适当的信号,部分休眠CTCs被唤醒激活,重新进入细胞周期和增殖,进而发展成明显的转移灶[10]。在乳腺癌和前列腺癌中,休眠的CTCs甚至可以导致早期诊断偏差及治疗数年后的复发,并产生继发性CTCs[11]。
1.2 CTC簇(CTC clusters)
CTC簇是指具有稳定细胞间连接、可以共同穿过血流的含有两个及两个以上细胞的CTC团,或三个及更多CTCs聚集而成的循环肿瘤微栓塞(circulating tumor microemboli, CTM)[1,12]。对CTC簇的研究迄今已有数十年的历史[13],但其形成、存活、传播的过程和转移能力的生物学机制还很不清楚。
肿瘤微环境是由浸润的免疫细胞及与癌症相关的成纤维细胞、间质细胞、周细胞和肿瘤基质等组成,对肿瘤细胞的起始、生长、进展和转移具有重大影响[14-15]。CTC簇的形成可以是CTCs的同型聚集,也可以是CTCs与免疫细胞、基质细胞等异型细胞聚集。在细胞簇中,异型肿瘤基质成分如成纤维细胞、血小板、白细胞、内皮细胞、周细胞等的存在,可以增加细胞簇中CTCs的生存力,抵抗或逃避压力和免疫攻击,赋予其转移、定植的早期生长优势,增强转移和散播潜力[1,16-17]。因此,与CTCs相比,CTC簇作为一个包含肿瘤细胞和其他类型细胞的聚集体,能够自携微环境土壤,即相关的非肿瘤细胞分泌的细胞因子和生长因子,通过最大程度地减少剪切应力、免疫攻击和增加定植能力来避免自身在循环中的损耗,帮助其在外渗后迅速重塑“小生境”而获得独特的生存优势[18-19]。体外使用微流控技术可模拟肿瘤微环境,精确控制小体积液体并以相对较低的成本和高灵敏度快速进行样品处理,更好地解析微环境对CTCs转移的影响并进行抗转移药物的筛选[20]。
与评估对象相关的权属证明、财务会计信息和其他资料是评估的基础性资料,没有这些资料,评估将无法进行。因此,委托人应当及时向评估专业人员提供这些材料,评估专业人员也有权要求委托人提供这些材料。根据本法第十八条的规定,委托人拒绝提供或者不如实提供执行评估业务所需的权属证明、财务会计信息和其他资料的,评估机构有权依法拒绝其履行合同的要求。同时,评估专业人员也有权要求委托人提供为执行公允的评估程序所需的必要协助。例如根据本法第二十五条的规定,评估专业人员应当根据评估业务具体情况,对评估对象进行现场调查。为完成现场调查,评估专业人员有权要求委托人提供必要协助。
尽管CTC簇在外周循环中十分稀少,远少于单个CTC的数量,但是CTC簇细胞中Oct4、Nanog和Sox2等多能性转录因子在基因组上的结合位点附近的DNA甲基化程度较低,靶基因表达具有明显的干细胞特征,因而具有更强(20~100倍)的转移潜能[21]。已有研究表明,CTCs中角蛋白14 (Keratin 14)的表达是CTC簇维持其多克隆组成和较强转移潜能的决定性因素[22]。当外科手术存在CTM时,CTCs转移增加,外周血中CTCs的水平显著提高[11,23]。而当感受到机械压力时,CTC簇还可以迅速发生可逆性重塑,形成链状结构,降低流体动力学阻力,使其能够通过窄小的缝隙[24](图2)。
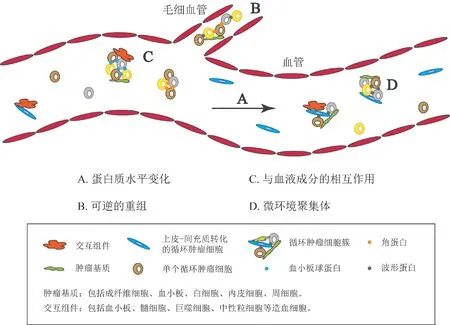
图2 CTC簇(CTM)
1.3 CTCs的异质性
肿瘤异质性(intra-tumor heterogeneity, ITH)的概念最初由Fidler和Hart于1982年提出,包括各种恶性和非恶性肿瘤在内的内部细胞具有遗传、表型和功能异质性,与肿瘤的发展、侵袭、转移、耐药性和复发息息相关[25]。单细胞分析表明,CTCs也具有高度的异质性,一定程度上反映了ITH的程度,并对预后和耐药的研究具有重要意义[1]。肿瘤细胞传播的路径(淋巴管或血管)、入侵和传播形式(单细胞或成簇)以及行为方式(与微环境互相作用或随机进入循环系统)、压力(比如肿瘤治疗)不同,都可能导致CTCs的异质性,甚至采血部位不同检测到的异质性也会不同[26-27]。CTCs分离的最初标准是细胞表面标志物上皮细胞黏附分子(EpCAM+)和/或细胞角蛋白(CK+)、缺乏白细胞常见抗原(CD45-)的有核细胞,但进一步研究表明EpCAM-和/或CK-的CTCs的存在[28-29],使得分离纯化代表性的CTCs亚群变得更加具有挑战。而患有雌激素受体(ER)+/人类表皮生长因子受体2(HER2)-的乳腺癌患者中,HER2+和HER2-CTCs能够共存,并相互动态转换[30]。
肿瘤细胞的上皮-间质转化(epithelialmesenchymal transition, EMT)程序的激活是肿瘤转移、散播过程中的关键事件,也是CTCs异质性产生的一个重要环节。从原发性肿瘤中脱落的单个肿瘤细胞侵入血管并流向全身,部分细胞失去上皮特征,获得间质细胞的特征;在离开血液进入远端组织时,再经历间质-上皮转化(mesenchymal-epithelial transition, MET)过程,增加CTCs在远端组织中的定植、存活[12,31]。因此,EMT能够导致脱落的肿瘤细胞(CTCs)上皮标志物的表达减少,可塑性、迁移和侵袭能力以及对凋亡和衰老抵抗力的增强,CTCs也因此获得肿瘤侵袭和EMT的特征[32-33]。
EMT过程中E型钙黏蛋白(E-cadherin)丢失,细胞间黏附破坏,β-联蛋白(β-catenin)核定位增加,而在间质细胞、成纤维细胞、神经组织和癌细胞中高度表达的N型钙黏蛋白(N-cadherin)升高[34]。迁移CTC簇保留了细胞间连接和间质特征,显示出更高的转移潜能[22,35]。血小板不仅可以黏附围绕CTCs形成细胞纤维蛋白-血小板聚集体,以对抗剪切应力、氧化应激和免疫反应,保护CTCs;而且活化的血小板可以通过分泌生长因子和细胞因子(如TNF-α和β)促进EMT的发生,增加CTCs的侵袭性、活动性和转移潜力[17,36]。脆弱细菌、粪肠球菌、大肠杆菌和核纤梭菌等微生物产生的代谢物和细胞因子也可以促进CTCs的增殖、迁移及EMT的发生,其产生的毒素也能够从上皮细胞中清除E-cadherin,引发EMT,促进CTCs进入静息或休眠状态,逃避攻击,得以存活[37-38]。
然而,EMT对于转移灶的建立并不是必需的,是否激活或部分激活EMT程序取决于细胞所处的环境[31],因而使得部分CTCs在保留上皮性状的同时获得迁移和侵袭的间质细胞特征,导致高度的可塑性和异质性。大多数CTC簇中含有这种具有中间状态、高度可塑和异质性表型的肿瘤细胞[6,33]。
2 CTCs的分离纯化和分子分析
血液中CTCs的数量稀少,如何从大量的血细胞中高效分离纯化CTCs是其生物学研究和临床应用的关键前提。尽管CTCs早在1869年已经被发现报道,但是直到二十世纪五六十年代,过滤、沉淀分离纯化CTCs的方法才出现[39-40],而目前最常用的分离纯化、检测技术——免疫磁珠方法,到1998年才问世[41-42]。从血液样本中分离纯化CTCs的方法有多种 (图3):按照分离原理可分为基于物理特征(如大小和形状、密度、可变形性、细胞表面电荷等)和基于生物特征(表面蛋白标记、胞内蛋白标记、细胞迁移能力等)的方法;按照分离策略可分为对CTCs的正向选择和对其他血细胞的负向耗竭;按照分离细胞的数量又可以分为单细胞分离或多细胞富集[7,28,43]。不同的分离纯化方法的效果以及分离后CTCs存活和可培养状态不同,后期能够开展的研究和应用项目也会不同,给CTCs分离纯化方法、方案的设计和选择带来挑战。CTCs的异质性也大大增加了高效分离纯化具有种群代表性的CTCs的难度。分离纯化技术必须设计合理且足够灵敏,才能够有效获取包括CTC簇在内的稀有异质性种群。
2.1 基于物理特征的分离技术
将CTC按照尺寸和形状、可变形性、密度和细胞表面电荷等物理特征进行分离是较为简便快捷的分离方法。在裂红处理后,血液样本中除了少数CTCs外主要是大量的白细胞,CTCs大小约20~30 μm,比白细胞(8~12 μm)及其他有核血液细胞都大,形态也截然不同。因此通过选择不同大小和形状的孔,可以将二者分离,不过这种简捷的过滤技术常伴随部分较大白细胞的残留[4,44]。
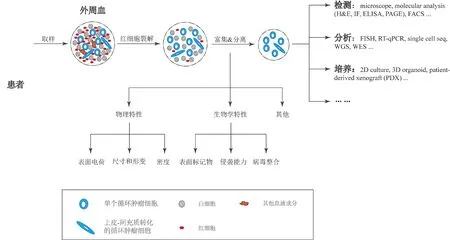
图3 CTCs的分离纯化分析和应用
ISET循环肿瘤细胞捕获仪(Rarecells)是基于肿瘤细胞大小的分离方法。非小细胞肺癌、前列腺癌的研究表明该方法的处理细胞量较大,可以得到较为准确的CTCs计数[45-46]。初步分离纯化的CTCs可以用抗全细胞角蛋白(PanCK)、EpCAM、CD45/CD66b/CD34/CD11b/CD14、波形蛋白(Vim)和CD45等的商业免疫荧光试剂盒进一步鉴定分析[47]。血液样本也可以与ScreenCell FC稀释缓冲液混合裂红,并固定白细胞和CTCs,通过ScreenCell微孔膜过滤器过滤截留收集CTCs;然后可将滤膜置于载玻片上,进行苏木精-曙红(H&E)染色观察。具有恶性特征的CTCs通常≥20 μm,细胞核致密,核/胞质比≥0.75[5,48]。
以CTChip®FR生物芯片为核心技术的ClearCell®FX平台是世界上最早的自动化细胞检索系统之一。它不依赖于细胞表面标记,而是基于迪恩流动分馏(Dean flow fractionation, DFF)涡旋原理,利用CTCs与正常血细胞受力的差异将CTCs温和而快速地分离出来,因此,能够在相对较短的时间内从血液中富集完整有活力的CTCs[49-50]。
与微滤装置不同,柔性微型弹簧阵列(flexible micro spring array, FMSA)技术综合考虑细胞大小和变形性,利用固定在两个聚二甲基硅氧烷(PDMS)的密封O形圈之间的柔性微型弹簧阵列进行CTCs的选择性富集。该方法利用压力传感器(ASDXL;霍尼韦尔)和机械控制阀实现实时压力测量和控制,微尺度的柔性结构和精确的压力调节能够最大程度地减少机械应力对细胞的损害,同时达到通量最大化。该方法无需进行样品预处理,利用微阵列直接从全血中快速富集CTCs后用杜氏磷酸缓冲盐溶液反向洗脱收集CTCs[4,44]。
Parsortix系统利用CTCs的变形特性,通过装置间形成的一定尺寸的间隙对CTCs进行拦截后逆流回收捕获,可以兼容自动染色功能进行细胞鉴别,其优点是细胞活力高,99%的分离细胞能够存活并应用于下游研究和分析[51]。JETTA微流体芯片则利用并行流体通道网络,形成56 320个捕获室,较小的血细胞(如红细胞)和大多数白细胞会逸出,而较大的CTCs则被捕获留存在腔室内[52]。改性埃洛石纳米管(HNT)也可以用于分离纯化CTCs:有黏附蛋白时,带负电荷的十二烷酸钠官能化可以增强HNT对CTCs的吸附和捕获,降低白细胞的黏附;没有黏附蛋白时,癸基三甲基溴化铵官能化导致HNT带电降低,减少CTCs的黏附,增强白细胞的黏附达到正向选择和负向耗竭的双重效果[53]。OncoQuick(Greiner Bio-One)的原理是密度梯度离心,被成功应用于乳腺癌CTCs的分离纯化[25,54]。
2.2 基于生物学特征的分离技术
最常用的基于CTCs生物学特征的分离方法是免疫亲和技术,大多使用特定表面标记物,如上皮细胞标志物和细胞骨架蛋白标志物(细胞角蛋白CKs和EpCAM)的免疫亲和作用将CTCs与其他细胞区分开[55]。不过由于CTC簇混合了上皮-间质特征,这种基于上皮标记物的方法潜在地会低估CTC簇的数量,不能有效检测出间质样细胞[56]。基于免疫亲和原理的CellSearch System是目前最为常用的CTCs临床检测系统,由CellPrep功能单元、CellSearch试剂盒和CellSpotter分析仪组成。作为较成熟的系统,其优点是稳定、可重复,缺点是灵敏度受到统计因素和血量等限制,且只能检测上皮样CTCs[4,57]。AdnaTest BreastCancerSelect系统和改进版AdnaTest CTC AR-V7 mRNA则被用于乳腺癌和去势抵抗性前列腺癌CTCs的检测分析,利用磁珠偶联的肿瘤特异性抗体和EpCAM抗体的免疫亲和作用捕捉外周血中的CTCs,然后通过磁性颗粒浓缩器(MPC)进行富集[58-59]。此外还有IsoFlux系统、HB-Chip、EasySep、磁免疫脂质体(MIL)等技术体系,均是基于免疫亲和原理,利用EpCAM、CD45和肿瘤细胞、白细胞、造血干细胞、血小板的特异性标志物抗体单独或联合与免疫磁珠偶联,提高富集程度和敏感性[18,60-61]。
静电纺丝纳米纤维也可以用于偶联、固定链霉亲和素与相关细胞表面抗原抗体进行CTCs的富集和检测[62]。偶联了EpCAM嵌合单克隆抗体的医用Seldinger导丝(FSMW)可以通过标准静脉套管插入静脉,经过30 min即可对EpCAM和/或细胞角蛋白进行免疫细胞化学染色来鉴定并计数[63]。GILUPI CellCollector则是基于无菌的不锈钢医用导线与EpCAM等抗体共价偶联,直接从癌症患者的手臂静脉内分离CTCs[64-65]。Vita-Assay培养板则是基于侵入性CTCs与组织或肿瘤微环境模拟物(细胞黏附基质或CAM)的高强度黏附力来识别捕捉CTCs的,能将血液中的CTCs富集到100万倍[66]。
总体而言,分离纯化是CTCs领域研究的重点和关键,其技术方法一直在快速进展和优化迭代中。比如基于病毒转染报告基因的CTCs分离纯化方法:通过病毒转染端粒酶特异、复制选择性的GFP报告基因腺病毒比如TelomeScan (O B P-4 0 1; r A d-G F P)或者Te l o m e S c a n F35(OPB-1101; rAdF35-142T-GFP)在CTCs细胞中特异性地产生可以用来识别的GFP信号[67-68]。综合应用物理和生物学特性的分离方法,发挥二者优势,规避各自的劣势。比如:将Ficoll-Paque PLUS密度梯度分离技术与流式细胞检测结合,用Ficoll-Paque PLUS密度梯度纯化富集肝癌病人全血样品中的CTCs细胞,然后利用肝特异性标志物抗体三联免疫荧光染色后进行流式细胞分析和分选[69];或者是将过滤分离纯化与RNA原位杂交(RNA-ISH)分析方法结合,比如CanPatrol技术[70];还有将微孔硅芯片、荧光成像和穿孔技术等结合,比如Punch VyCAp,其CTCs分离成功率可以达到80%~90%[71]。
2.3 CTCs的分子分析
CTCs分离纯化后,可以用H&E染色、免疫荧光染色、ELISA、PAGE、流式细胞分析等技术对CTCs进行计数、鉴定和分析,也可以使用免疫染色结合荧光原位杂交(FISH)、实时定量PCR (RT-qPCR)和各种组学等检测基因组畸变,评估基因的转录水平和蛋白表达水平等。不过,回收CTCs和所含核酸的数量、质量受到体内外和分离纯化过程的影响,给常规分析带来一定的挑战,而采用全基因组测序(WGS)或全外显子测序(WES)对CTCs群体进行分析,可以解决诸如细胞丢失或遗传物质受损等问题,获得高质量的测序文库[72]。CTCs基因组的扩增有三种常用的方法:简并寡核苷酸引发的聚合酶链反应(DOP-PCR)、多重置换扩增(MDA)和多次退火环状循环扩增技术(MALBAC)。DOP-PCR可以用于扩增单个细胞来源的DNA,但基因组覆盖率低(约10%),可以用于拷贝数的评估,但不足以实现良好的单核苷酸变异检测(SNV)。与DOR-PCR刚好相反,MDA技术可以有效检测突变,但是基因组覆盖范围不均衡,不适合拷贝数分析。MALBAC方法可以获得较高且均匀的基因组覆盖率(93%),对于拷贝数变异检测很有用,但假阳性率高,不适合检测点突变[73-75]。CTC转录组的分析方法学进展也很快,包括能够扩增全长转录本或3端区域的Smart-seq2、CELseq、STRT序列等方法[76-77]。随着微流控和单细胞分析技术的进展与突破,CTCs的分子分析将会越来越简捷、可靠和强大。
3 CTCs与肿瘤精准、个体化医学
“液体活检”是通过对体液中分子或细胞标志物的检测达到对机体健康和疾病状态的非侵入性、动态监控和分析,因此在诊断、预后、疾病进展和疗效的监测、疾病机理以及药物靶标的研究方面具有巨大的潜力[78-79]。肿瘤“液体活检”主要指通过对血液中细胞或非细胞形式的核酸、蛋白等的分析,及时准确地为癌症诊疗提供动态进展信息,包括早期肿瘤诊断、风险评估和分期、疗效、预后、复发检测和监控等[80]。主要检测对象包括细胞形式的CTCs(簇)、非细胞形式循环肿瘤DNA(ctDNA)、microRNA和RNA以及胞外囊泡或被肿瘤诱导同化的血小板等[81]。其中cfDNA、CTCs和胞外囊泡等代表着肿瘤液体活检的最前沿和重要进展,在肿瘤诊断、预后等的检测和监测中展现出越来越大的价值[82]。尽管cfDNA和胞外囊泡比CTCs的分离更加简捷,但cfDNA和胞外囊泡等适用的分析比较有限,比如cfDNA主要用于基因组突变的分析[83],CTCs则可以开展诸多其他分析,包括细胞形态、免疫表型和重要表位分析,肿瘤细胞克隆异质性与进化分析,表观遗传组、转录组、蛋白质组和代谢组分析[16,84]。此外,目前临床上常用的穿刺取样给患者带来巨大的疼痛和不便,并且可能无法获得所需的肿瘤细胞,取样过程的侵入性还有增加癌转移的潜在风险。相比而言,基于CTCs的液体活检在临床检测中具有很大的优势:取样简捷易行、无创、可控,一定程度上可以克服肿瘤异质性的问题,在癌症病人诊疗和管理的全流程中可以及时、快捷、安全地提供更详细、动态和个性化的信息,从而支持、指导精准、个体化医疗决策和实践[65,85]。
CTCs的不同特性与癌症类型、分期和治疗应答紧密关联,如CTCs的物理属性、计数、微结构、聚集特征等可以作为有价值的预后指标,CTCs计数和浓度变化则与肿瘤负荷有关,具有部分EMT表型的CTCs与肿瘤的进展、预后及早期复发相关[86-87]。因此CTCs在肿瘤精准、个体化医学中具有广泛、重大的应用价值,对早期诊断、癌症分期、治疗决策、疗效监测、动态确定治疗目标、监测耐药和机制、实时调整治疗和管理策略,以及直接靶向CTCs作为消除转移亚群的治疗策略,肿瘤复发监测和生存期判断等具有重要指导价值[88-89]。
事实上,随着技术的进展,CTCs分析日益成为评估肿瘤转移和复发的首选方法,每7.5 mL血液含有5个以上CTCs成为判定肿瘤转移和复发的领域共识[90]。不仅如此,具有高转移潜能的CTC(簇)通常具有总体基因组DNA低甲基化和局部位点的超甲基化的特点,因此通过分析CTCs的CpG岛的甲基化模式可以帮助确定肿瘤的来源[21,83,91]。同时,类似于DNA甲基化这种具有可逆性的生物标志物为利用表观遗传标志物的动力学来监测疾病的进展和对治疗的反应又提供了新的路径和可能[92]。CTCs分析的价值在乳腺癌、肺癌、结肠直肠癌和前列腺癌等原位和转移性癌症的临床中得到印证,为临床诊断和治疗决策提供了强有力的参考,从而得到日益广泛的推广应用[93-94]。
此外,作为起始培养的种子细胞,CTCs与肿瘤类器官等培养技术的结合更加拓展了CTCs的临床应用路径和价值。已知的CTCs临床前模型有单层细胞培养、三维细胞球培养、三维肿瘤类器官和CTCs衍生的外植体(CDX/PDX)模型等[95-96]。来源于CTCs的培养物可用于药物筛选、疾病建模、基因组编辑、肿瘤免疫疫苗和生物库的建立等(图4)。通过培养和后续分析,可以对具有转移能力的CTCs进行功能解析,深入的蛋白质组学、转录组学和基因组分析,以及药物敏感性筛选[97]。
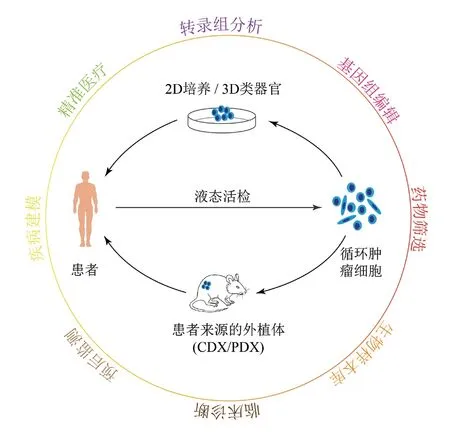
图4 CTCs的潜在应用
4 结语
自澳大利亚病理学家托马斯·阿什沃思于1869年首次发现报道CTCs,历经百余年,特别是近20年来,随着CTCs分离纯化技术的快速进展,CTCs生物学研究取得巨大进步,CTCs的生成、转移散播和异质性及其在肿瘤发展和转移中的作用与机理得到进一步阐明。这些基础和技术突破促进了基于CTCs的肿瘤液体活检技术的快速进展,其潜在应用能够满足肿瘤精准与个体化医学对疾病诊疗动态监控监测的迫切、巨大需求;而CTCs与新兴二代、三代组学、多组学及类器官等技术的结合将广泛拓展CTCs在肿瘤精准、个体化诊疗全流程中的应用,具有给肿瘤疾病的管理带来革命性进展的潜能。
(2021年12月1日收稿)

