生物芯片技术与力学*
王首智,张能辉,任九生
上海大学 力学与工程科学学院,上海市应用数学和力学研究所,上海 200444
生物芯片是指在固相基底(材料一般为玻璃片、硅片或尼龙膜)上放置生物样品,然后由相关仪器收集信号,并用计算机分析和处理的微型化、集成化平台。生物芯片技术是综合了生物学、医学、物理学、微电子学、化学、材料学、力学等学科内容的新兴技术[1]。利用生物芯片技术可将实验室需要很多试管和很多步骤才能完成的检测和操作转移至厘米大小的生物芯片上,具有快速、高通量、低成本、可携带的优点。因此,生物芯片在药物筛选、疾病诊断(如新冠病毒检测)、司法鉴定、个体化治疗、环境监测、食品安全、农业生物、军事工程等多个领域发挥着重要作用[1]。
作为20世纪三大研究计划之一,人类基因组计划中海量数据处理的现实需求极大地推动了生物芯片的兴起和发展。生物芯片起源于1973年萨瑟恩(Southern)基于对豚鼠和小鼠中卫星DNA碱基序列差异性研究提出的核酸杂交理论,即被标记核酸分子能与互补配对的核酸分子杂交[2]。1975年桑格(Sanger)与吉尔伯特(Gilbert)提出了第一代DNA测序法(链终止法),并于1980年获诺贝尔奖[3]。1983年穆利斯(Mullis)提出了简易实现聚合酶链反应(polymerase chain reaction, PCR)的方法,可大量复制DNA样本,并于1993年获诺贝尔奖[4]。在1988年贝恩斯(Bains)创造性地将短DNA片段固定在固相基底之后[5],1995年Brown实验室做出了第一块以玻璃为载体的基因微矩阵芯片[6],1996年Affymetrix公司实现了第一块商业化生物芯片[7]。由此,1998年美国启动了基因芯片计划,使21世纪生物芯片技术得到蓬勃发展。
根据检测分子的差别可将生物芯片分为DNA芯片、蛋白质芯片、组织芯片和器官芯片等。DNA芯片是最早被广泛使用的生物芯片,其核心技术主要包括四个步骤:芯片制备、样品制备、杂交反应和检测信号读取[8]。在制备方面,DNA芯片通常以硅为基底,存在成本高、能耗高、污染严重等问题,于是2016年英国剑桥大学研发了聚合物基[9],2018年奥本大学研发了纸基,从而可在部分领域替代硅基生物芯片[10]。在分子识别方面,采用巯基自组装技术固定的探针分子与待测靶分子识别效率不高,导致基于DNA分子杂交识别的检测灵敏度不高,因此樊春海等[11]提出了框架DNA探针技术,以加强识别信号。在信号读取方面,目前商用DNA芯片主要使用荧光标记法等,检测时间长,成本高,因此研究人员转而寻求可将生物信息转换为电学信号或力学信号的替代技术,如基于微纳力学的机械传感技术[12]。生物芯片中许多技术均与力学息息相关,以下主要介绍生物芯片的技术支撑及相关核心力学问题的研究现状,并对其未来发展前景进行初步展望。
1 生物芯片的技术支撑
生物芯片底层支撑技术主要有微纳加工技术、生物传感技术和微流控技术。微纳加工技术是指加工尺度为微米/纳米尺度的零件及零件制成部件或系统的加工技术,其主要步骤包含薄膜制备(沉积、刻蚀、外延生长、氧化和掺杂等)、掩模制备、图形形成及转移(涂胶、曝光、显影),而其中关键步骤是图形形成及转移[13]。目前研究人员可利用多种技术实现图形形成及转移,如:对于硬材料,可采用与集成电路工艺兼容的表面牺牲层技术[14];对于聚合物、凝胶等软材料,可采用低成本的软刻蚀技术[15];对于聚合物或金属等材料,可采用集光刻、电铸和塑铸环节为一体的LIGA(德文lithographie、galvanoformung和abformung)技术[16]。值得一提的是,20世纪90年代鲁克斯(Roukes)等[17]成功简化了高品质微悬臂梁加工工艺,使这一技术得到广泛应用,促进了生物芯片的快速发展。总之,利用以上微纳加工技术可制备生物芯片所需的固相基底、管道、阀门、马达[18]等微纳装置。
生物芯片技术的实现还需要借助生物传感技术将生物信息转换为人类可读取的信号。生物传感技术原理是将生理活动中物理或化学信息转换为光学、电学、力学信号。若需转换为光学信号,可利用荧光标记和同位素标记等方法;若需转换为电信号,可利用纳米孔测序等方法[19];若需转换为力学信号,可利用吸附引起微梁变形或振动信号的变化[12,20-21],如图1所示。

图1生物芯片示意图:(a)DNA芯片俯视图;(b)微梁簇侧视图;(c)生物信息可被转换为微梁变形信号;(d)生物信息可被转换为微梁振动信号
此外,为实现对缓冲液中生物样品的操控、细胞培养与分离、药物筛选与输运等疾病检测和治疗需要,还需借助微流控技术[22]。微流控技术是一种精确控制、操作与检测微观尺度流体的技术,其通道尺度在100 nm到几百微米之间。在微观尺度下重力与惯性不再起主导作用,而表面张力、能量耗散与流动阻力将主导微观流动的行为。总之,以上有关机械传感技术和微流控技术等涉及力学的固体变形、结构振动、微观流动等基础知识。
2 固体变形
利用生物分子吸附引起固体变形的变化,不但可进行高灵敏度的生物检测,也可以实现溶液条件下微纳装置的驱动。例如,当溶液中DNA靶分子与微梁上探针分子发生杂交反应时,敏感层中质量效应和分子相互作用的变化引起微梁的变形并产生纳米级变化,由此可利用光学杠杆技术或电学技术读出这种纳尺度变形及其变化,从而识别检测物的生物信息(图1(c)和图2)。此外,利用与操纵分子开关或分子棘轮类似的机制,通过调控溶液pH值和离子强度,改变微梁的变形方向或幅度,以实现微观驱动[23-24]。
2.1 分子检测
基于微梁变形机制,除了可以检测DNA分子外[25],也可以检测其他生物分子。例如,张广平[26]通过分析LR型微囊藻毒素与适配体特异性结合引起微梁变形的变化,实现了对微囊藻毒素的高灵敏度检测。
2.2 细胞检测
考尔(Kaur)等[27]尝试将乳腺癌特异性肽18-4作为探针分子,采用微梁悬臂阵列检测了乳腺癌细胞,发现肽18-4是一种极具潜力的识别乳腺癌的探针分子,如图2所示。

图2利用微梁变形信号的乳腺癌细胞检测:(a)参考肽对乳腺癌细胞无响应,无法引起微梁的变形;(b)癌细胞靶向肽18-4与乳腺癌细胞特异性结合,可引起微梁的变形[27]
2.3 变形驱动
在理解生物吸附引起微梁弯曲变形的机制后,可进一步利用生物能与机械能的转化,实现溶液条件下微纳器件的驱动。例如,盖博(Gerber)等[28]尝试利用pH值和离子强度调控DNA-微梁变形的方向和大小,如图3所示。
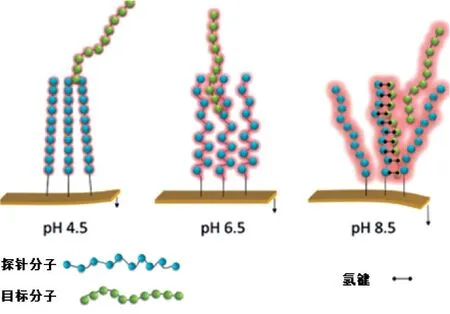
图3 通过pH值调控DNA-微梁变形以实现微纳驱动[28]
3 结构振动
为突破或弥补静态变形检测模式的限制或不足,研究人员可通过观察结构振动信号的变化,获取更丰富的检测信息,提高生物检测的灵敏度、检测速度和可靠性[29]。在利用动态检测模式时,首先,系统利用压电激励等方式使结构产生振动,并记录未吸附时结构的振动信号;然后,将生物分子吸附在结构上或与靶分子相互作用,结构振动信号就会发生改变。于是研究者可通过提取结构振动固有频率、振幅等物理量的变化,感知生物分子的变化[14]。
3.1 大肠杆菌数量检测
在食品安全检测中,大肠杆菌数量是一个重要指标。伊利克(Ilic)等[30]利用微梁振动开展了大肠杆菌的检测研究,实验发现吸附位置变化会引起微梁振动信号产生不同的变化趋势,即:大肠杆菌在自由端吸附时,质量效应主导,微梁固有频率下降;而大肠杆菌在固定端吸附时,刚度效应主导,微梁频率增加。
3.2 细菌耐药性检测
在药物筛选中,细菌耐药性检测需要快速、准确和高通量的方法。桑代特(Thundat)等[31]将双层材料微梁嵌入微流控芯片通道,在梁的内部表面固定有化学或物理功能化的受体,可选择性地捕捉流过通道的细菌,这种吸附引起体系质量和应力的变化,可导致微梁共振频率和振幅的变化,如图4所示。该方法可用于开发便携式、高通量检测仪器,用来实时检测细菌及其对抗生素的反应。

图4利用微梁振动信号的细菌耐药性检测:(a)微梁装置及其内部的细菌;(b)位于芯片底部入口处横截面的扫描电子显微镜图像,可采用微流控技术注入细菌水溶液;(c)32 μm宽微通道的横截面,采用mAb或亮氨酸A,将微梁通道内表面功能化处理后,可利用其特异性反应捕捉李斯特菌;(d)从微梁顶部拍摄的充满荧光标记细菌的图像;(e)微梁尖端的扫描电镜图像,圆形微通道设计有助于确保无堵塞流动;(f)当微梁内部细菌吸收红外光时,会产生局部热量,导致微梁产生纳米力学变形;(g)内部细菌吸附质量变化引起微梁共振频率的漂移;(h)在一定波段范围内红外光照射下,微梁纳米力学变形图显示了细菌可吸收的红外光波长,这为复杂混合物的检测提供了新的选择[31]
3.3 细胞力学性能检测
利用商业原子力显微镜(AFM),Raman等[32]开发了一种新的多通路微梁检测技术,允许AFM以较广泛的频率范围在较大区域(几十微米)快速绘制细胞的力学特性(图5)。
3.4 检测灵敏度的提高
检测灵敏度是基于微梁振动信号生物检测中的关键指标,可采用以下有效措施:①改变微梁截面形状,研究表明采用三角形梁可成倍提高基于频率变化的检测灵敏度[33];②将样本池嵌入微梁中间,可消除缓冲液高黏性阻力造成的振幅损耗[34];③调整吸附物位置,可解耦测量生物分子有关的刚度效应和质量效应变化[35];④基于模态局部化原理,利用连接件耦合多个微梁使局部微梁振幅激增[36]。
4 微观流动
微流控技术已经被广泛应用于生物医学和环境科学等领域,如图4所示,但表面张力是不可回避的技术难题,也给经典管道流体力学理论带来了挑战和发展机遇。在微纳尺度,表面张力是指气液或固液界面液体分子的非均匀分布导致液面产生的收缩效应。它主导了微流体的流动特性,可引起液滴形成与微气泡破裂,需要采用新技术加以控制或利用。对于微液滴,可利用“液体刀”技术来制备[37];对于微气泡,也可在表面张力可控条件下实现药物输送[38]。
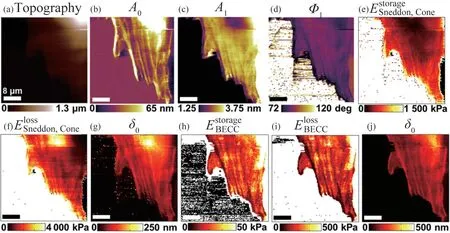
图5利用多通路微梁技术绘制的活鼠成纤维细胞的力学特性图:(a)基于调制平均偏转位移A0并利用洛伦兹力激发微梁扫描的活大鼠成纤维细胞的形貌图像;(b~d)与亚细胞水平分辨率的形貌图同时获取的(A0、A1、Φ1)多谐波图像;(e~g)利用黏弹性Sneddon模型和多谐波数据提取的局部弹性存储模量、黏性损耗模量和平均压痕δ0的映射图;(h~j)利用黏弹性BECC模型和多谐波数据提取的局部弹性存储模量、黏性损耗模量和平均压痕δ0的映射图。其他信息见原文[32]
4.1 核酸检测
鉴于传统核酸检测方法存在对环境和人员要求高、耗时多、操作复杂等不足,吴迪[39]基于微流控技术开发了一种集成式一体化核酸检测微装置,采用自压式气体扩散微泵实现微流体在微管道内的长时间连续、稳定、匀速流动。该装置不仅可以防止交叉污染,还易于操作,可满足病原体即时检测的需求。
4.2 细胞培养
微流控技术为细胞培养提供了一种新的选择,具有用量少、成本低、灵敏度高、准确度高等优点。岳涛等[40]开发了人工血管的自组装技术。考虑到大多数血管只有微米级大小,他们采用微流控芯片装置为细胞提供了一个封闭的环境,并与其他功能部件集成,可执行多种任务,如细胞固定、细胞培养、细胞制造、自组装以及组装结构的提取。
4.3 器官芯片
基于微流控芯片技术也可模拟器官的生理功能,可在单个芯片系统中实现药物的代谢和作用过程。为了研究口服药物后药物经过肠道和肝脏代谢后的疗效与副作用,Choe等[41]设计了一种肠-肝共培养芯片,以重现代谢的过程与药效。尽管仍存在一些挑战,但目前器官芯片已能集成多个器官功能,未来发展方向是对人体的整体模拟[42]。
5 结论与展望
生物芯片应用广泛,市场潜力巨大。生物芯片的发展离不开多个学科的交叉和多种技术的融合,其中与力学紧密相关的机械传感技术和微流控技术等提供了技术支撑和替代性选择。追求更高检测灵敏度、更低廉检测成本和更可靠检测结果是生物芯片技术更新换代的不竭动力。
目前出现的植入式芯片为生物芯片技术发展描绘了美好的未来。植入式芯片优势体现在能远程感知生物信息并加以控制,可将芯片植入到人体内并执行一系列任务,如:植入式眼压检测芯片可检测青光眼病情的发展[43];利用脑机接口技术可控制仿生外骨骼,使严重瘫痪患者恢复活动能力[44];生物计算机可利用DNA等生物分子存储和读入数据[45]。植入式芯片的发展需要结合生物计算机和人工智能等新型技术,实现生物信息收集、数据存储、智能决策和指令执行等,真正做到人机结合。实现这些美好的愿景充满了挑战,需要不断摸索,这也为古老的力学学科孕育出力学信息学新方向提供了土壤。
(2021年12月29日收稿)

