钙对枳生长发育及柑橘溃疡病抗性的影响
肖桂华,文康,韩健,郝晨星,叶蓉春,朱亦赤,萧顺元,邓子牛,马先锋
钙对枳生长发育及柑橘溃疡病抗性的影响
肖桂华1,2,3,文康1,2,3,韩健4,郝晨星1,2,3,叶蓉春1,2,3,朱亦赤1,2,3,萧顺元1,邓子牛1,2,3,马先锋1,2,3
1湖南农业大学园艺学院,长沙 410128;2园艺作物种质创新与新品种选育教育部工程研究中心,长沙 410128;3国家柑橘改良中心长沙分中心,长沙 410128;4湖南省园艺研究所,长沙 410125
【背景】柑橘溃疡病是由柑橘黄单胞杆菌柑橘致病变种(subsp.,)引起的细菌性病害,可侵染枝、叶、果,危害几乎所有的柑橘主栽品种。前期对湖南省39个柑橘园的调查结果显示柑橘果园土壤酸化和交换性钙缺乏严重,叶片中均存在钙缺乏现象。钙是植物所需大量元素之一,钙缺乏会造成植物营养失衡,生长势下降,植物免疫水平受影响。然而,钙元素对柑橘溃疡病抗性的影响尚不明确。【目的】分析对柑橘溃疡病敏感的枳()在不同钙浓度处理下叶片注射接种后的致病差异,探讨钙在侵染枳叶片过程中的作用。【方法】采用沙培法对枳实生苗进行0、0.75、3、30 mmol·L-1钙浓度处理,分别测定枳生长期的生物量、叶绿素a和b浓度、根系和叶片钙元素含量、观察根系活性氧(ROS)的产生和胼胝质沉积,并分析枳叶片接种后细胞壁合成相关基因及免疫途径相关基因诱导表达变化特征。【结果】以3 mmol·L-1钙处理为对照,0、0.75和30 mmol·L-1钙处理后,枳地上部和地下部生长发育均受抑制,叶绿素a和b浓度降低;根系与叶片中的钙含量与外源钙施加量成正比;不同钙浓度处理后根系中产生ROS和胼胝质沉积,在3 mmol·L-1处理时达到最大值;枳叶片接种后,随着钙浓度增加,叶片症状逐渐减轻,但的生长量无明显差异;相较于3 mmol·L-1处理,参与细胞壁合成相关基因在0 mmol·L-1处理下受诱导先上调表达后下调表达,在30 mmol·L-1处理下受诱导上调表达,和在0 mmol·L-1处理下受诱导下调表达,在30 mmol·L-1处理下受诱导上调表达;叶片接种0、2、4、6 dpi后免疫途径相关基因、、在30 mmol·L-1处理下受诱导表达水平高于0 和3 mmol·L-1处理。【结论】钙缺乏和过量均会影响枳生长发育,引起叶片失绿,根系产生ROS和胼胝质沉积均有所减少。施钙后接种,叶片表面的感病症状明显减弱,但菌含量与对照无显著差异。钙可能通过调控细胞壁合成相关基因促使细胞壁增厚,从而抑制突破叶片表皮形成典型症状。
柑橘溃疡病;柑橘黄单胞杆菌柑橘致病变种;钙;枳;免疫
0 引言
【研究意义】柑橘溃疡病由柑橘黄单胞杆菌柑橘致病变种(subsp.,)引起,是柑橘主要栽培品种中严重的细菌性病害之一,在世界范围内造成重大经济损失。前期调查研究显示枳()与柑橘主栽品种同样易感溃疡病,且大部分主栽品种无核,而枳的种子易获得。因此,以枳为试验材料研究防治柑橘溃疡病的措施对柑橘产业健康发展具有重要意义。【前人研究进展】钙是地壳中含量丰富的金属元素之一,也是植物生长不可缺少的元素。尽管钙在自然界中含量丰富,但在需钙量高的果树中容易出现缺钙现象。其中柑橘园中Ca、Mg等营养元素严重缺乏,叶片营养元素缺乏比例分别为N 100%、K 2.6%、Ca 100%、Mg 100%、Zn 53.8%、B 64.1%;P和Mo不缺乏;Fe、Cu、Mn多数超量,少数缺乏,果实品质逐年下降[1]。缺钙严重时,新梢停止生长,叶脉产生斑点,叶面卷曲失绿,影响光合作用,根尖端容易死亡,形成短粗的扫帚根,易引发根腐病等病害,从而影响根系的养分吸收能力[2]。钙是一种不可移动的营养物质,很难从旧组织中重新动员,也很难通过韧皮部重新分配,缺钙症状通常发生在发育中的组织,如嫩叶和根尖[3]。植物利用Ca2+来强化细胞壁,中和液泡阴离子,并提供胁迫保护。除细胞壁外,Ca2+还通过与磷脂的相互作用稳定细胞膜[4]。因此,钙浓度低会削弱细胞壁,例如花粉管或根毛的细胞壁[5]。植物细胞壁可分为初生细胞壁和次生细胞壁,次生细胞壁主要由纤维素、半纤维素和木质素组成。纤维素合成酶A(cellulose synthase A,CesA)催化UDP葡萄糖聚合以合成纤维素微纤维[6]。果胶是植物细胞壁的主要成分,果胶甲基酯酶(pectin methyl esterase,PME)是一种作用于果胶的酶,PME作用产生具有不同结构和功能特性的果胶,在植物生理学中具有重要作用[7],成束状阿拉伯半乳糖蛋白(fasciclin-like arabinogalactan protein,FLA)作为一类与细胞壁结构相关的糖蛋白,可以通过影响树木中的细胞壁组成来调节茎的机械性能[8]。钙除了作为细胞壁和其他细胞结构的重要组成部分外,作为植物细胞中普遍存在的信号物质也发挥着重要的作用[9]。Ca2+是一种普遍的第二信使,参与植物生长发育、非生物胁迫、生物胁迫[10],作用于Ca2+渗透通道,导致细胞质游离Ca2+浓度短暂增加,这些Ca2+信号将外部信号转化为多样的细胞内生化反应[11-14]。据报道,施用外源钙有助于植物抵抗病原菌,在钙浓度高的营养液中培养的番茄植株对假单胞杆菌引起的青枯病抗性增强[15];增加田间大豆植株的钙供应也可以减少疫霉菌所造成的损失[16];高钙供应与诱导防御基因表达之间具有相关性[17]。为了保护自身免受各种生物压力的伤害,植物进化出两层免疫信号网络来提供防御[18],第一层为基础防御,被称为病原相关分子模式激发的免疫反应(pathogen-associated molecular patterns-triggered immunity,PTI),第二层为效应蛋白激发的免疫反应(effector-triggered immunity,ETI)。PTI可通过保守的病原体相关分子模式(pathogen- associated molecular pattern,PAMP)激活质膜(plasma membrane,PM)定位的模式识别受体(pattern recognition receptor,PRR),启动信号级联,激活下游反应,包括细胞质Ca2+的增加、防御相关基因的表达、活性氧(reactive oxygen species,ROS)的产生和胼胝质沉积[19-20]。ROS的快速产生被称为氧化爆发,是在病原体入侵时的一种早期诱导性植物反应,ROS介导的质膜Ca2+通道激活在植物信号转导和发育中起重要作用[21]。NADPH氧化酶AtRbohD和AtRbohF在促进病原菌相关的ROS产生和介导ABA信号转导方面具有双重功能[22-23]。胼胝质除了参与植物正常生长发育,在抵抗病原菌入侵的防御反应中也发挥了重要作用[24],胼胝质沉积在质膜和现有的细胞壁之间,形成物理防御屏障,抵御病原的攻击[20]。【本研究切入点】前期调查发现田间柑橘叶片和果实受溃疡病危害严重,通过对柑橘果实、叶片和土壤等的矿质营养元素分析,结果显示钙均缺乏严重,钙可能是影响柑橘免疫水平的重要元素。【拟解决的关键问题】探明砧木枳对钙的耐受水平和钙对枳生长发育的影响,确定适宜枳生长的钙浓度。解析钙在枳叶片响应侵染中的作用,为柑橘园科学施肥提供理论依据。
1 材料与方法
试验于2019年10月至2022年3月在园艺作物种质创新与新品种选育教育部工程研究中心和国家柑橘改良中心长沙分中心完成。
1.1 试验材料
1.1.1 植物材料 选取柑橘砧木枳的实生苗作为试验材料。将新鲜饱满种子用有效氯浓度为1%、pH为7的次氯酸钠消毒液进行消毒处理,均匀平铺于无菌毛巾上,覆盖上无菌毛巾后置于25—30℃恒温箱中暗培养约10 d进行催芽,选取萌发一致的幼芽,移栽至植物营养土,并放置于植物人工气候室(温度28℃,相对湿度80%,自然光周期)培养。30 d后选取长势一致的幼苗移栽至珍珠岩培养基质中,置于植物人工气候室进行培养。
1.1.2 菌系 供试菌系为本实验室分离纯化的DL509菌株(亚洲A系)。将保存于-80℃冰箱的DL509在LB固体培养基上划线,置于28℃培养箱中培养2 d,挑取单菌落重悬于5 mL液体LB培养基中,在28℃、200 r/min的条件下振荡培养18 h,再取1 mL菌液重悬于50 mL液体LB培养基中,在28℃、200 r/min的条件下振荡培养12 h,4℃、5 000 r/min离心收集菌体,用无菌水重悬菌体,并将重悬液的OD600调至0.62(109CFU/mL左右),然后进行10倍梯度稀释,选择105CFU/mL用于叶片注射。
1.2 方法
1.2.1 钙浓度梯度设置 用无水CaCl2配制0、0.75、3、30 mmol·L-1共4个钙浓度梯度的溶液,浓度梯度设置以完全营养液3 mmol·L-1为基准。营养液中除钙元素外的其他各养分的配置参照1/2 MT培养液的养分成分,CaCl2的添加则根据浓度试验设置的钙浓度。幼苗移栽至珍珠岩培养基质即进行不同钙浓度营养液的处理,每处理3个重复,每个重复选取健康且生长一致的18株幼苗,每隔7 d浇灌营养液150 mL。
1.2.2 生长量测定 采集不同钙浓度处理80 d后的叶片和根系进行拍照观察及生物量的测定,使用格尺测量株高和根长,精确到0.01 cm。将幼苗整株洗净,分为根、叶两部分,吸去多余水分,分别称量植株叶片和根系的鲜重,105℃杀青30 min后80℃烘干至恒重,分别称量植株叶片和根系的干重。
1.2.3 叶绿素浓度测定 叶绿素浓度的测定参考李合生[25]的方法。采集不同钙浓度处理14 d后的叶片测定叶绿素浓度,称取剪碎叶片样品0.1 g装入15 ml离心管中,加入10 ml的95%乙醇后在黑暗条件下浸提24 h,期间颠倒摇晃混匀3—4次;摇匀后吸取200 μL于酶标板上利用多功能酶标仪(TECAN Infinite M200 Pro)测定470、649和665 nm波长处的吸光值(浸提液需进行避光处理)。
1.2.4 叶片和根系钙元素含量测定 枳在珍珠岩基质中培养80 d后,采集整株枳,用锡箔纸包裹后置于105℃烘箱中杀青30 min,然后在65℃恒温条件下烘干至恒重,分别称量植株叶片和根系的干重。用多样品组织研磨机(上海静信实业发展有限公司,型号为TissueIyser-48)分别将烘干叶片和根系样品研磨成粉末状,分别称取25 mg粉末于100 mL小口三角瓶中,加入体积比为4﹕1的浓硝酸与高氯酸的混合酸溶液10 mL,盖上弯颈小漏斗,置于210℃的电热板上消化,直至溶液表面出现白色雾气且消化液清亮即可停止。置于室温条件下冷却至室温,用2%硝酸溶液冲洗转移至25 mL容量瓶中混匀定容,用电感耦合等离子体质谱仪(ICP-OES Optima 8300)进行钙含量的测定。以未添加粉末样品的消化处理为空白对照。
1.2.5 枳根系的ROS原位染色检测 称取3,3′-二氨基联苯胺(3,3′-diaminobenzidine,DAB)粉末30 mg(Sigma-Aldrich,D8001-5G),置于50 mL的试管底部,加入15 μL的浓盐酸促进粉末溶解,再加入30 mL无菌水,先用浓度为0.2 mol·L-1的HCl溶液调至pH 3.0后用0.2 mol·L-1Na2HPO4调至pH 3.8—3.9。将不同钙浓度处理后的根系剪成长度约为1 cm的茎段,置于DAB染色液中,在水平摇床上室温弱光条件下染色约14 h,随后将根系茎段转移至2 mL离心管中,加入1.5 mL脱色液(酒精﹕醋酸﹕甘油为3﹕1﹕1),置于95℃的水浴锅中水浴脱色15 min,脱色至透明,放置于20%无菌甘油中保存备用。
1.2.6 枳根系胼胝质检测 将不同钙浓度处理后的根系剪成长度约为1 cm的茎段,放入2 mL的离心管中,加入酒精与醋酸体积比为3﹕1的脱色液,在水平摇床上室温脱色,每6 h更换一次脱色液,直至完全脱色。然后使用70%酒精漂洗茎段2 h,再转至50%酒精漂洗2 h,随后置于无菌水中漂洗14 h,再用无菌水漂洗2—3次后置于10% NaOH溶液中,在37℃、200 r/min的条件下振荡约2 h,无菌水漂洗5—6次,每次0.5 h,最后加入0.01%苯胺蓝溶液染色14 h,并保存于50%甘油中备用。
1.2.7 叶片PTI免疫及细胞壁相关基因定量分析 不同钙浓度处理的枳叶片接种,采集0、2、4、6 dpi(days post inoculation)的叶片样品,用于细胞壁相关基因和PTI免疫相关基因的表达分析。
利用Promega公司的Eastep Super(LS1040)总RNA提取试剂盒提取总RNA,然后使用Vazyme公司的M-MLV(H-)Reverse Transcriptase试剂盒(9PIM170)合成cDNA。利用NCBI在线分析工具Primer-BLAST(https://www.ncbi.nlm.nih.gov/tools/ primer-blast/)设计检测引物(表1),以为内参基因。选用Vazyme公司的ChamQ Universal SYBP qPCR Master Mix荧光染料,使用BIO-RAD CFX96Touch定量PCR仪进行扩增。反应体系10 μL:cDNA样品2 μL,SYBP qPCR Master Mix 5 μL,上、下游引物(10 mmol·L-1)各0.2 μL,最后加ddH2O水至终体积10 μL。扩增条件:95℃预变性30 s,95℃变性5 s,60℃ 15 s,72℃ 20 s,循环40次,每个样品设置3个重复。数据分析根据2-ΔΔct法完成。

表1 PTI免疫响应相关基因及细胞壁合成相关基因的引物列表
1.3 数据统计与分析
采用Adobe Photoshop CS6、Zeiss Axio Imager 2.0、Image J软件进行图片处理,CFX Manager 3.1软件进行数据分析,Excel 2016和IMB SPSS statistics 23分别进行标准偏差分析和方差分析,GraphPad Prism 5.0绘图。
2 结果
2.1 不同钙浓度处理下枳生长发育的差异
不同钙浓度处理80 d后,枳地上部和地下部的生长出现差异(图1-A、1-B)。与3 mmol·L-1相比,0、0.75、30 mmol·L-1处理时植株高度分别下降16.4%、13.8%、14.6%(图1-C);根系长度分别下降6.1%、3.7%、13.5%(图1-D);地上部鲜重和干重分别下降14.1%、5.9%、32.6%和30.9%、21.6%、19.7%(图1-E、1-F);地下部鲜重和干重分别下降11.8%、7.0%、31.2%和3.6%、3.3%、11.4%(图1-G、1-H)。结果表明,钙浓度为3 mmol·L-1时,地上部和地下部发育良好,0、0.75、30 mmol·L-1处理时均受到不同程度的抑制,其中30 mmol·L-1处理抑制效果最明显。
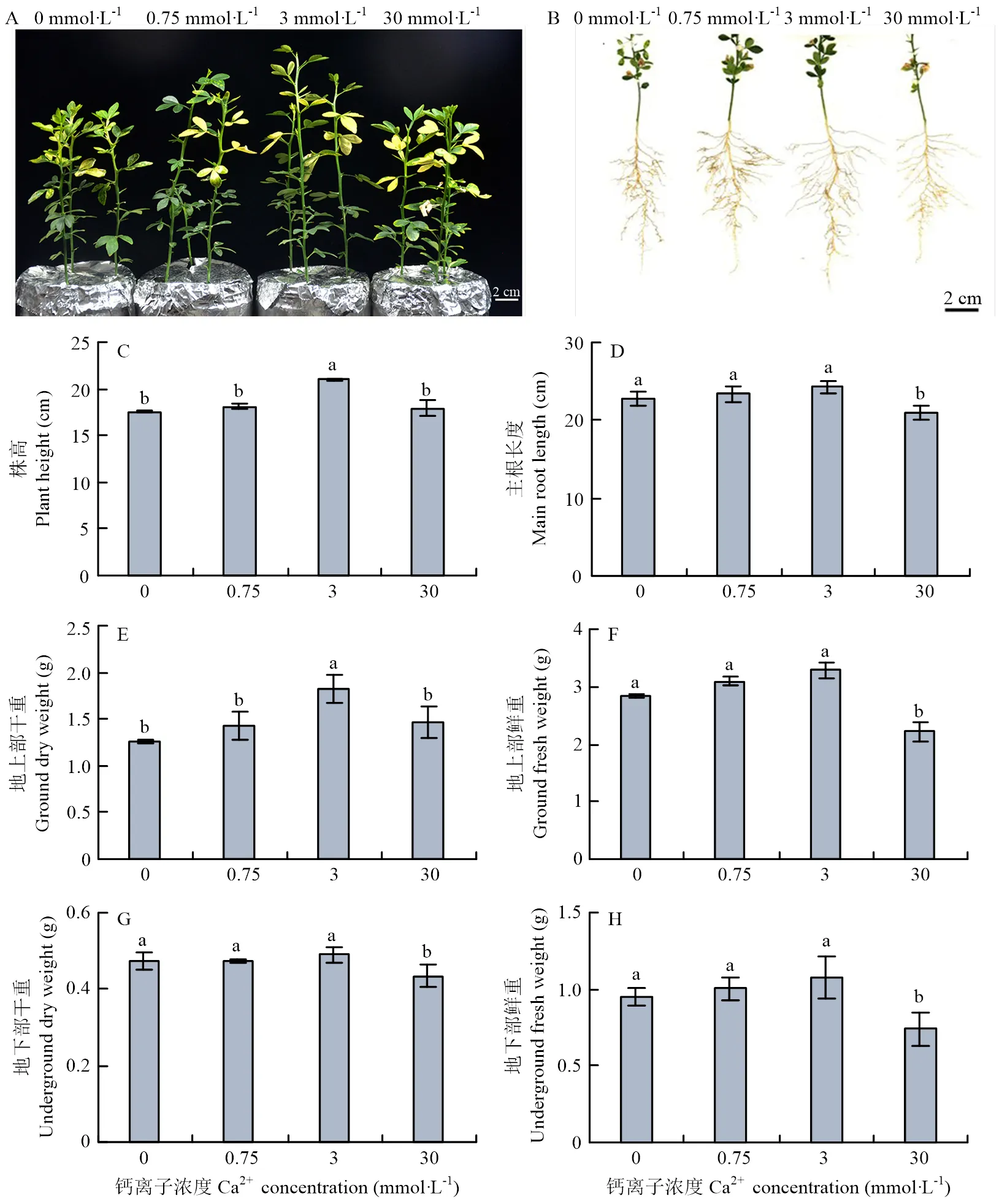
A:实生苗生长发育The development of seedling;B:根系发育The development of root。C—H:采用邓肯检验,柱上标有不同字母表示差异显著(p<0.05)。下同Duncan test, different lowercases on the bars indicate significant difference (p<0.05). The same as below
2.2 不同钙浓度处理下枳叶片中叶绿素浓度
测定了培养14 d后尚未黄化的枳叶片叶绿素a和b的浓度及总叶绿素浓度,与3 mmol·L-1相比较,0、0.75、30 mmol·L-1处理时叶绿素a和b的浓度分别下降23.0%、20.8%、11.0%和20.9%、20.0%、14.2%,总叶绿素浓度分别下降22.4%、20.6%、11.9%(图2)。其中,3 mmol·L-1处理时,叶绿素a和b的浓度及总叶绿素浓度大于其他3个处理,0 mmol·L-1处理时叶绿素a和b的浓度及总叶绿素浓度最低。
2.3 不同钙浓度处理下叶片和根系中钙元素含量变化
不同钙浓度处理枳80 d后,根系及叶片中钙元素含量见图3。随钙离子处理浓度的增加,植株叶片及根系中的钙含量呈现上升的趋势,相较于0 mmol·L-1处理,0.75、3、30 mmol·L-1处理时根系中分别增加了19.1%、58.6%、67.1%,叶片中钙浓度分别增加了19.1%、281.6%、481.3%。结果表明,在根系和叶片中,钙元素含量与外源钙施加量成正比。
2.4 不同钙浓度处理后枳叶片接种Xcc的症状差异
为验证钙在枳响应侵染中的作用,对不同钙浓度处理的枳叶片注射接种105CFU/mL的,15 dpi的症状结果显示,在0—30 mmol·L-1范围内,随着钙浓度的增加,叶片表面出现的症状逐渐减轻(图4-A),其中30 mmol·L-1时,叶片几乎无症状,但细菌定量结果却显示各处理间菌量无明显差异(图4-B),表明单位叶面积的细胞间隙菌量是一致的,细菌在胞间隙的繁殖不受钙浓度的影响。
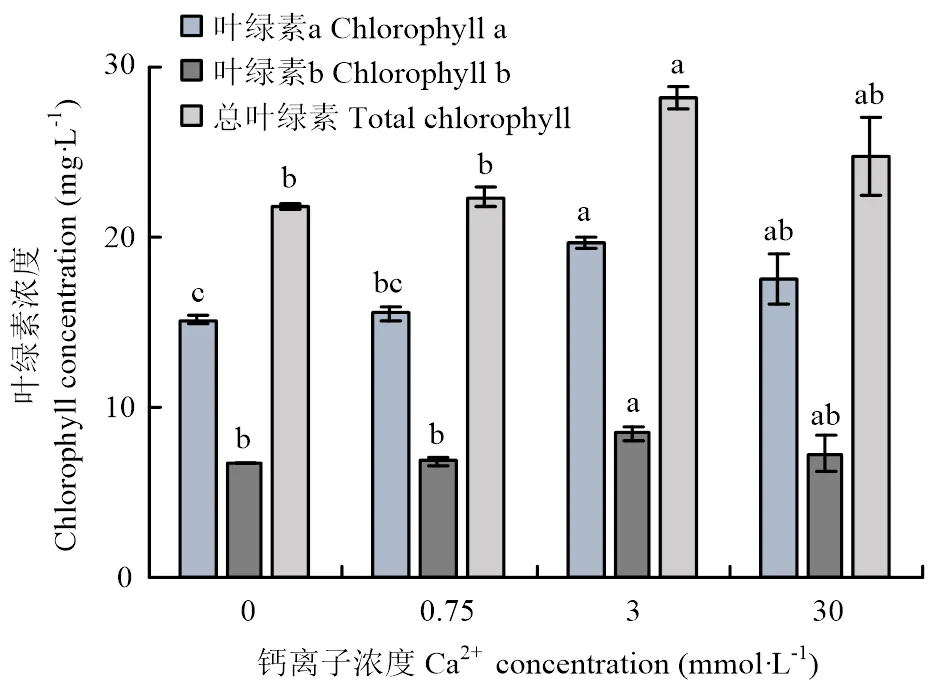
图2 不同钙浓度处理下枳叶片的叶绿素浓度
2.5 钙处理下Xcc入侵枳叶片过程中细胞壁合成相关基因的表达
钙在稳定细胞壁物理结构方面有重要作用,其浓度的升高可能促进叶片细胞壁增厚,以抵御病原菌的入侵[26]。为探明高钙处理下叶片接种后不表现典型症状的原因是否为高钙引起细胞壁物理结构发生变化,分析了钙处理下入侵枳叶片过程中细胞壁合成相关基因、和的表达(图5),结果显示,在0 mmol·L-1处理时,在4 dpi时上调表达、6 dpi时下调表达;和在6 dpi时下调表达;在3 mmol·L-1处理时,、和均下调表达,在30 mmol·L-1处理时,、和均上调表达。上述结果表明30 mmol·L-1钙处理可诱导细胞壁合成相关基因的表达。
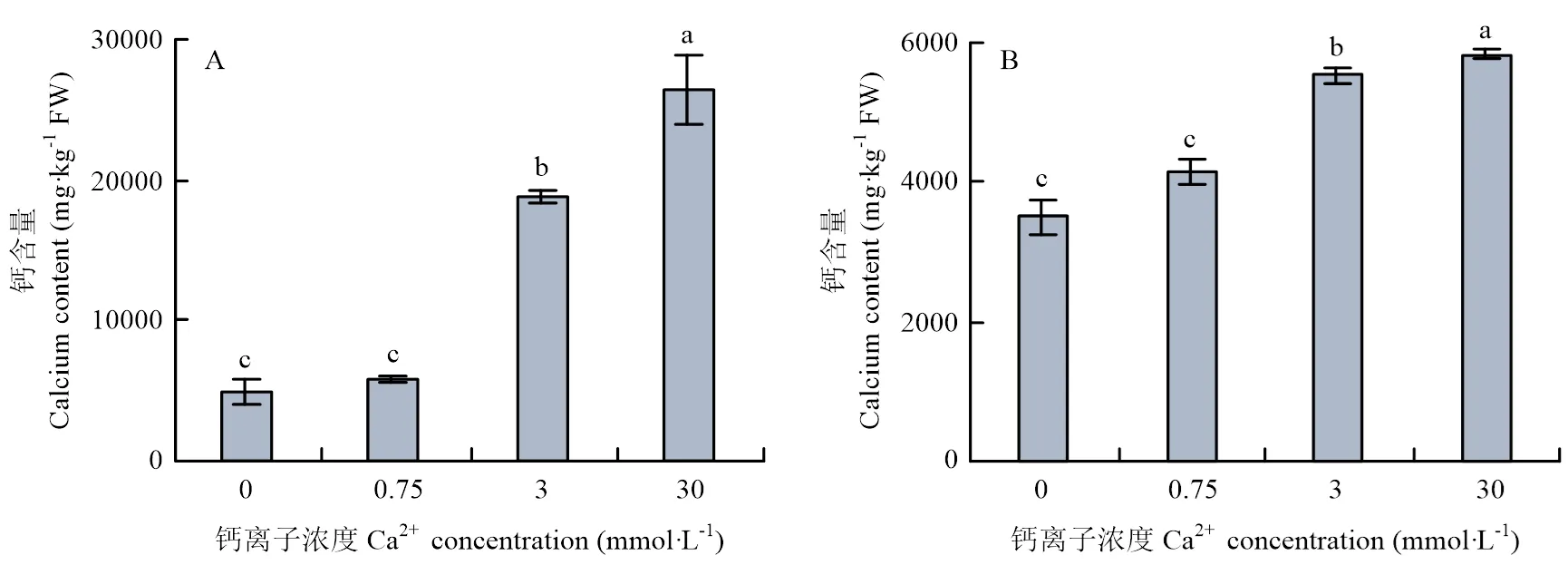
图3 不同钙浓度处理下枳叶片(A)和根系(B)中的钙含量
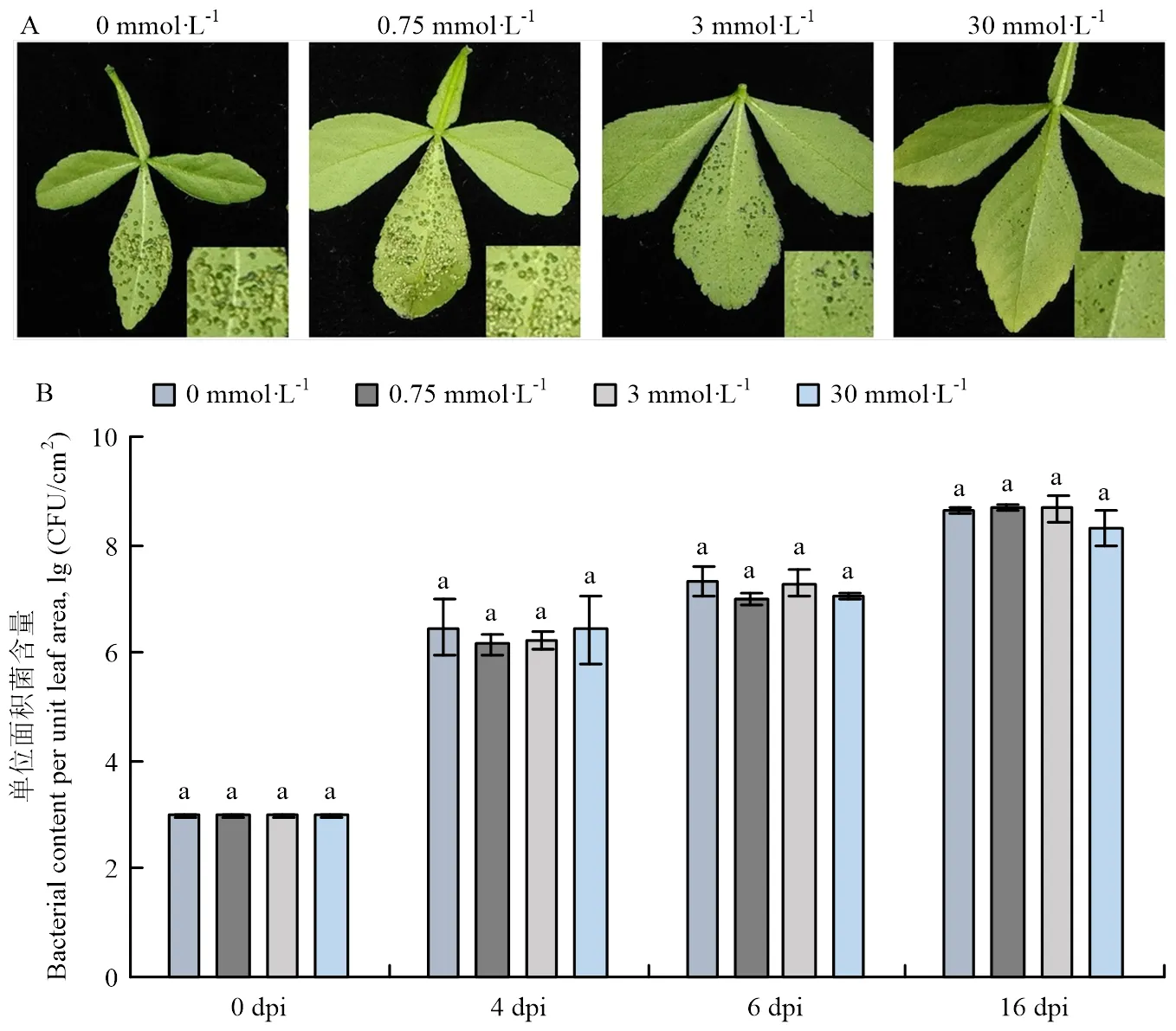
A:接种15 d后症状观察Observation of symptoms at 15 dpi;B:细菌定量分析Quantitative analysis of bacteria content
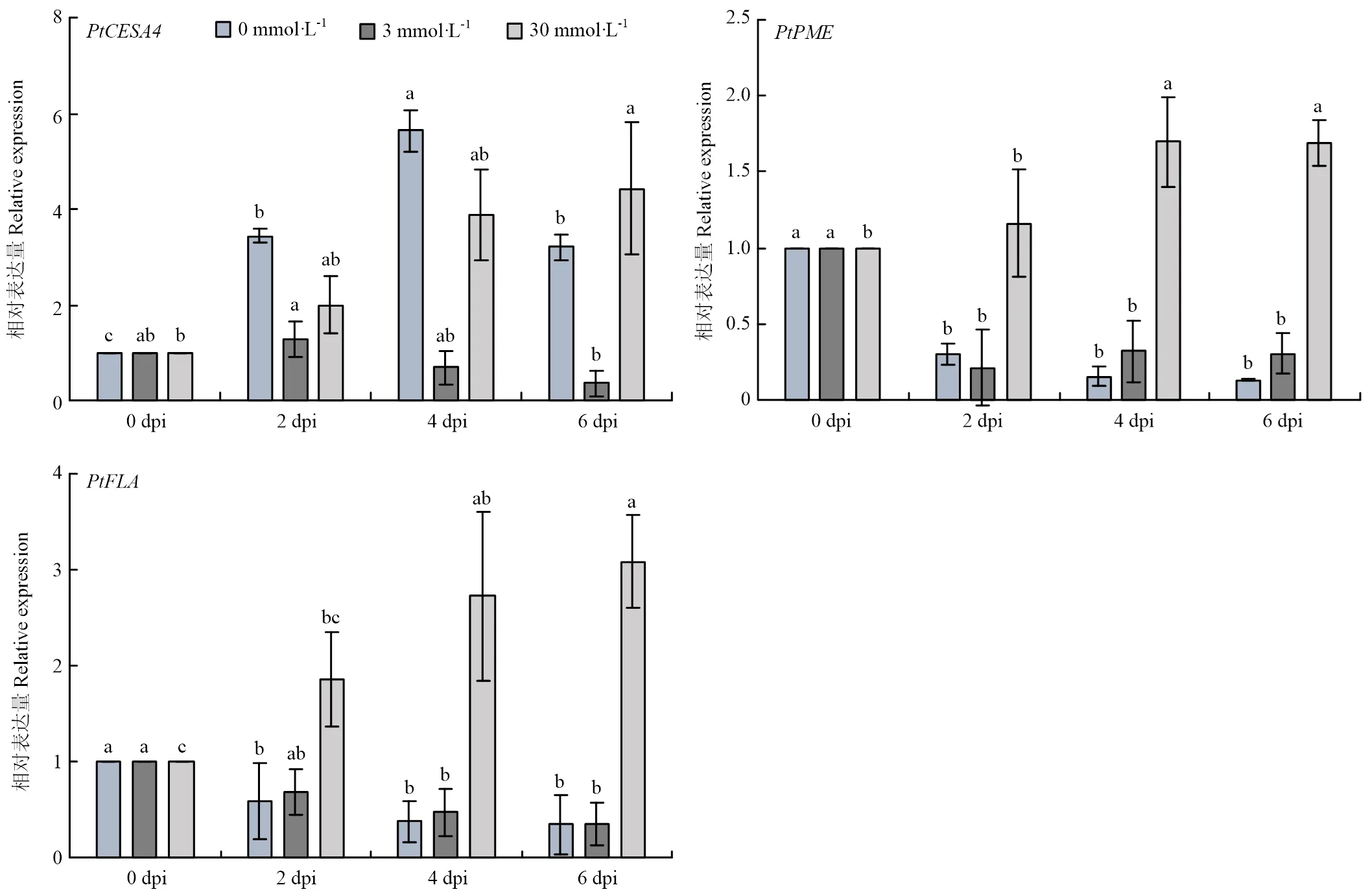
图5 不同钙浓度处理下接种Xcc后参与细胞壁合成相关基因的相对表达量
2.6 钙处理枳叶片接种Xcc后免疫响应相关基因的表达
钙在植物免疫中起着至关重要的作用,为探明高钙能否影响枳叶片的免疫响应水平,分析了钙处理下入侵枳叶片过程中免疫响应相关基因、、的表达(图6),结果显示,0 mmol·L-1处理时,表达量变化不明显,在2—6 dpi表达量呈上升、下降、上升的趋势,在0—6 dpi持续上调表达;3 mmol·L-1处理时,表达量变化不明显,和在6 dpi时均显著上调表达;30 mmol·L-1处理时,在4 dpi时上调表达,6 dpi下调表达,和在6 dpi时均显著上调表达。上述结果表明30 mmol·L-1钙处理枳叶片对的抗性增强。
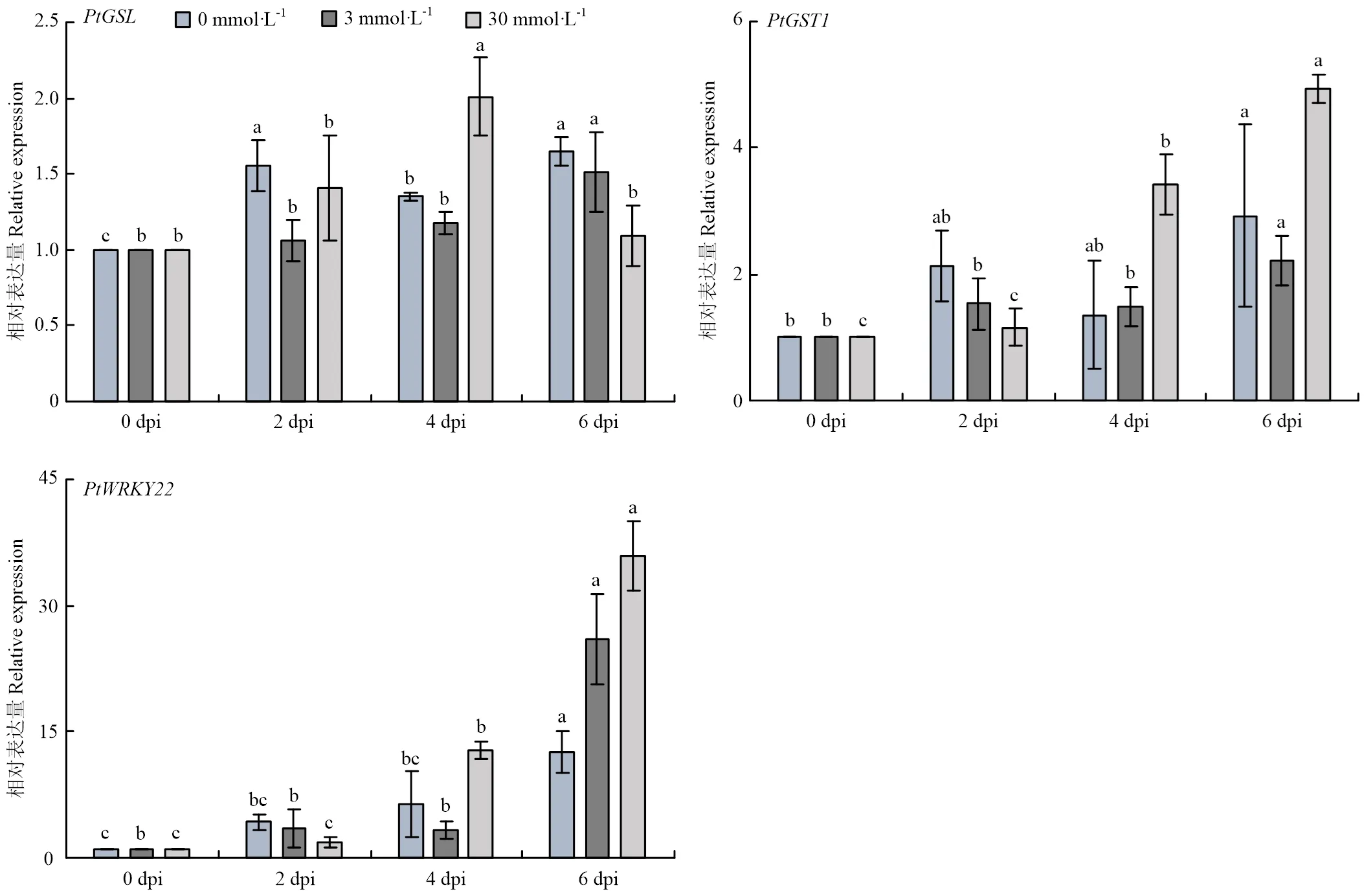
图6 不同钙浓度处理下接种Xcc后免疫响应相关基因的相对表达量
2.7 钙处理枳根系ROS的爆发及胼胝质沉积
外源钙的施加可能引起植物ROS的爆发及胼胝质沉积。在0、30 mmol·L-1处理下,枳根系中ROS产生的两个关键基因和均下调表达(图7-C、7-D)。观察不同钙浓度处理枳根系中ROS的爆发和胼胝质沉积(图7-A、7-B),3 mmol·L-1处理时枳根系维管形成层中产生ROS和胼胝质沉积达到最大值,0、30 mmol·L-1处理后产生ROS和胼胝质沉积均有所减少。结果表明适当钙浓度会刺激枳根系产生ROS和胼胝质沉积,从而抵御病原菌的入侵。
3 讨论
3.1 外源钙影响枳的生长
前期对湖南省39个果园的调查研究显示果园钙缺乏现象普遍,栽培品种受柑橘溃疡病的危害越来越严重。且大部分果园施肥以复合肥为主,少施钙肥。针对湖南地区偏酸性的土壤,应重视钙肥的施用[1]。根据本研究的结果,钙缺乏是导致柑橘叶片易感溃疡病的原因之一,但是过量钙可能导致毒害,而适量钙能有效促进植株的生长发育,增大叶面积,促进植株光合效率[27]。为了探明砧木枳对钙的耐受水平和钙对枳生长发育的影响,预试验分析了不同钙浓度梯度处理(0、0.75、1.5、3、7.5、15、30、60 mmol·L-1)对枳生长发育的影响,观察比较结果显示1.5和0.75 mmol·L-1处理生长差异不大,7.5、15和30 mmol·L-1处理差异也不明显,60 mmol·L-1处理时枳在移栽两周内死亡,因此采用0、0.75、3、30 mmol·L-1这4个钙浓度开展研究。
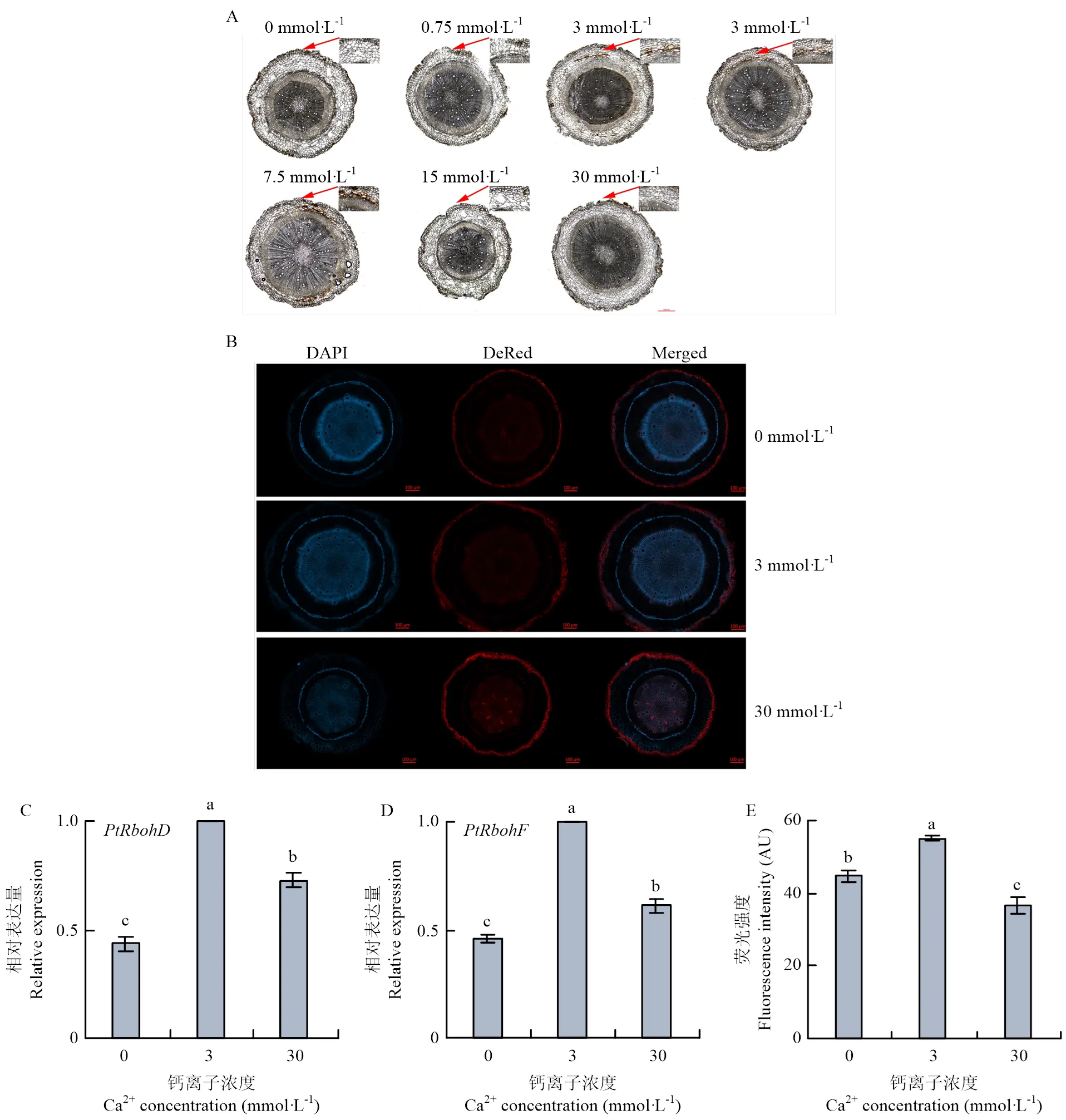
A:枳根系DAB染色,比例尺:200 μm DAB staining of P. trifoliata roots, scale: 200 μm;B:枳根系的胼胝质染色,比例尺:100 μm Callose staining of P. trifoliata roots, scale: 100 μm;C、D:PtRbohD、PtRbohF相对表达量relative expression level of PtRbohD, PtRbohF;E:胼胝质沉积部位平均荧光强度Average fluorescence intensity of callose deposition site
钙不仅能影响植物地上部分和地下部分生长发育[28],且外源钙喷施后可改善其营养品质[29]。本研究对施钙前后枳地上部和地下部生长发育进行分析,结果显示外源钙促进枳生长发育,其中最适合枳生长的钙浓度为3 mmol·L-1,与常用的基本培养基配方中的钙离子浓度一致。钙浓度过度增加对枳生长不利,这与张芳等[30]在枸骨木和南酸枣中的结果是一致的。推测钙浓度为3 mmol·L-1时可能适用于大部分植物生长。枳作为砧木具有很多优良性状,摸索出最适宜枳生长的钙浓度对产业发展具有一定的指导意义。同时,在其他的柑橘种质中是否也存在类似规律是未来研究的方向。
3.2 外源钙对叶绿素含量和元素吸收的影响
植物体内钙的含量变化对其生长发育有较大影响[31],缺钙时,植株养分缺乏,影响生长发育进程,钙过量时抑制对其他元素的吸收和利用。适量钙能促进植物对镁和铁的吸收,但钙过量会影响植物对镁的吸收和分配,从而影响叶绿素的合成,最终对植物光合产生影响[32-33]。本研究中,枳叶片在0、0.75、30 mmol·L-1处理下,叶绿素a和b浓度降低,钙含量的降低会影响枳叶片中叶绿素的合成,引起叶片失绿。这与杨阳等[34]在葡萄中的研究结果相似,其结果表明喷施外源钙能有效缓解干旱对葡萄叶片光合作用的抑制。3 mmol·L-1处理时枳叶片也表现一定程度的黄化现象,这可能与枳在不同生长时期所需养分不一致有关。本研究中只探讨了钙浓度的变化对枳的影响,尚未针对不同时期枳所需其他养分进行研究。探明钙对镁、钾等其他元素吸收的影响,以及这些元素在植物免疫方面的作用是未来研究的重要方向。
3.3 外源钙对Xcc入侵过程的影响
钙对真菌和细菌产生的细胞壁降解酶有抑制作用,较高的钙浓度可抑制细胞壁降解酶的活性,从而抵御病菌的入侵[35]。在本研究中,枳叶片接种后,0—30 mmol·L-1钙处理范围内,叶片感病症状存在差异,且在30 mmol·L-1钙处理下,细胞壁合成相关基因、和上调表达。钙处理可诱导细胞壁合成相关基因的表达,可能促使叶片细胞壁增厚,从而改变叶片细胞壁物理结构,侵染难以突破细胞壁形成典型火山口症状。这与Langer等[36]的研究具有相似之处,其结果证实CaCl2处理可改变草莓果实的细胞壁代谢并激活防御反应。
ROS的爆发是植物产生抗性反应的重要标志之一。提高叶绿体中H2O2的含量可以提高农作物对盐胁迫的抗性,来源于叶绿体中的ROS对植物的抗逆应答十分重要[37]。作为植物的另一道防御屏障,胼胝质是一种广泛分布于高等植物中的-(1,3)-D-葡聚糖,除了参与植物正常生长发育,在植物防御中也发挥了重要作用[24]。Müller等[38]研究表明,过表达后在低磷中可触发铁积累和胼胝质在初生根分生组织和伸长区的沉积,这将根分生组织中胼胝质调节的细胞间信号与非生物信号的感知联系起来。本研究中,钙处理后枳根系维管组织形成层中产生ROS和胼胝质,触发枳产生自身免疫应答反应,但缺钙处理和高钙处理下反而减弱甚至失去这种诱导免疫应激反应的能力,这可能与30 mmol·L-1处理时枳根系发育受到抑制有关。
可以被病原体相关分子模式(PAMP)激活,诱导丝裂原激活的蛋白激酶(mitogen- activated protein kinase,MAPK)级联反应,是病原体触发免疫的标志基因[23,39]。在拟南芥、水稻和胡椒中,的表达被病原菌诱导上调并导致宿主耐药性[40-42]。基因家族被预测为编码具有特定生物学功能和亚细胞定位的胼胝体合成酶[43]。在本研究中,钙处理下枳叶片接种后感病症状存在差异,在30 mmol·L-1处理下免疫防御基因上调表达,这与枳叶片在30 mmol·L-1钙处理后表现对溃疡病的抗性相吻合。
4 结论
不同浓度钙处理后枳地上部和地下部的生长发育差异明显,3 mmol·L-1钙浓度处理最适合枳的生长。钙处理后根系产生ROS和胼胝质沉积也存在差异,其中3 mmol·L-1ROS和胼胝质沉积量最多。钙诱导细胞壁合成相关基因表达,钙浓度增加可能会促使叶片细胞壁增厚,且高钙处理后免疫防御基因、、上调表达,抑制突破叶表皮形成典型症状。未来可以在施肥中加入适量的钙,促进柑橘的生长发育、改善其果实品质、提高免疫水平,并抑制的入侵。
[1] 赵宜波, 韩健, 杨贵兵, 龙立长, 谭振华, 李先信, 周卫军, 邓子牛, 马先锋. 湖南省甜橙主产区土壤和叶果矿质元素状况分析. 中国南方果树, 2020, 49(6): 27-33.
ZHAO Y B, HAN J, YANG G B, LONG L C, TAN Z H, LI X X, ZHOU W J, DENG Z N, MA X F. Analysis of soil and leaf and fruit mineral elements in main producing areas of sweet orange in Hunan Province. South China Fruits, 2020, 49(6): 27-33. (in chinese)
[2] 杨利玲, 张桂兰. 土壤中的钙化学与植物的钙营养. 甘肃农业, 2006(10): 272-273.
YANG L L, ZHANG G L. Calcium chemistry in soil and calcium nutrition in plants. Gansu Agriculture, 2006(10): 272-273. (in chinese)
[3] WHITE P J, BROADLEY M R. Calcium in plants. Annals of Botany, 2003, 92(4): 487-511.
[4] HEPLER P K. Calcium: a central regulator of plant growth and development. The Plant Cell, 2005, 17(8): 2142-2155.
[5] BASCOM C S, HEPLER P K, BEZANILLA M. Interplay between ions, the cytoskeleton, and cell wall properties during tip growth. Plant physiology, 2018, 176(1): 28-40.
[6] YAMAMOTO T, NAKAMURA A, IWAI H, ISHII T, MA J F, YOKOYAMA R, NISHITANI K, SATOH S, FURUKAWA J. Effect of silicon deficiency on secondary cell wall synthesis in rice leaf. Journal of Plant Research, 2012, 125(6): 771-779.
[7] GIOVANE A, SERVILLO L, BALESTRIERI C, RAIOLA A, D’AVINO R, TAMBURRINI M, CIARDIELLO M A, CAMARDELLA L. Pectin methylesterase inhibitor. Biochimica et biophysica acta, 2004, 1696(2): 245-252.
[8] WANG H, JIANG C, WANG C, YANG Y, YANG L, GAO X, ZHANG H. Antisense expression of the fasciclin-like arabinogalactan protein FLA6 gene ininhibits expression of its homologous genes and alters stem biomechanics and cell wall composition in transgenic trees. Journal of Experimental Botany, 2015, 66(5): 1291-1302.
[9] HIRSCHI K D. The calcium conundrum. Both versatile nutrient and specific signal. Plant physiology, 2004, 136(1): 2438-2442.
[10] DODD A N, KUDLA J, SANDERS D. The language of calcium signaling. Annual review of plant biology, 2010, 61: 593-620.
[11] FINKA A, CUENDET A F, MAATHUIS F J, SAIDI Y, GOLOUBINOFF P. Plasma membrane cyclic nucleotide gated calcium channels control land plant thermal sensing and acquired thermotolerance. The Plant Cell, 2012, 24(8): 3333-3348.
[12] TUNC-OZDEMIR M, TANG C, ISHKA M R, BROWN E, GROVES N R, MYERS C T, RATO C, POULSEN L R, MCDOWELL S, MILLER G, MITTLER R, HARPER J F. A cyclic nucleotide-gated channel (CNGC16) in pollen is critical for stress tolerance in pollen reproductive development. Plant physiology, 2013, 161(2): 1010-1020.
[13] TOYOTA M, SPENCER D, SAWAI-TOYOTA S, JIAQI W, ZHANG T, KOO A J, HOWE G A, GILROY S. Glutamate triggers long-distance, calcium-based plant defense signaling. Science, 2018, 361(6407): 1112-1115.
[14] JIANG Z, ZHOU X, TAO M, YUAN F, LIU L, WU F, WU X, XIANG Y, NIU Y, LIU F,. Plant cell-surface GIPC sphingolipids sense salt to trigger Ca2+influx. Nature, 2019, 572(7769): 341-346.
[15] CALDWELL D, KIM B S, IYER-PASCUZZI A S.differentially colonizes roots of resistant and susceptible tomato plants. Phytopathology, 2017, 107(5): 528-536.
[16] SUGIMOTO T, WATANABE K, YOSHIDA S, AINO M, FURIKI M, SHIONO M, MATOH T, BIGGS A R. Field application of calcium to reduce phytophthora stem rot of soybean, and calcium distribution in plants. Plant Disease, 2010, 94(7): 812-819.
[17] RAZ V, FLUHR R. Calcium requirement for ethylene-dependent responses. The Plant Cell, 1992, 4(9): 1123-1130.
[18] BOLLER T, HE S Y. Innate immunity in plants: an arms race between pattern recognition receptors in plants and effectors in microbial pathogens. Science, 2009, 324(5928): 742-744.
[19] MORALES J, KADOTA Y, ZIPFEL C, MOLINA A, TORRES M A. TheNADPH oxidasesanddisplay differential expression patterns and contributions during plant immunity. Journal of Experimental Botany, 2016, 67(6): 1663-1676.
[20] VOIGT C A. Callose-mediated resistance to pathogenic intruders in plant defense-related papillae. Frontiers in Plant Science, 2014, 5: 168.
[21] WOJTASZEK P. Oxidative burst: an early plant response to pathogen infection. The Biochemical journal, 1997, 322(3): 681-692.
[22] TORRES M A, ONOUCHI H, HAMADA S, MACHIDA C, HAMMOND-KOSACK K E, JONES J D. Sixhomologues of the human respiratory burst oxidase (gp91phox). The Plant journal, 1998, 14(3): 365-370.
[23] KLOTH K J, WIEGERS G L, BUSSCHER-LANGE J, VAN HAARST J C, KRUIJER W, BOUWMEESTER H J, DICKE M, JONGSMA M A. AtWRKY22 promotes susceptibility to aphids and modulates salicylic acid and jasmonic acid signalling. Journal of Experimental Botany, 2016, 67(11): 3383-3396.
[24] WANG Y, LI X F, FAN B F, ZHU C, CHEN Z X. Regulation and function of defense-related callose deposition in plants. International Journal of Molecular Science, 2021, 22(5): 2393.
[25] 李合生. 现代植物生理学. 3版. 北京: 高等教育出版社, 2012.
LI H S. Modern Plant Physiology. 3rd ed. Beijing: Higher Education Press, 2012. (in chinese)
[26] ZHANG Q, XIE Z, ZHANG R, XU P, LIU H, YANG H, DOBLIN M S, BACIC A, LI L. Blue light regulates secondary cell wall thickening via MYC2/MYC4 activation of the-directed transcriptional network in. The Plant Cell, 2018, 30(10): 2512-2528.
[27] 张海平, 单世华, 蔡来龙, 官德义, 李毓, 庄伟建. 钙对花生植株生长和叶片活性氧防御系统的影响. 中国油料作物学报, 2004, 26(3): 33-36.
ZHANG H P, SHAN S H, CAI L L, GUAN D Y, LI Y, ZHUANG W J. Effects of calcium on peanut plant growth and defense system of active oxygen in leaves. Chinese Journal of Oil Crop Sciences, 2004, 26(3): 33-36. (in chinese)
[28] 任城帅, 李慧, 翁小航, 张淞著, 刘丽颖, 周永斌. 外源钙对水曲柳生长、光合特性及水分利用效率的影响. 沈阳农业大学学报, 2020, 51(6): 663-669.
REN C S, LI H, WENG X H, ZHANG S Z, LIU L Y, ZHOU Y B. Effects of exogenous calcium on growth, photosynthetic characteristics and water use efficiency of. Journal of Shenyang Agricultural University, 2020, 51(6): 663-669. (in chinese)
[29] 姚棋, 韩天云, 梁祎, 石玉, 侯雷平, 张毅. 外源钙和EBR处理对番茄果实品质特性的影响. 中国瓜菜, 2021, 34(10): 74-79.
YAO Q, HAN T Y, LIANG Y, SHI Y, HOU L P, ZHANG Y. Effects of exogenous calcium and EBR treatment on fruit quality characteristics of tomato. China Cucurbits and Vegetables, 2021, 34(10): 74-79. (in chinese)
[30] 张芳, 宋敏, 彭晚霞, 曾馥平, 杜虎, 胡芳, 陈莉, 苏樑. 不同钙浓度对两种岩溶植物幼苗生长及其酶活性的影响. 广西植物, 2017, 37(6): 707-715.
ZHANG F, SONG M, PENG W X, ZENG F P, DU H, HU F, CHEN L, SU L. Effects of different calcium concentrations on seedling growth and enzyme activities of two karst plant species. Guihaia, 2017, 37(6): 707-715. (in chinese)
[31] THOR K. Calcium-nutrient and messenger. Frontiers in Plant Science, 2019, 10: 440.
[32] 李敏, 吉文丽, 张恒, 李程程, 杨静萱, 张延龙. 外源Ca2+对油用牡丹凤丹白幼苗光合特性的影响. 西北林学院学报, 2017, 32(5): 39-45.
LI M, JI W L, ZHANG H, LI C C, YANG J X, ZHANG Y L. Effects of exogenous calcium on photosynthetic characteristics and biomass of oil‘Fengdan White’. Journal of Northwest Forestry University, 2017, 32(5): 39-45. (in chinese)
[33] 汪雷, 马琛, 高海立, 徐涛. 钙对半夏生理特性及光合生理的影响. 浙江理工大学学报(自然科学版), 2018, 39(4): 461-467.
WANG L, MA C, GAO H L, XU T. Effects of calcium on physiological characteristics and photosynthetic physiology of. Journal of Zhejiang Sci-Tech University (Natural Sciences), 2018, 39(4): 461-467. (in chinese)
[34] 杨阳, 王恒振, 王咏梅, 管雪强, 尹向田, 苏玲. 喷钙对干旱胁迫下葡萄光合作用及叶绿素荧光参数的影响. 安徽农业科学, 2017, 45(27): 62-64, 189.
YANG Y, WANG H Z, WANG Y M, GUAN X Q, YIN X T, SU L. Effects of calcium spray on photosynthesis and chlorophyll fluorescence of grape under drought stress. Journal of Anhui Agricultural Sciences, 2017, 45(27): 62-64, 189. (in chinese)
[35] FORAND A D, FINFROCK Y Z, LAVIER M, STOBBS J, QIN L, WANG S, KARUNAKARAN C, WEI Y, GHOSH S, TANINO K K. With a little help from my cell wall: Structural modifications in pectin may play a role to overcome both dehydration stress and fungal pathogens. Plants, 2022, 11(3): 385.
[36] LANGER S E, MARINA M, BURGOS J L, MARTíNEZ G A, CIVELLO P M, VILLARREAL N M. Calcium chloride treatment modifies cell wall metabolism and activates defense responses in strawberry fruit (×, Duch). Journal of the Science of Food and Agriculture, 2019, 99(8): 4003-4010.
[37] ZHUANG Y, WEI M, LING C, LIU Y, AMIN A K, LI P, LI P, HU X, BAO H, HUO H, SMALLE J, WANG S. EGY3 mediates chloroplastic ROS homeostasis and promotes retrograde signaling in response to salt stress in. Cell Reports, 2021, 36(2): 109384.
[38] MüLLER J, TOEV T, HEISTERS M, TELLER J, MOORE K L, HAUSE G, DINESH D C, BüRSTENBINDER K, ABEL S. Iron-dependent callose deposition adjusts root meristem maintenance to phosphate availability. Developmental cell, 2015, 33(2): 216-230.
[39] RASMUSSEN M W, ROUX M, PETERSEN M, MUNDY J. MAP kinase cascades ininnate immunity. Frontiers in Plant Sciences, 2012, 3: 169.
[40] ABBRUSCATO P, NEPUSZ T, MIZZI L, DEL CORVO M, MORANDINI P, FUMASONI I, MICHEL C, PACCANARO A, GUIDERDONI E, SCHAFFRATH U, MOREL J B, PIFFANELLI P, FAIVRE-RAMPANT O., a monocot WRKY gene, plays a role in the resistance response to blast. Molecular Plant Pathology, 2012, 13(8): 828-841.
[41] HSU F C, CHOU M Y, CHOU S J, LI Y R, PENG H P, SHIH M C. Submergence confers immunity mediated by the WRKY22 transcription factor in. The Plant Cell, 2013, 25(7): 2699-2713.
[42] HUSSAIN A, LI X, WENG Y H, LIU Z Q, ASHRAF M F, NOMAN A, YANG S, IFNAN M, QIU S S, YANG Y J, GUAN D Y, HE S L. CaWRKY22 acts as a positive regulator in pepper response toby constituting networks with CaWRKY6, CaWRKY27, CaWRKY40, and CaWRKY58. International Journal of Molecular Science, 2018, 19(5): 1426.
[43] ELLINGER D, VOIGT C A. Callose biosynthesis inwith a focus on pathogen response: what we have learned within the last decade. Annals of Botany, 2014, 114(6): 1349-1358.
Effects of Calcium on Growth and Development ofand resistance to Citrus Canker
Xiao GuiHua1,2,3, WEN Kang1,2,3, HAN Jian4, HAO ChenXing1,2,3, YE RongChun1,2,3, ZHU YiChi1,2,3, XIAO ShunYuan1, DENG ZiNiu1,2,3, MA XianFeng1,2,3
1College of Horticulture, Hunan Agricultural University, Changsha 410128;2Engineering Research Center for Horticultural Crop Germplasm Creation and New Variety Breeding, Ministry of Education, Changsha 410128;3National Center for Citrus Improvement (Changsha), Changsha 410128;4Hunan Institute of Horticulture, Changsha 410125
【Background】Citrus canker is a bacterial disease caused bysubsp.(), which can infect branches, leaves and fruits, and affects almost all major citrus varieties. The results of a previous survey of 39 citrus orchards in Hunan Province showed that soil acidification and exchange calcium deficiency in citrus orchards were serious and calcium deficiency existed in all leaves. Calcium is one of the elements required by plants in large quantities, and calcium deficiency causes nutritional imbalance, reduced growth potential and compromised plant immunity level. However, the effect of calcium element on the process of citrus infection with canker is not clear.【Objective】The objective of this study is to analyze the pathogenic differences after inoculation within(sensitive to citrus canker) leaves under different calcium concentrations, and to explore the role of calcium ininfection ofleaves.【Method】The seedlings ofwere sand cultured with calcium concentrations of 0, 0.75, 3, and 30 mmol·L-1. During the growth period of, the biomass, chlorophyll a and b concentrations, and calcium content in roots and leaves were determined, as well as the formation of reactive oxygen species (ROS) in roots and callose deposition. The effects ofinoculation on cell wall synthesis-related genes and immune-related genes inleaves were investigated.【Result】Compared with 3 mmol·L-1calcium treatment, 0, 0.75 and 30 mmol·L-1calcium treatments inhibited the growth and development of aboveground and underground parts of, and chlorophyll a and b concentrations decreased. The calcium content in roots and leaves was proportional to the amount of exogenous calcium. ROS and callose deposition were generated in roots after treatment with different calcium concentrations, reaching the maximum at 3 mmol·L-1. after inoculation with, the leaf symptoms gradually decreased with the increase of calcium concentration, but the growth ofhad no significant difference. Compared with 3 mmol·L-1treatment,, a gene involved in cell wall synthesis, was up-regulated and then down-regulated byunder 0 mmol·L-1treatment, and up-regulated byunder 30 mmol·L-1treatment.andwere down-regulated byunder 0 mmol·L-1treatment, and up-regulated byunder 30 mmol·L-1treatment. The expression levels of immune pathway related genes,andinduced byat 30 mmol·L-1were higher than those at 0 and 3 mmol·L-1after inoculation withat 0, 2, 4 and 6 dpi.【Conclusion】The growth and development ofis affected by calcium deficiency and excess, resulting in leaf chlorosis, and ROS production and callose deposition in roots decreased. The sensitive symptoms on the leaf surface caused bywere greatly attenuated after calcium application, but the bacterial content was not significantly different from that of the control. Calcium may promote cell wall thickening by regulating genes related to cell wall synthesis, thereby inhibitingfrom breaking through leaf epidermis and forming typical symptoms.
citrus canker;subsp.(); calcium;; immunity

10.3864/j.issn.0578-1752.2022.19.007
2022-04-11;
2022-05-17
国家重点研发计划(2018YFD1000300)、湖湘高层次人才聚集工程(2019RS1052)
肖桂华,E-mail:17843096258@163.com。通信作者马先锋,E-mail:ma8006@hunau.edu.cn
(责任编辑 岳梅)

