血清HIF-1α、CK-BB水平与新生儿缺氧缺血性脑病严重程度的相关性
肖 飞, 张 鹏, 王润智, 张耀东
(1.平煤神马医疗集团总医院儿科,河南 平顶山 467000;2.河南省儿童医院新生儿科,河南 郑州 451161)
新生儿缺氧缺血性脑病(hypoxic ischemic encephalopathy,HIE)多由围产期窒息引起,具有较高的致残率和致死率[1]。目前,临床对HIE尚无别有特效的预防或治疗方法,及时、明确地诊断HIE,正确评估患儿脑损伤严重程度,对于降低永久性神经功能障碍发生率及病死率具有重要意义[2]。HIE的发生机制复杂,涉及血流动力学和脑细胞能量代谢障碍,细胞因子在缺血、缺氧的过程中具有重要作用。低氧诱导因子-1α(hypoxia inducible factor-1 alpha,HIF-1α)是细胞重要的氧代谢调节因子,参与细胞能量代谢、血管与红细胞生成等,调节低氧环境对细胞造成的损伤[3]。肌酸激酶BB同工酶(creatine kinase isoenzyme-BB,CK-BB)是参与细胞能量运转的重要激酶,也是神经元损伤的敏感性标志物[4]。有研究结果显示,神经系统疾病患者CK-BB的升高程度与脑损伤的预后密切相关[5]。为此,本研究拟分析血清HIF-1α、CK-BB水平与HIE患儿脑损伤严重程度的关系,为HIE的诊断和预后评估提供参考。
1 材料和方法
1.1 研究对象
选取2017年10月—2019年10月在平煤神马医疗集团总医院治疗的HIE患儿230例(HIE组),其中男118例、女112例,年龄(8.52±2.30)d,胎龄为(39.50±1.23)周,出生体质量为(3 857.30±352.36)g,经阴道分娩180例、剖宫产50例。根据病情严重程度[6]分为轻度(102例)、中度(71例)、重度(57例)。另选取同期平煤神马医疗集团总医院出生的健康新生儿200名作为正常对照组,其中男102名、女98名,年龄(8.62±2.01)d, 胎龄为(3 9.2 0±1.3 1)周,出生体质量为 (3 880.41±345.50)g,经阴道分娩152例、剖宫产48例。2个组之间性别、胎龄、出生体质量及分娩方式差异均无统计学意义(P>0.05)。本研究经平煤神马医疗集团总医院伦理委员会批准,新生儿父母均知情同意。
1.2 病例入选、排除标准
入选标准:(1)HIE诊断符合《新生儿缺氧缺血性脑病诊断标准》[7],出生后1 min Apgar评分≤3分、5 min Apgar评分≤5分,脑电图异常且有神经系统症状和体征;(2)初次就诊。排除标准:(1)先天畸形;(2)代谢异常;(3)合并其他颅内疾病、血液疾病、感染性 疾病。
1.3 方法
采集所有新生儿出生24 h内的股静脉血3 mL,静置1 h后,以1 007×g离心10 min,取上清液,置于-20 ℃冰箱内保存待检。采用双抗体夹心酶联免疫吸附试验(enzyme-linked immunosorbent assay,ELISA)检测HIF-1α、CK-BB水平,试剂盒购于上海科华公司,检测仪器为Multiskan FC酶标仪[赛默飞世尔科技(中国)有限公司]。严格按仪器和试剂盒说明书要求操作。
样本采集完毕后,采用20项新生儿行为神经测定评分法(neonatal behavioral neurological assessment,NBNA)[8]评估HIE患儿脑损伤的严重程度,总分为0~40分,以NBNA评分≥37分判定为神经功能正常,分数越高表示神经功能 越好。
1.4 统计学方法
采用SPSS 25.0软件进行统计分析。呈正态分布的计量资料以±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。采用Pearson相关分析评估各项指标的相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 HIE组与正常对照组血清HIF-1α、CK-BB水平、NBNA评分比较
HIE组血清HIF-1α、CK-BB水平均高于正常对照组(P<0.001),NBNA评分低于正常对照组(P<0.001)。见表1。
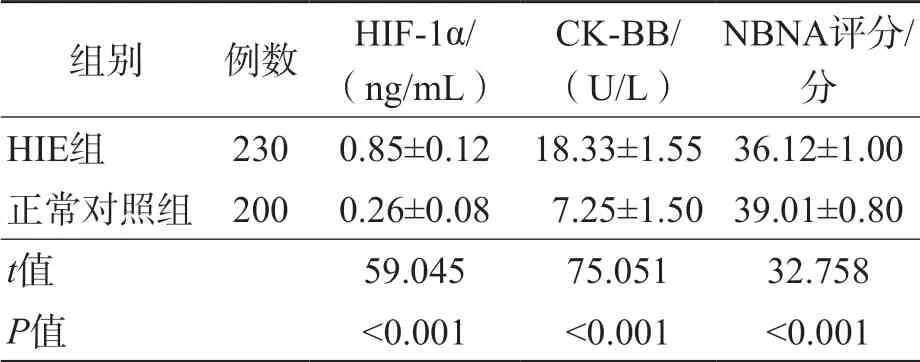
表1 HIE组与正常对照组血清HIF-1α、CK-BB水平和NBNA评分比较
2.2 血清HIF-1α、CK-BB水平与NBNA评分的相关性分析
血清HIF-1α、CK-BB水平与NBNA评分均呈负相关(r值分别为-0.701、-0.683,P<0.05)。见图1。
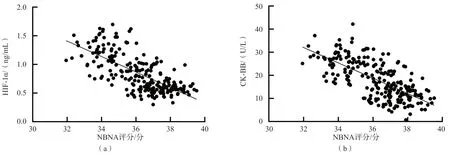
图1 血清HIF-1α、CK-BB水平与NBNA评分的相关性
2.3 不同病情严重程度HIE患儿血清HIF-1α、CK-BB水平、NBNA评分比较
随着病情严重程度的增加,HIE患儿血清HIF-1α、CK-BB水平依次升高(P<0.001),NBNA评分依次降低(P<0.001)。见表2。
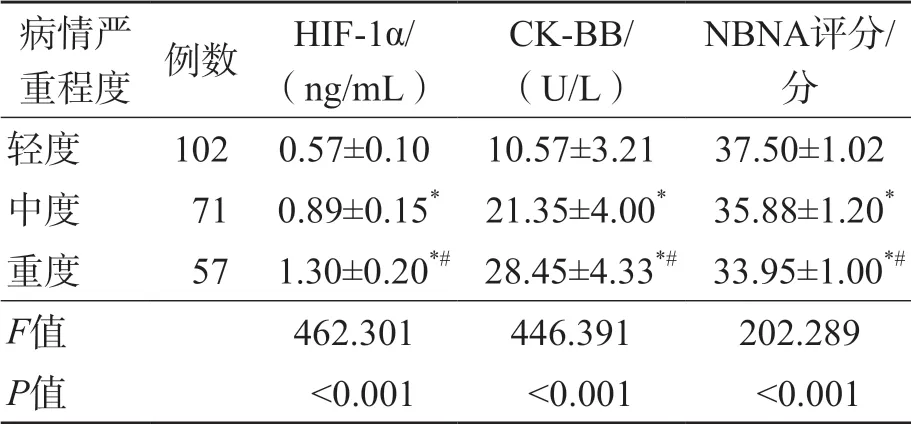
表2 不同病情严重程度HIE患儿血清HIF-1α、CK-BB水平、NBNA评分比较
3 讨论
新生儿HIE的发生是由于围产期窒息导致缺氧、缺血,引起代谢性或混合性酸中毒,造成中枢神经系统损伤,并伴有呼吸循环系统等多脏器功能的损伤[8]。脑组织在缺氧、缺血时可发生无氧酵解,造成乳酸堆积,细胞能量供应减少,细胞膜功能受损,钙离子内流,大量自由基生成,细胞膜通透性增强,引发水肿,最终发展为不同程度的脑损伤,甚至死亡[9]。近年来,随着我国医学水平的进步,新生儿重症监护和围产医学有了长足的发展,新生儿HIE的病死率有所下降,但多数患儿仍遗留有不同程度的神经系统发育障碍,严重影响了患儿的生存质量[10]。血清特异性指标检测是临床疾病诊断、预后评估的重要方法,具有创伤小、可重复性强、操作方便成本低等优势,可为临床治疗方案的制定提供参考。有研究结果显示,HIF-1α、CK-BB均参与了细胞能量代谢,分别是缺氧和神经元损伤的敏感指标,并参与了脑缺血缺氧疾病的发生、发展[11-12]。了解HIF-1α、CK-BB与新生儿HIE病情严重程度的相关性,对于疾病诊断、指导治疗及预后判断有重要意义。
本研究结果显示,HIE组血清HIF-1α、CK-BB水平均高于正常对照组(P<0.001),NBNA评分低于正常对照组(P<0.001)。HIF-1α是具有转录活性的核蛋白,有广泛的靶基因谱,包括缺氧适应、炎症反应、肿瘤生长等相关的100多种靶基因,其C末端含有1个氧依赖性降解结构阈和2个转录激活结构域,受缺氧信号调控[13]。当细胞处于缺氧环境时,HIF-1α可形成有活性的复合物,进入细胞核内,与靶基因的缺氧反应元件结合,启动靶基因转录。有研究证实,当机体发生缺氧缺血性脑损伤时,HIF-1α水平可升高,并通过缺氧反应元件上调靶基因转录活性,增强凋亡相关基因活性,提高脑组织对缺氧的适应性[14]。邬刚等[15]证实颅脑损伤患者血清HIF-1α水平异常升高,且其水平变化与患者病情及预后有关。CK-BB是细胞能量代谢的重要催化剂,主要存在于脑胶质细胞和神经元胞质中,当脑细胞受外界刺激而受损时,CK-BB在细胞中被降解释放,进入脑脊液,脑脊液中的CK-BB可通过受损的血脑屏障,进入血液循环,导致血清CK-BB水平升 高[16]。张玉娇等[17]的研究结果显示,血清CK-BB水平与新生儿HIE的严重程度显著相关,与本研究结果一致。由此可见,血清HIF-1α、CK-BB水平可反映HIE患儿病情的严重程度。
NBNA评分可全面反映新生儿脑功能状态,对各种有害因素造成的轻微脑损伤也有较高的敏感性[18]。本研究结果显示,随着病情严重程度的增加,HIE患儿血清HIF-1α、CK-BB水平依次升高(P<0.001),NBNA评分依次降低(P<0.001);且血清HIF-1α、CK-BB水平与NBNA评分均呈负相关(r值分别为-0.701、 -0.683,P<0.05)。提示血清HIF-1α、CK-BB水平可反映HIE患儿脑损伤程度。
综上所述,HIE患儿血清HIF-1α、CK-BB水平异常升高,反映了病情的严重程度,可作为HIE诊断、病情监测及评估脑损伤严重程度的 指标。

