基于微滴数字PCR技术的婴幼儿配方乳粉中双歧杆菌定量检测及应用
李恩静,王 丹,薛晨玉,杨红莲,耿健强,穆同娜,吴燕涛,吕 莹
(1.北京市食品安全监控和风险评估中心,北京 100094;2.北京农学院食品科学与工程学院,北京 102206)
婴幼儿配方乳粉是以乳类及乳蛋白制品为主要蛋白来源,加入适量的维生素、矿物质和(或)其他辅料,仅用物理方法生产加工制成的产品,其能量和营养成分能够部分满足初生至3 周岁婴幼儿的成长需要,根据不同月龄婴幼儿营养的需求,主要分为婴儿配方乳粉和较大婴儿及幼儿配方乳粉。随着益生菌与婴幼儿健康关系研究的不断深入,婴幼儿配方乳粉中添加活性益生菌成为一种趋势。段文锋等调研发现,市场常见的添加益生菌的婴幼儿配方乳粉中,50%以上的产品使用了双歧杆菌,添加最多的是动物双歧杆菌Bb-12,其次还有动物双歧杆菌乳亚种HN019、Bi-07和嗜酸乳杆菌NCFM。双歧杆菌作为一种重要的益生菌,是一种专性厌氧的革兰氏阳性菌,至今已有大量研究表明双歧杆菌能够调节婴幼儿肠道的菌群平衡,改善婴幼儿的免疫系统,有效促进婴幼儿正常生长发育。由于婴幼儿是特殊的敏感群体,为了规范菌株使用,2011年原卫生部发布了《可用于婴幼儿食品的菌种名单》,明确列出婴幼儿食品中可使用的菌种名称及菌株号,截至目前,经国家卫健委批准可应用于婴幼儿食品的益生菌共13 株11 个菌种,主要以双歧杆菌和乳杆菌为主。
婴幼儿配方乳粉中添加益生菌种类的规定保证了其安全性,而益生菌产品的活菌数是保证其功能特性的关键因素,婴幼儿配方乳粉系列食品安全国家标准均对保质期内产品中益生菌的活菌数目进行了规定,规定产品中活菌数应不小于10CFU/g(mL)。针对双歧杆菌定量检测的现行有效国家标准采用的是平板计数法,该方法在实际应用中存在耗时长(一般为72 h)、工作量大和操作较繁琐等缺陷。近年来,以实时聚合酶链式反应(real-time polymerase chain reaction,real-time PCR)为代表的分子生物学技术也逐渐被广泛应用到益生菌的定量检测工作中。相比较于传统培养法,real-time PCR快速、灵敏、特异,但该方法属于相对定量,结果的准确性和重复性在很大程度上依赖于所绘制的标准曲线质量及扩增效率,并且需要具备已知浓度的核酸标准品。新兴的微滴式数字PCR(droplet digital PCR,ddPCR)被认为是第3代核酸扩增技术,通过把稀释到一定浓度的DNA分子分布到10 000~20 000 个微滴中,使大部分微滴中DNA分子的数量为1或0,然后通过PCR扩增和阳性信号的累积读取阳性反应单元数,采集阳性信号与阴性信号的比例,再根据泊松分布计算出样本中的DNA分子数,从而实现对DNA分子的绝对定量。目前该技术在食品领域的应用日益增多,主要应用于食源性致病菌检测、转基因植物检测、动物源性成分检测等方面。国内鲜见ddPCR技术应用于婴幼儿配方食品中双歧杆菌检测的文献报道,针对现有检测方法的不足,本研究拟采用ddPCR检测技术建立针对婴幼儿配方食品中常见益生菌的快速准确定量方法,旨在为婴幼儿配方食品中益生菌的定量检测提供新的思路,为监管部门对益生菌婴幼儿配方乳粉实现有效监管提供有力的技术支撑。
1 材料与方法
1.1 材料与试剂
两歧双歧杆菌()CICC6071、婴儿双歧杆菌()CICC6069、青春双歧杆菌()CICC6070、发酵乳杆菌()CICC21800、德氏乳杆菌保加利亚种(subsp.)CICC6047、副干酪乳杆菌()CICC20262、唾液乳杆菌()CICC23174、约氏乳杆菌()CICC6084、嗜酸乳杆菌()CICC6081、德氏乳杆菌乳亚种(subsp.)CICC20708、瑞士乳杆菌()CICC6032、嗜热链球菌()CICC21728中国工业微生物菌种保藏管理中心;长双歧杆菌()CGMCC1.2186、短双歧杆菌()CGMCC1.2213 中国普通微生物菌种保藏管理中心;动物双歧杆菌乳亚种(subsp)Bb-12、动物双歧杆菌乳亚种(subsp)HN019、鼠李糖乳酪杆菌()GG为所在实验室分离菌株。所有冷冻干燥菌株按照各自的指示培养基进行活化,在适宜的温度条件下培养,转接传代3 次后备用。
MRS培养基 美国BD公司;磷酸缓冲盐溶液(phosphate buffered saline,PBS) 美国赛默飞公司;十六烷基三甲基溴化铵(cetyltrimethylammonium bromide,CTAB)、聚乙二醇辛基苯基醚(Triton X-100)美国Sigma公司;细菌基因组DNA提取试剂盒、蛋白酶K(20 mg/mL)、溶菌酶(50 mg/mL) 北京Tiangen公司;ddPCR反应体系有关试剂 美国伯乐公司;引物、探针由生工生物工程(上海)股份有限公司合成。
1.2 仪器与设备
Q×200 ddPCR仪 美国伯乐公司;PCR仪 美国ABI公司;高速离心机(转速≥12 000 r/min)、加热混匀仪 德国Eppendorf公司;BILON-08无菌匀质器上海比朗仪器有限公司;Incucell型恒温恒湿培养箱 德国MMM公司;1300 Series A2型生物安全柜 美国Thermo公司。
1.3 方法
1.3.1 核酸提取
1.3.1.1 标准菌株核酸提取
采用改良后的细菌基因组DNA提取试剂盒,将活化后第3代的菌株培养物原液1 mL放置离心机内12 000 r/min离心5 min;倒掉上清液,加入溶菌酶200 µL,37 ℃消化1.5 h;加入蛋白酶K 50 µL,细菌基因组DNA提取试剂盒中提供的缓冲液GA 150 µL,56 ℃消化1.5 h。后续用细菌基因组DNA提取试剂盒进行核酸提取。
1.3.1.2 婴幼儿配方乳粉样品核酸提取
参考文献[21-22],对婴幼儿配方乳粉中双歧杆菌基因组DNA的提取方法进行优化:将婴幼儿配方乳粉以质量比1∶10溶于0.85%生理盐水中,取1 mL乳液样品12 000 r/min离心10 min;去掉上清液及脂肪,加入1 mL PBS溶液12 000 r/min离心5 min;-20 ℃冰箱放置1.5 min,100 ℃加热混匀仪放置1.5 min,反复处置样品6 次;加入200 µL PBS溶液,100 µL蛋白酶K以及1 µL Triton X-100,56 ℃消化1.5 h;12 000 r/min离心5 min去掉上清液,加入200 µL溶菌酶37 ℃消化1.5 h;加入蛋白酶K 50 µL,细菌基因组DNA提取试剂盒中提供的缓冲液GA 150 µL,56 ℃消化1.5 h。后续用细菌基因组DNA提取试剂盒进行核酸提取。
1.3.2 ddPCR体系及检测
配制ddPCR体系,体系为2×探针法ddPCR预混液10 µL,将引物稀释到10 µmol/L,取2.25 µL上下游引物和1.0 µL探针加入体系,加入2 µL的模板,最后用灭菌双蒸水补足20 µL。
将充分混匀的ddPCR体系转移到微滴发生卡中,并向微滴发生卡中加入70 µL微滴发生专用油,将微滴发生卡放到微滴发生器中进行反应。随后将生成的40 µL微滴液转移到ddPCR的96 孔板中,用封膜仪对96 孔板封膜,准备进行ddPCR。
ddPCR程序:95 ℃预变性10 min;94 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,进行43 个循环;98 ℃固化微滴10 min。
ddPCR结束后将96 孔板放入QX200 Droplet Reader仪器中,依次录入样品信息,根据Quantasoft软件计算出最终结果(copies/20 µL)。
1.3.3 引物探针设计及特异性实验
查阅文献[23]筛选出的双歧杆菌单拷贝特异基因,在基因上设计引物探针序列,利用Primer Premier 6.0设计引物探针,并通过Oligo 7.37进行验证,再进行BLAST在线比对后,设计出一对引物探针,如表1所示,探针5′端标记FAM,3′端标记BHQ。对7 株双歧杆菌及10 株近源乳酸菌按照1.3.1.1节方法进行DNA提取,并对引物探针应用ddPCR检测方法对双歧杆菌同源及近源菌种进行检测,验证引物探针的特异性。

表1 ddPCR引物和探针序列Table 1 Primers and probe sequences used in ddPCR
1.3.4 ddPCR条件优化
1.3.4.1 引物及探针浓度优化实验
设置3 组待优化的上下游引物及探针浓度,如表2所示,以动物双歧杆菌乳亚种HN019的DNA为模板,使用上述筛选得出的一对引物探针对3 组浓度分别参照1.3.2节进行ddPCR检测,根据微滴检测仪生成的结果,筛选出最优的引物探针ddPCR浓度。

表2 3 组引物探针浓度Table 2 Three groups of primer and probe concentration nmol/L
1.3.4.2 ddPCR退火温度优化实验
在设计ddPCR扩增的反应程序时,以动物双歧杆菌乳亚种HN019的DNA为模板,使用上述筛选得出的一对引物探针和相应浓度,以1.3.2节的ddPCR体系为基础,对ddPCR退火温度进行优化。设置退火温度为53、53.5、54、55、56、58 ℃梯度ddPCR,根据微滴检测仪生成的结果筛选出最佳退火反应温度。
1.3.5 双歧杆菌纯培养液的平板计数及ddPCR检测
1.3.5.1 平板计数
对动物双歧杆菌乳亚种HN019培养物原液选取合适稀释度进行平板计数,依据GB 4789.34—2016《食品微生物学检验 双歧杆菌检验》方法,每个稀释度做2 个平皿,置于37 ℃厌氧培养48~72 h,观察菌落生长情况。选取菌落数在30~300 CFU之间、无蔓延菌落生长的平板计数菌落总数,每个稀释度菌落数应取2 个平板计数结果的平均值。
1.3.5.2 双歧杆菌培养液ddPCR检测
将37 ℃厌氧培养48 h的动物双歧杆菌乳亚种HN019培养物原液至10稀释菌液,应用1.3.2.1节方法提取DNA,应用已建立的ddPCR检测方法进行检测,每个浓度梯度检测重复3 次,借助SPSS 14.0进行统计学分析,计算变异系数(coefficient of variation,CV)。灵敏度根据拷贝数定量出的菌液浓度,同时与平板计数方法测定结果比较,确定定量范围,并得到检测限。
ddPCR 可直接测得每反应的目标基因拷贝数(copies/20 µL),ddPCR的拷贝数与对应菌悬液浓度的换算关系公式如下:
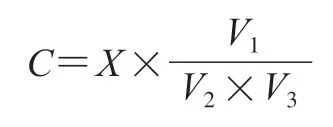
式中:为根据ddPCR 拷贝数换算得到菌悬液的浓度/(CFU/mL);为ddPCR中20 µL体系的拷贝数/(copies/20 µL);为DNA提取最终的定容体积/µL;为DNA提取的菌悬液体积/mL;为ddPCR反应体系中DNA模板体积/µL。
1.3.6 模拟双歧杆菌婴幼儿配方乳粉样品的平板计数及ddPCR检测
称取未添加双歧杆菌的婴幼儿配方乳粉5 g,置于装有44 mL生理盐水的均质袋内,将37 ℃厌氧培养48 h的双歧杆菌HN019菌悬液10~10稀释度菌液各1 mL,至于均质袋中,用拍击式匀浆器拍击2 min,制成质量比为1∶10的样品匀液,各添加水平分别设3 个样品重复,另取1 份无菌称样5 g婴儿乳粉样品加入45 mL生理盐水,代替添加菌液作为阴性对照品,将以上5 个浓度添加水平的婴儿配方乳粉样品溶液,分别梯度稀释进行平板计数方法检测。同时取各样品溶液各1 mL用1.3.1.2节方法提取DNA,最终将核酸溶解在100 µL TE缓冲液中,并进行ddPCR检测。ddPCR对样品的检测结果对应的菌液浓度可由1.3.5.2节公式换算得到,将其定量结果与平板计数定量结果进行比较。
1.3.7 实际婴幼儿配方乳粉样品的平板计数及ddPCR检测
对市售10 份不同厂家的添加双歧杆菌的婴幼儿配方乳粉样品,应用1.3.1.2节方法提取基因组DNA并进行ddPCR定量检测,每个样品取2 个平行样品,每个平行样品做3 次重复,同时对样品应用平板计数方法定量检测,比较2 种方法的定量结果的一致性。
2 结果与分析
2.1 引物探针特异性验证
以7 株双歧杆菌及10 株近源乳酸菌培养物原液提取的DNA为模板,应用表1中的双歧杆菌引物探针进行ddPCR扩增,结果如图1所示,7 株双歧杆菌均出现蓝色的阳性油滴信号,其他10 株乳酸菌均未扩增呈阴性,为灰色油滴信号,表明选取的双歧杆菌引物探针特异性较好,能够满足双歧杆菌的检测。
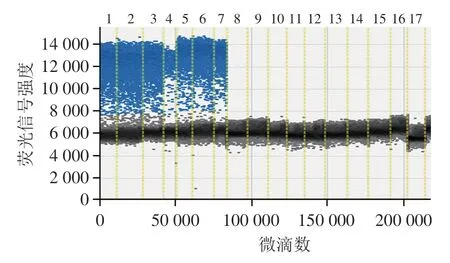
图1 引物探针特异性验证Fig.1 Specificity evaluation of primers and probes
2.2 引物探针浓度优化结果
以动物双歧杆菌乳亚种HN019的DNA为模板,对3 组引物探针浓度进行ddPCR扩增,结果如图2所示,3 组浓度的ddPCR扩增荧光信号强度无明显差异,阴阳性微滴之间的荧光振幅差异不明显,故选择最适合实际应用的引物探针浓度为第3组:500、500、250 nmol/L。

图2 引物探针浓度优化Fig.2 Optimization of primer and probe concentration
2.3 退火温度优化结果
选择ddPCR扩增体系的退火温度53、53.5、54、55、56、58 ℃进行优化实验,结果如图3所示,退火温度在53~58 ℃范围内均有荧光信号被检出,阴阳性微滴有明显分界,且阴阳性油滴之间的扩增振幅逐渐增大,在58 ℃达到最大扩增振幅,且在此温度条件下阴阳性油滴间的弥散油滴数量适中,表明ddPCR非特异扩增较少,故选择58 ℃作为反应最佳退火温度。
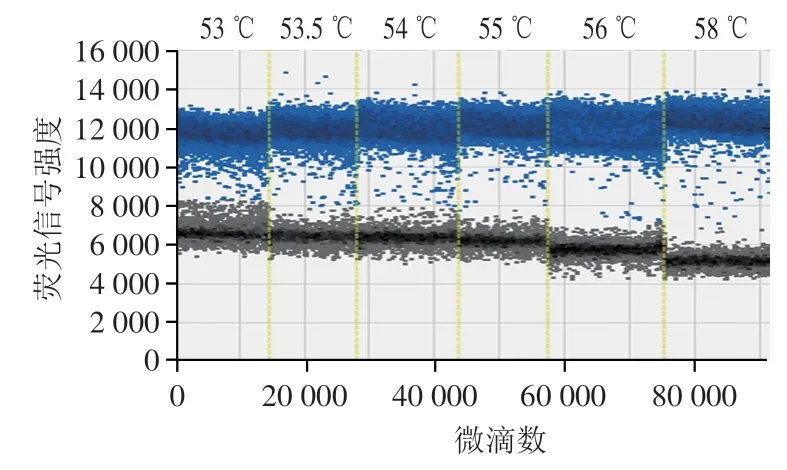
图3 退火温度优化Fig.3 Optimization of annealing temperature
2.4 双歧杆菌纯培养液的ddPCR检测及平板计数
对双歧杆菌纯培养液进行梯度稀释并应用平板计数方法,得到原始菌液浓度为1.1×10CFU/mL,其对数值为8.05。ddPCR对原始菌液梯度稀释至10检测,ddPCR在10稀释度模板浓度过高,达到检测上限,无阴性油滴,仪器无法推算模板浓度,需要适当稀释才能确定,在10稀释度由于模板浓度过低,达到检测下限,无阳性油滴,仪器无法推算模板浓度。如图4所示,10~10稀释度菌液ddPCR均能检测到阳性及阴性油滴。如表3所示,ddPCR检测得到原菌悬液定量对数值在8.13~8.47(lg(CFU/mL))之间,CV值在4.31%~12.76%之间,均小于20%,重复性较好,且与平板计数测定值相差在0.5(lg(CFU/mL))值之间,偏差小于10%(表3),与平板计数定量结果一致性较好。在10稀释度菌液达到ddPCR方法的检出限,菌液定量结果为296 CFU/mL。

图4 梯度稀释纯菌液ddPCR扩增Fig.4 ddPCR amplification results of gradient dilutions of pure bacterial culture

表3 纯菌液ddPCR定量Table 3 Quantitative results of pure bacterial culture by ddPCR
2.5 模拟双歧杆菌婴幼儿配方乳粉样品的平板计数及ddPCR检测
10~10稀释度菌悬液添加水平的婴幼儿配方乳粉样品的平板计数结果分别为3.5×10、3.6×10、4.3×10、3.3×10、3.8×10CFU/g。同时ddPCR方法对于加入婴幼儿配方乳粉食品基质的双歧杆菌定量结果由表4所示,分别为2.76×10、3.38×10、6.57×10、4.56×10、7.30×10CFU/g,在10~10CFU/g样品浓度范围中测定结果CV值在3.92%~15.80%之间,重复性较好,与平板计数定量对数值偏差范围在1.37%~7.80%之间,偏差小于10%,与平板计数定量结果一致性较好,模拟样品的检出限为7.30×10CFU/g。

表4 模拟双歧杆菌样品ddPCR及平板计数定量Table 4 Quantitative results of simulated samples by ddPCR and plate counting method
2.6 实际婴幼儿配方乳粉样品的平板计数及ddPCR检测
对市售不同厂家仅含有双歧杆菌的婴幼儿配方乳粉进行双歧杆菌平板计数定量检测,检测结果显示,活菌数均不小于10CFU/g,符合产品标准要求,与标签标识相符。同时应用已建立的ddPCR方法进行检测,结果如表5所示,样品定量检测结果均大于10CFU/g,且ddPCR定量值与平板计数定量值相差在0.5(lg(CFU/g))值之间,偏差小于10%,结果一致性较好。由此可知本研究所建立的对婴幼儿配方乳粉中双歧杆菌的ddPCR定量检测方法可应用于实际样品的双歧杆菌的定量检测。

表5 市售样品ddPCR及平板计数检测Table 5 Quantitative results of commercial samples by ddPCR and plate counting method
3 讨论
近年来,ddPCR检测技术因其灵敏度高、快速等优点在食品检测中应用日益增多。魏永新等利用ddPCR技术对食品中O157∶H7进行检测,细菌纯培养液中最低定量为10CFU/mL,人工污染三文鱼样品中检出限为110 CFU/g;刘洋等基于ddPCR技术建立饮料中嗜酸乳杆菌的定量检测方法,方法灵敏度达到0.25 pg/µL,重复性的相对标准偏差在2.34%~6.10%之间;Hansen等报道了PMA结合基因芯片dPCR技术同时检测混菌样品中NCFM和subsp.Bl-04的活菌数量,相对标准偏差分别为5%和4%,显著优于平板计数法(15%),可见该方法精确度高,稳定性强。
本研究利用双歧杆菌特异性引物建立ddPCR定量检测方法,并对模拟和市售添加双歧杆菌的婴幼儿配方乳粉进行测定。首先查阅文献确定双歧杆菌特异性单拷贝基因,并设计特异性引物探针,避免了多拷贝基因由于定量拷贝数的变化而使得ddPCR检测结果准确度降低的问题。其次获得高质量及准确浓度的模板DNA是ddPCR准确定量的决定因素,由于双歧杆菌是革兰氏阳性菌、细胞壁不易破碎,且婴幼儿配方乳粉含有大量蛋白质分子且成分复杂,对提取高质量的模板DNA增加难度,因此分别对双歧杆菌DNA和婴幼儿配方乳粉中的双歧杆菌提取方法进行优化;最后由于ddPCR检测原理是将阳性微滴数和阴性微滴数用泊松分布公式计算出DNA分子的拷贝数,因此阴阳性油滴之间的荧光振幅能够在一定程度上反映出ddPCR方法的准确性和扩增效率,而ddPCR条件的退火温度及ddPCR中引物探针的浓度,都会对荧光振幅产生影响,由此对这2 个参数进行优化,建立婴幼儿配方乳粉中ddPCR定量检测双歧杆菌的快速检测方法。
本研究将ddPCR检测方法应用于婴幼儿配方乳粉中的双歧杆菌检测,所建立的ddPCR检测方法对双歧杆菌菌纯培养液的检出限为296 CFU/mL,模拟样品检出限为7300 CFU/g,CV值均小于20%,重复性较好。对市售添加双歧杆菌的婴幼儿配方乳粉样品进行检测,表明ddPCR检测方法和平板计数检测方法检测定量偏差小于10%,结果一致性较好。现行有效的食品中双歧杆菌定量检测方法为平板计数法,一般检验周期为3 d左右,本研究所建立的方法可将检验周期减少至1 d左右,且具有特异性好、准确度高等优点,适用于婴幼儿配方乳粉中双歧杆菌的定量检测工作。由于婴幼儿配方食品基质复杂,且不同生产厂家的婴幼儿配方食品中添加的原辅材料多有差异,可能影响双歧杆菌DNA模板提取效果,进而对ddPCR检测准确度有一定影响,未来还需要对不同婴幼儿配方食品基质中的双歧杆菌提取方法进行研究,研究出更简便、高效的提取方法,以适应于婴幼儿配方食品的益生菌定量检测的快速检测要求。

