香豆素类荧光衍生试剂的合成及其柱前衍生氟虫腈HPLC-FLD检测方法的建立
刘 媛,刘 佳,唐道邦,涂勇刚,臧建威,吴雨青,陈继光,张清峰,尹忠平,
(1.江西农业大学食品科学与工程学院,江西省天然产物与功能食品重点实验室,江西省农产品加工与安全控制工程实验室,江西 南昌 330045;2.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东 广州 510610)
氟虫腈是一种高效、广谱的苯基吡唑类杀虫剂,该物质能与昆虫体内重要的抑制性神经递质——-氨基丁酸受体结合,使中枢神经系统氯离子通道关闭,引起肌肉和神经异于常态、极度兴奋,最终导致昆虫麻痹、死亡。该杀虫剂使用方便(可直接施入土壤中,也可喷洒于叶面上),药效持久,且对农作物本身没有毒害作用,因此曾被广泛用于蔬菜、水果、棉花、果树等作物害虫防控以及畜牧生产、公共卫生和医疗等方面。但是氟虫腈在自然条件下难以降解,半衰期长,易造成环境污染问题,也容易在动物和人体中富集,导致健康和安全问题,此外对水生生物也有较高的毒性。因此,对农产品中氟虫腈的残留进行检测和控制十分必要。
目前,氟虫腈的检测方法主要有高效液相色谱(high performance liquid chromatography,HPLC)法、高效液相色谱-串联质谱(high performance liquid chromatography-tandem mass spectrometry,HPLCMS/MS)法、气相色谱法以及气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)联用法,这些方法各有优缺点。HPLC-MS/MS、GC-MS具有较高的灵敏度,应用范围较广,但检测成本相对较高,需要较为贵重的精密仪器,操作人员技能要求较高。HPLC检测成本低,操作较为简便,但灵敏度不高。因此,开发灵敏度高、选择性强、干扰小的氟虫腈残留检测方法具有重大意义。
高效液相色谱-荧光检测(high performance liquid chromatography-fluorescence detection,HPLC-FLD)灵敏、稳定、干扰小,因此被广泛应用于痕量和微量检测。HPLC-FLD检测的灵敏度主要取决于荧光衍生试剂的性质,高荧光强度就意味着高灵敏度。一个优良的荧光衍生试剂必需具备一个高强度的发色基团和一个高效率的衍生基团。在荧光衍生试剂的分子结构中,发色团是最为重要的部分,可以说该基团决定了HPLC-FLD的检测灵敏度,因此发色团的设计合成又是荧光衍生试剂设计合成的核心。此外,衍生化反应基团是荧光衍生试剂另一个重要的必需结构,是连接待测物与荧光体的“手臂”,这个基团决定了衍生化反应效率的高低。
香豆素类化合物具有良好的光物理和光化学性质,对环境有极强的敏感性,同时具有较大的Stokes位移,因此在荧光检测中具有很好的应用前景。该类物质分子结构中的取代基位置和类型对其荧光性质有较大的影响,不同位置的供电子基团和吸电子基团能在其结构上建立“推、拉”电子体系,可减弱或增强该体系,进而有效地控制荧光强度;同时,其结构中的供、吸电子基团容易被修饰,从而使其荧光波长在大且宽的范围之内得到更好的拓展。因此,香豆素类化合物作为荧光衍生试剂还具有很大的改造和提升空间。
研究表明,氟虫腈分子结构中吡唑环上3位腈基、4位三氟甲基亚砜基及5位游离的氨基均可被修饰和改造,可利用这一结构特点设计和合成氟虫腈柱前荧光衍生试剂,从而建立氟虫腈HPLC-FLD检测方法。相比较而言,吡唑环上的5位氨基更易被修饰,因此针对该基团进行特异性反应生成较强荧光强度的氟虫腈衍生物是可行的。
以4-(二乙氨基)水杨醛为母体,合成以羧酸基团为衍生化反应基团的香豆素类荧光衍生试剂——7-(二乙氨基)-2-氧-2-色酮-3-羧酸(记为L1),以L1与氟虫腈进行衍生化反应,生成柱前荧光衍生产物-(3-氰基-1-(2,6-二氯-4-(三氟甲基)苯基)-4-((三氟甲基)亚磺酰基)-1-吡唑-5-基)-7-(二乙氨基)-2-氧-2-色酮-3-甲酰胺(记为SF1),在此基础上建立高灵敏度的氟虫腈HPLC-FLD检测方法。本实验所合成的结构新颖的香豆素类荧光衍生试剂L1具有高荧光强度,因此在HPLC-FLD检测中具有较高的应用价值;基于羧基和氨基建立的柱前衍生化反应方法,还可用于其他具有氨基基团的待测目标物的检测,因此,本实验检测设计思路和研究方案对HPLCFLD方法研究具有一定的指导意义。
1 材料与方法
1.1 材料与试剂
4-(二乙氨基)水杨醛(纯度≥98%) 天津希恩思生化科技有限公司;丙二酸二乙酯(纯度≥99%) 上海毕得医药科技有限公司;乙醇、氢氧化钠、二氯甲烷(dichloromethane,DCM)、,-二甲基甲酰胺(,-dimethylformamide,DMF)、盐酸(均为分析纯) 西陇科学股份有限公司;氟虫腈(纯度≥98%)、1-(3-二甲基氨基丙基)-3-乙基碳二亚胺盐酸盐(1-(3-dimethylaminopropyl)-3-ethylcarbodiimide hydrochloride,EDC,纯度≥99%) 萨恩化学技术(上海)有限公司;哌啶(分析纯)、四氢呋喃(tetrahydrofuran,THF,化学纯) 国药集团化学试剂有限公司;4-二甲氨基吡啶(4-dimethylaminopyridine,DMAP,分析纯)、,-二环己基碳酰亚(dicyclohexyl carbodiimide,DCC,分析纯) 上海阿拉丁生化科技股份有限公司;六氟磷酸苯并三唑-1-基-氧基三吡咯烷基磷(benzotriazole-1-yl-oxytripyrrolidinophosphonium hexafluorophosphate,PyBOP,分析纯)、三乙胺(triethylamine,TEA,分析纯) 西宝生物科技(上海)股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO,纯度≥99%) 上海索来宝科技有限公司;乙腈(acetonitrile,ACN,色谱纯)美国Tieda试剂有限公司。
1.2 仪器与设备
400/500MHz核磁共振波谱仪 德国布鲁克科技有限公司;7890A-5975C GC-MS联用仪、1260-G1321B HPLC-FLD仪 安捷伦科技有限公司;SGW X-4B显微数字熔点测定仪 上海仪电科学仪器股份有限公司;DLSB-5/25低温冷却液循环泵 巩义市予华仪器有限责任公司;MR Hei-End恒温加热磁力搅拌器、Precision MLG3旋转蒸发仪 德国海道夫集团;PS-06A数控超声波清洗仪 深圳市恒达康科技有限公司;超纯水制备仪 美国Milli-Q科技有限公司。
1.3 方法
1.3.1 香豆素类荧光衍生试剂的合成路线与方法
1.3.1.1 香豆素类荧光衍生试剂的合成路线
在实验室前期合成工作基础上,以4-(二乙氨基)水杨醛为原料,在哌啶催化下与丙二酸二乙酯缩合成环,再经酯水解等反应,合成荧光衍生试剂L1,具体合成路线如图1所示。

图1 香豆素类荧光衍生试剂(L1)的合成路线Fig.1 Synthesis routes of fluorescent coumarin derivatization reagent (L1)
1.3.1.2 香豆素类荧光衍生试剂的合成方法
中间体化合物1-1的合成:分别将4-(二乙氨基)水杨醛(9.7 g,1.0 mmol)和丙二酸二乙酯(16.0 g,2.0 mmol)溶于150 mL无水乙醇溶液中,添加10 mL哌啶,将其混合溶液在80 ℃搅拌反应6 h,薄层色谱(thin layer chromatography,TLC)法监测反应进程。待反应结束,溶液冷却至室温,脱溶,硅胶拌样,柱层析纯化分离制得化合物1-1(洗脱剂:石油醚-乙酸乙酯(10∶1,/))。
香豆素类荧光衍生试剂L1的合成:将中间体化合物1-1(1.45 g,10 mmol)溶于20 mL无水乙醇,添加10 mL 10% NaOH溶液,95 ℃回流搅拌反应2 h,TLC监测反应进程。待反应结束,溶液冷却至室温,加盐酸调节溶液pH值至2,0 ℃下冷却结晶,生成大量沉淀;静置、抽滤,冰水冲洗;真空干燥,得到目标产物L1。经检测产物纯度高,无需纯化,可直接用于后续反应。
1.3.2 荧光光谱扫描
以ACN为溶剂,配制不同浓度的荧光衍生试剂L1及其与氟虫腈衍生化产物SF1的储备液,采用荧光分光光度计扫描检测其荧光光谱性质。荧光分光光度计的狭缝设置为10 nm/10 nm,扫描所用石英皿为1 cm×1 cm,以最大吸收波长进行扫描获取发射波长;同时,根据所测定的发射波长与激发波长计算Stokes位移(发射波长与激发波长之间的差值)。
1.3.3 氟虫腈柱前衍生化反应
1.3.3.1 衍生化反应试剂的配制
氟虫腈标准溶液的配制:准确称取0.043 7 g氟虫腈,用ACN溶解并定容至10 mL,配制成1.0×10mol/L的氟虫腈标准溶液,置于4 ℃冰箱中贮存,备用。
DCC溶液的配制:准确称取0.103 2 g DCC,用ACN溶解并定容至5 mL,配制成0.1 mol/L的DCC溶液,置于4 ℃冰箱中贮存,备用。
EDC溶液的配制:准确称取0.095 8 g EDC,用ACN溶解并定容至5 mL,配制成0.1 mol/L的EDC溶液,置于4 ℃冰箱中贮存,备用。
PyBOP溶液的配制:准确称取0.260 2 g PyBOP,用ACN溶解并定容至5 mL,配制成0.1 mol/L的PyBOP溶液,置于4 ℃冰箱中贮存,备用。
DMAP溶液的配制:准确称取0.122 2 g DMAP,用ACN溶解并定容至5 mL,配制成0.2 mol/L的DMAP溶液,置于4 ℃冰箱中贮存,备用。
荧光衍生试剂L1溶液的配制:准确称取0.032 6 g所合成的L1,用ACN溶解并定容至25 mL(利用超声完全促溶),配制成5.0×10mol/L的L1溶液,置于4 ℃冰箱中贮存,备用。
1.3.3.2 衍生化产物SF1的制备
L1与氟虫腈的衍生化反应如图2所示。具体的衍生化产物SF1的制备方法如下:将荧光衍生试剂L1(0.47 g,1 mmoL)和40 mL二氯甲烷加入100 mL茄形瓶中,35 ℃搅拌下依次加入DMAP(0.19 g,0.85 mmoL)、EDC(0.19 g,0.5 mmoL)和氟虫腈(0.32 g,0.4 mmoL),继续反应,TLC监测反应进程。待反应结束后,加入40 mL饱和NaOH溶液和20 mL水(超纯水,以下同),以二氯甲烷萃取(3×50 mL),合并有机相,无水硫酸钠干燥,脱溶,以硅胶柱层析进行分离纯化(洗脱剂为正己烷-乙酸乙酯,3∶1,/),得到黄绿色的衍生化产物SF1。
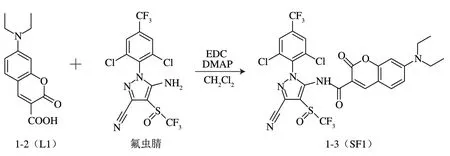
图2 L1与氟虫腈的衍生化反应Fig.2 Derivatiation reaction of L1 and fipronil
1.3.3.3 氟虫腈柱前衍生化反应体系和方法
取2 mL安瓿瓶,依次加入300 µL DCM、90 µL EDC(0.1 mol/L)、90 µL DMAP(0.2 mol/L)、30 µL氟虫腈溶液(1.0×10mol/L)和660 µL荧光衍生试剂L1(5.0×10mol/L),密封;充分混匀后置于45 ℃水浴中振荡反应60 min,取出冷却至室温,ACN定容至10 mL,取10 µL进行HPLC-FLD检测。
1.3.4 化合物结构鉴定
合成的中间体化合物1-1、荧光衍生试剂L1及氟虫腈柱前衍生化产物SF1,均以氢核磁共振(hydrogen nuclear magnetic resonance,H NMR)、C核磁共振(C nuclear magnetic resonance,C NMR)和高分辨率质谱仪(high resolution mass spectrometer,HRMS)波谱技术进行结构鉴定与表征。
1.3.5 衍生化反应条件的优化
采用单因素试验对衍生化反应主要条件进行优化,试验因素梯度设计如下:催化剂分别选取EDC/DMAP、DCC/DMAP和PyBOP/TEA;反应溶剂分别选取DCM、ACN、THF、DMF、DMSO;反应时间分别设置10、20、30、40、50、60、70、80 min;反应温度分别设置5、15、25、35、45、55、65 ℃;荧光衍生试剂与氟虫腈体积比分别设置1∶1、3∶1、5∶1、7∶1、9∶1、11∶1、13∶1、14∶1。优化试验中的衍生产物,均以HPLC-FLD进行检测,以测得峰面积为指标衡量反应的效率。
1.3.6 氟虫腈柱前衍生化HPLC-FLD检测方法和条件
HPLC-FLD检测方法和条件如下:Symmetry C色谱柱(4.6 mm×250 mm,5 μm);柱温40 ℃;进样量10 µL;流速1.0 mL/min;流动相A为100%纯ACN,流动相B为超纯水;等度洗脱,时间为15 min,A相为80%,B相为20%;激发光波长和发射光波长分别为454 nm和490 nm;检测前色谱柱先用流动相平衡10 min,所有检测样品进样前均先经0.22 µm滤膜过滤。
1.3.7 氟虫腈柱前衍生化HPLC-FLD检测方法评价
1.3.7.1 精密度实验
精确吸取优化条件下反应后的溶液10 µL,按照1.3.6节色谱分离条件,连续进样检测20 次,测定衍生化产物SF1的保留时间和峰面积,并计算其相对标准偏差(relative standard deviation,RSD)。
1.3.7.2 稳定性实验
将衍生化反应产物在室温条件下分别放置1、2、4、8、24 h后进行HPLC-FLD检测,记录放置不同时间后衍生产物SF1的保留时间和峰面积,并计算其RSD,以此评价检测方法的稳定性。
1.3.7.3 重复性实验
按照1.3.3.3节氟虫腈柱前衍生化反应条件,进行10 次重复实验,在相同条件下进行HPLC-FLD检测,计算衍生产物SF1的保留时间和峰面积的RSD,以评价方法的重复性。
1.3.7.4 检出限和定量限的计算
检出限和定量限分别以=3和=10进行计算,按式(1)计算:

式中:为检出限;为检测器灵敏度;为噪音。
灵敏度按式(2)计算:

式中:为灵敏度;为信号响应值;为进样量。
合并2 个公式,得式(3):

信号响应值与噪音之比为该进样量下的信噪比;HPLC-FLD检测时,仪器可自动分析显示信噪比,直接用于计算检出限、定量限。
1.4 数据统计分析
数据统计分析及绘图软件为Microsoft Excel 2019、IBM SPSS statistics 25、GraphPad Prism 8.0和ChemBioDraw 14。样本间的多重比较采用Duncan新复极差法(<0.05和<0.01)。
2 结果与分析
2.1 香豆素类荧光衍生试剂的合成与结构表征
以4-(二乙氨基)水杨醛为先导物,在哌啶催化下与丙二酸二乙酯缩合成环,再经酯水解得到香豆素类荧光衍生试剂L1。采用H NMR、C NMR和HRMS波谱技术对荧光衍生试剂L1及中间体化合物1-1进行结构鉴定与表征,结果如下:
中间体化合物1-1:7-(二乙氨基)-2-氧-2-色酮-3-羧酸乙酯,红褐色固体,产率75.8%。H NMR(500 MHz,DMSO)8.54(s,1H),7.62(d,=9.0 Hz,1H),6.76(dd,=9.0,2.4 Hz,1H),6.53(d,=2.3 Hz,1H),4.24(q,=7.1 Hz,2H),3.48(q,=7.0 Hz,4H),1.29(t,=7.1 Hz,3H),1.14(t,=7.0 Hz,6H)。HRMS(ESI)/[M+H]:CHNO,理论计算值289.131 4,实际检测值290.136 9。
荧光衍生试剂L1:7-(二乙氨基)-2-氧-2-色酮-3-羧酸,橙黄色固体,产率97.2%。H NMR(500 MHz,DMSO)12.55(bs,1H),8.59(s,1H),7.68~7.61(m,1H),6.80(dd,=9.0,2.4 Hz,1H),6.57(d,=2.3 Hz,1H),3.49(q,=7.0 Hz,4H),1.14(t,=7.0 Hz,6H)。C NMR(126 MHz,DMSO)164.45、159.57、157.84、152.86、149.37、131.79、110.01、107.35、107.12、95.88、44.36、12.27。HRMS(ESI)/[M+H]:CHNO,理论计算值261.100 1,实际检测值261.099 3。
2.2 SF1的分离纯化与结构表征
选用EDC/DMAP为催化缩合剂,二氯甲烷为反应溶剂,氟虫腈与荧光衍生试剂L1用量比为1∶11,在45 ℃水浴中反应60 min,制得衍生化反应产物SF1。利用硅胶柱层析法,对所制备的SF1进行分离和纯化,并通过H NMR、C NMR和HRMS波谱技术对其进行了结构鉴定与表征,结果如下:
柱前荧光衍生化产物SF1:-(3-氰基-1-(2,6-二氯-4-(三氟甲基)苯基)-4-((三氟甲基)亚磺酰基)-1-吡唑-5-基)-7-(二乙氨基)-2-氧-2-色酮-3-甲酰胺,黄绿色固体,产率81.5%。H NMR(400 MHz,DMSO)11.69(s,1 H ),8.79(s,1 H ),8.46(d d,=17.0,1.3 Hz,2H),7.73(d,=9.2 Hz,1H),6.87(dd,=9.2,2.3 Hz,1H),6.61(d,=2.1 Hz,1H),3.50(q,=7.0 Hz,4H),1.13(t,=7.0 Hz,6H)。C NMR(101 MHz,DMSO)162.92、160.03、157.85、153.99、149.77、139.10、135.24、135.15、133.46、132.75、127.33、126.07、123.39、120.66、111.23、110.93、108.28、104.33、95.98、44.64、12.26。
2.3 荧光衍生试剂L1和衍生产物SF1的荧光光谱特性
由图3可知,荧光衍生试剂L1和氟虫腈荧光衍生产物SF1的荧光光谱性质差别不太大,SF1的激发光波长和发射光波长分别为454 nm和490 nm,Stokes位移为36 nm;L1的激发光波长和发射光波长分别为454 nm和480 nm,Stokes位移为26 nm。从峰形看,L1更加对称、平滑,其峰形比SF1稍好一些;从荧光强度看,在相同浓度下的L1和SF1都具有较强的荧光强度;从Stokes位移看,衍生化反应产物SF1比L1要大10 nm。根据宋昊翰的研究,Stokes位移越大,荧光检测时激发光对发射光的干扰就越小,因此检测会更加稳定些。上述结果显示,氟虫腈通过衍生化反应后所形成的产物,具有良好的荧光光谱性质,使建立高灵敏度的氟虫腈残留检测方法成为可能。

图3 荧光衍生试剂L1(A)和氟虫腈衍生产物SF1(B)在ACN中的荧光光谱扫描图Fig.3 Fluorescence spectra of fluorescent derivatization reagent L1 (A) and fipronil derivative SF1 (B) in acetonitrile
2.4 氟虫腈柱前衍生化反应条件的优化
2.4.1 催化剂对衍生反应效率的影响
根据文献报道,选择EDC/DMAP、DCC/DMAP和PyBOP/TEA三种碱性催化剂进行实验,检测分析其对氟虫腈与荧光衍生试剂L1的衍生化反应效率的影响。如图4所示,在EDC/DMAP的催化作用下,衍生产物SF1的HPLC-FLD检测所得峰面积极显著高于DCC/DMAP和PyBOP/TEA(<0.01),因此EDC/DMAP为衍生化反应的优选催化剂。王梦等的研究表明,EDC/DMAP在氟虫腈亚砜酰胺化反应中为较优催化剂。

图4 催化剂对香豆素类荧光衍生试剂与氟虫腈衍生化反应效率的影响Fig.4 Influence of catalyzer on the derivatization reaction efficiency between fluorescent coumarin derivatization reagent and fipronil
2.4.2 反应溶剂对衍生反应效率的影响
对衍生化反应所使用的溶剂进行优选,选择DCM、ACN、THF、DMF和DMSO 5种常用的衍生化反应溶剂进行试验,分析其对衍生反应效率的影响,结果如图5所示。衍生化反应在DCM中的效率最高,检测到衍生产物SF1的峰面积最大,荧光衍生化反应最完全,其次是在ACN中,而在THF、DMF和DMSO中反应不完全,效率很低。衍生化反应之所以在DCM中反应效率高,主要是因为荧光衍生试剂L1和氟虫腈在DCM中都具有很好的溶解性。基于上述试验结果,优选DCM为衍生化反应的溶剂。
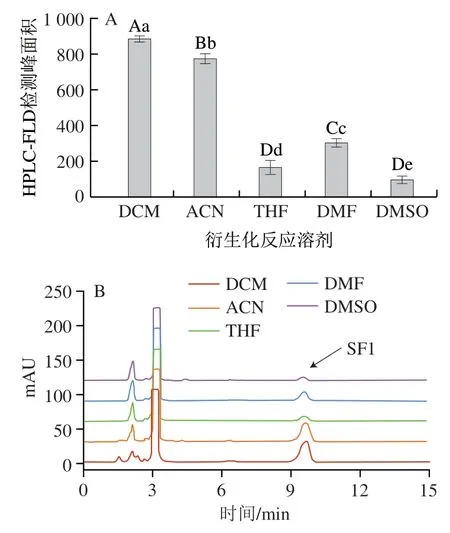
图5 反应溶剂对香豆素类荧光衍生试剂与氟虫腈衍生化反应效率的影响Fig.5 Influence of reaction solvent on the derivatization reaction efficiency between fluorescent coumarin derivatization reagent and fipronil
2.4.3 反应时间对衍生反应效率的影响
如图6所示,在10~80 min时间范围内,衍生化产物SF1的峰面积随反应时间的延长而增大,60 min时达到了峰值;进一步延长反应时间,产物的峰面积不再增加,基本保持不变。上述结果说明,60 min时衍生化反应基本完成,因此优选60 min为衍生化反应时间。

图6 反应时间对香豆素类荧光衍生试剂与氟虫腈衍生化反应效率的影响Fig.6 Influence of reaction time on the derivatization reaction efficiency between fluorescent coumarin derivatization reagent and fipronil
2.4.4 衍生温度对衍生反应效率的影响
温度是最重要的反应条件之一,直接影响衍生化反应的速率和效率,同时也对荧光衍生试剂和衍生产物的稳定性有一定的影响。为了获得适合的衍生化反应温度,设定反应时间为60 min,在5~65 ℃范围内对温度进行考察,结果如图7所示。在0~45 ℃温度区域内,衍生产物SF1的峰面积随温度的升高而增大;当衍生温度超过45 ℃时,温度升高会导致衍生效率降低,这可能是荧光衍生试剂和衍生产物在高于45 ℃的反应体系中稳定性下降所致。王梦等报道了类似研究结果,45 ℃ 为比较合适的衍生化反应温度。以上结果表明,45 ℃时衍生效率达到峰值,因此45 ℃为优选衍生化反应温度。

图7 衍生温度对香豆素类荧光衍生试剂与氟虫腈衍生化反应效率的影响Fig.7 Influence of derivatization temperature on the derivatization reaction efficiency between fluorescent coumarin derivatization reagent and fipronil
2.4.5 衍生试剂用量对衍生反应效率的影响
为了保证荧光衍生化的效率,确保氟虫腈能够反应完全,需要使用适量的荧光衍生试剂,因此本研究对荧光衍生试剂与氟虫腈用量比进行优化。如图8所示,随着荧光衍生试剂L1用量的增加,衍生产物SF1的峰面积不断增大,在用量比达到11∶1时,反应产物不增加,维持在平衡、稳定的状态。因此,优选的用量比(荧光衍生试剂∶氟虫腈)为11∶1。

图8 衍生试剂用量对香豆素类荧光衍生试剂与氟虫腈衍生化反应效率的影响Fig.8 Influence of derivatization reagent dosage on the derivatization reaction efficiency between fluorescent coumarin derivatization reagent and fipronil
综上所述,氟虫腈衍生化反应的优选条件如下:EDC/DMAP为催化剂,二氯甲烷为最佳反应溶剂,反应时间和衍生温度分别为60 min、45 ℃,荧光衍生试剂用量比为11∶1。检测色谱图如图9所示。

图9 氟虫腈柱前衍生化HPLC-FLD色谱图Fig.9 HPLC-FLD chromatogram showing separation of L1 and SF1
2.5 基于L1建立的氟虫腈柱前衍生HPLC-FLD检测回归方程和检出限
在前述衍生化试剂合成和衍生化反应条件优化的基础上,建立基于L1的氟虫腈柱前衍生HPLC-FLD检测方法,所得线性回归方程和检出限如表1所示。

表1 基于L1建立的氟虫腈柱前衍生HPLC-FLD检测方法参数Table 1 Analytical figures of merit of HPLC-FLD method for fipronil determination
由表1可知,检测回归方程具有较好的线性相关性,为0.999 6,检出限和定量限分别达到了0.01 µg/L和0.036 µg/L,在氟虫腈的痕量和微量检测中具有较好的应用前景。
2.6 基于L1建立的氟虫腈柱前衍生HPLC-FLD检测方法评价
对基于L1建立的氟虫腈柱前衍生HPLC-FLD检测方法的精密度、稳定性以及重复性进行评价,结果见表2。该方法的精密度、稳定性以及重复性3 个指标的保留时间的RSD均低于0.4%,峰面积的RSD均低于2.2%。上述结果表明,本实验所建立的氟虫腈HPLCFLD检测方法具有较好的稳定性和可靠性,可在实际检测中进行应用。

表2 基于L1建立的氟虫腈柱前衍生HPLC-FLD检测方法评价RSD结果Table 2 Relative standard deviations (RSDs) for precision,stability and repeatability of HPLC-FLD method for fipronil determination %
3 讨论
HPLC-FLD灵敏、稳定、干扰小,因此被广泛应用于痕量和微量检测。由于氟虫腈本身的荧光微弱,不能直接进行荧光检测,因此需要设计合成能对氟虫腈进行衍生化反应的高荧光强度柱前衍生化试剂,从而建立高灵敏度的氟虫腈HPLC-FLD检测方法。从已有文献资料看,目前尚无HPLC-FLD应用于氟虫腈检测方面的报道。目前氟虫腈的检测方法主要有HPLC、HPLCMS/MS、GC以及GC-MS等,但这些方法还存在一些不足。HPLC-MS/MS、GC-MS具有较高的灵敏度,应用范围较广,但检测成本相对较高,需要较为贵重的精密仪器,操作人员技能要求较高;HPLC检测成本低,操作较为简便,但灵敏度不高,难以达到痕量检测的要求。刘炜等建立了土壤中氟虫腈等6 种农药的HPLC-MS/MS检测方法,该方法氟虫腈的定量限为0.01 mg/kg;郭敏等采用GC法测定土壤中氟虫腈及其代谢物残留,结果显示,氟虫腈及其代谢物的最低检测浓度为1 µg/kg;王艳丽等采用负化学、电子轰击技术联用GC-MS法和GC-MS/MS法分别检测蛋、肉及内脏中氟虫腈残留,最低检出限为0.05 µg/kg;本实验采用香豆素类荧光衍生试剂L1,建立氟虫腈柱前荧光衍生化检测方法,其检出限为0.01 µg/L,定量限为0.036 µg/L,该方法灵敏、稳定、可靠,因此具有很好的应用前景。
根据杨子辉等的研究报道,在DCC/DMAP催化下,阿魏酸的羧酸基团与氟虫腈的氨基基团容易发生反应。为了制备建立HPLC-FLD检测方法所需的氟虫腈荧光衍生化产物,根据这一文献,设计以实验室前期合成的香豆素-3-羧酸作为荧光衍生试剂、与氟虫腈进行衍生化反应的研究方案,反应路线如图10所示。根据该研究方案,得到衍生化反应产物经二氯甲烷萃取(3×50 mL)后,再以硅胶柱层析法分离目标物,结果发现产物的纯化比较困难,耗时久,产率较低,明显低于上述文献报道的76.2%;同时反应后体系中极性相近的杂质较多,对后续色谱分离检测会产生干扰。因此,放弃以该化合物为荧光衍生试剂的研究方案,重新设计了以4-(二乙氨基)水杨醛为原料合成了荧光衍生试剂L1的方案。在建立和优化荧光衍生试剂L1柱前衍生氟虫腈主要反应条件时,实验室进行了大量的探索,曾设计和尝试多种方案,最终优化出如下反应条件:催化缩合剂为EDC/DMAP,反应溶剂为二氯甲烷,荧光衍生试剂L1与氟虫腈的用量比为11∶1,反应时间和衍生温度分别为60 min和45 ℃。优化条件下,衍生反应效率较高,衍生产物SF1也比较容易纯化。

图10 香豆素-3-羧酸柱前衍生氟虫腈合成荧光衍生化产物路线Fig.10 Synthesis routes of fluorescent derivative products of fipronil using coumarin-3-carboxylic acid as precolumn derivatization reagent
4 结论
以4-(二乙氨基)水杨醛为原料,经缩合成环、水解等反应合成了一种结构新颖的香豆素类荧光衍生试剂L1,基于L1建立氟虫腈柱前衍生化反应体系,分离、纯化、鉴定了衍生产物SF1;优化后的柱前衍生条件如下:催化缩合剂为EDC/DMAP,反应溶剂为二氯甲烷,荧光衍生试剂L1与氟虫腈用量比为11∶1,反应时间和衍生温度分别为60 min和45 ℃;在此基础上,建立氟虫腈柱前衍生化HPLC-FLD检测方法,该方法的检出限达到了0.01 µg/L,定量限为0.036 µg/L。此外,建立的基于羧基和氨基的柱前衍生化反应方法,还可用于其他具有氨基基团的待测物的检测。综上所述,氟虫腈柱前衍生化HPLC-FLD检测方法具有较好的应用前景,研究思路和方案对HPLCFLD方法研究具有一定的指导意义。

