热诱导温度与pH值对乳清浓缩蛋白凝胶结构和性质的影响
刘芙蓉,王雨生,2,李 鹏,房子蔚,陈海华,3,
(1.青岛农业大学食品科学与工程学院,山东 青岛 266109;2.青岛农业大学学报编辑部,山东 青岛 266109;3.青岛农业大学巴瑟斯未来农业科技学院,山东 青岛 266109)
乳清浓缩蛋白(whey protein concentrate,WPC)是指从巴氏杀菌的乳清中去除非蛋白成分后的乳清产品,是乳制品行业的副产物,是必需氨基酸的极好来源。乳清蛋白因具有发泡、包封、凝胶和乳化等优良功能和营养特性,在食品工业中得到了广泛的应用。目前,乳清蛋白已被应用于婴儿配方奶粉、烘焙产品、糖果、水果饮料、功能食品(运动饮料、营养品、减肥产品)和药品中。乳清蛋白最显著的功能特性之一是能够通过热诱导形成可固定大量水和其他食物成分的黏弹性凝胶,从而改善食品的外观、质地和性能,常被用作制备可食用凝胶。蛋白凝胶网络还能够保护和传递生物活性分子,提高其利用率。
蛋白凝胶的形成是一个复杂的过程,涉及蛋白质的变性、解离、聚集和凝胶化等反应。胶凝过程受许多因素影响,如热、酸、压力和酶等。乳清蛋白对热和环境pH值更为敏感,其功能特性也高度依赖于热敏感性和酸碱环境引起的成分变化,这极大地限制了乳清蛋白凝胶在肉制品、烘焙产品和乳制品等食品中的应用。因此,研究热诱导温度和pH值对WPC凝胶形成的影响有重要意义。
乳清蛋白的凝胶化过程受到pH值和热诱导温度的强烈影响。Nicolai和Jiang Shanshan等的研究表明热诱导能使蛋白质分子变性聚集,乳清蛋白在低温下聚集速度过慢,加热到高温时形成聚集体或凝胶;Ako等研究发现-乳球蛋白在60 ℃左右开始变性,85 ℃时变性最快。pH值在乳清蛋白凝胶化过程中也起着重要作用。Donato等发现-乳球蛋白的展开和聚集受蛋白质分子电荷分布的影响;Yang Chen等认为pH 5~11的油菜籽蛋白在不同温度下形成的凝胶网络主要是通过疏水相互作用和氢键连接;Li Quanyang等研究表明80 ℃加热pH 5.8和pH 6.7的乳清蛋白,蛋白质的聚集和凝胶化过程与疏水相互作用有关。目前的研究多集中在单一pH值或温度对凝胶的影响,特别是对添加了添加物的蛋白凝胶,然而蛋白质形成凝胶的过程同时受蛋白质浓度、环境温度、pH值的影响。因此,综合考虑多因素对WPC凝胶,特别是对无添加物的WPC凝胶的影响很有意义。
本研究采用自动电位滴定仪、动态流变仪、光学微流变仪、圆二色谱(circular dichroism,CD)仪、荧光分光光度计、扫描电子显微镜和紫外-可见分光光度计系统研究蛋白质浓度、热诱导温度(60、85 ℃)和环境pH值(2.0,酸性;4.5,等电点;7.0,中性;9.0,碱性)对WPC分子构象和WPC凝胶微观结构的影响,从微观角度揭示WPC凝胶的形成机制,以期为改善蛋白凝胶性能提供理论参考。
1 材料与方法
1.1 材料与试剂
WPC(蛋白质质量分数80%) 江苏富盛德生物工程有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
ZDJ-4B自动电位滴定仪 上海仪电科学仪器股份有限公司;MCR103型动态流变仪 奥地利安东帕公司;Rheolaser Master光学微流变仪 法国Formuloction公司;Chirascan CD仪 英国Applied Photophysics公司;F-2700荧光分光光度计、S-3400N扫描电子显微镜 日本日立公司;UV-2000紫外-可见分光光度计 尤尼柯(上海)仪器有限公司。
1.3 方法
1.3.1 WPC溶液的配制
用天平分别准确称取1.0~15.0 g WPC于100 mL烧杯中,加入去离子水,配制质量浓度分别为10~150 mg/mL的15 组WPC溶液,搅拌1 h,使蛋白质充分溶解。加入2~3 滴质量浓度为0.02 mg/mL的叠氮化钠以抑制微生物生长,并置于4 ℃冰箱中过夜,使蛋白质充分水化,得到WPC溶液备用。
1.3.2 蛋白质电荷密度()的测定
参考Kharlamova等的方法,选择配制的10、40、70、110、150 mg/mL 5 种质量浓度梯度的WPC溶液,用0.1 mol/L和1 mol/L的HCl(或NaOH)溶液调节pH值。首先将所有样品的pH值调至7.0,然后使用自动电位滴定仪依次滴定至特定pH值(7.0~3.0),记录WPC溶液的电位和消耗的HCl(或NaOH)溶液体积。根据式(1)、(2)分别计算每个蛋白分子结合或释放的H数量,推导:
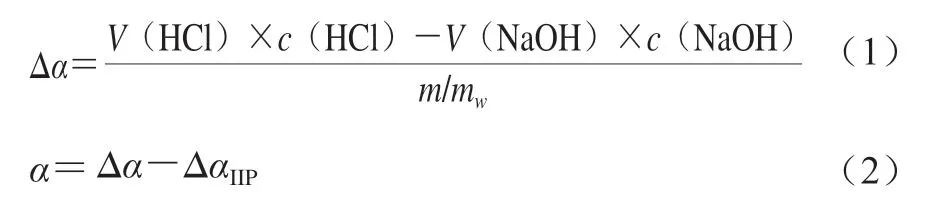
式(1)、(2)中:为WPC质量/g;(HCl)和(NaOH)为滴加的HCl和NaOH溶液体积/mL;(HCl)和(NaOH)为HCl和NaOH溶液质量浓度/(g/mL);m为WPC分子质量,为1.75×10g/mol;Δ为等离子点处WPC溶液电荷密度。
1.3.3 热诱导WPC凝胶的形成
用0.1 mol/L和1 mol/L的HCl(或NaOH)溶液调节不同质量浓度的WPC溶液(10~150 mg/mL)至特定pH值(1.0~9.0),分别在60 ℃和85 ℃水浴加热1 h后,用冰水浴快速冷却。根据Chihi等的倒管法将上述样品按外观状态分为:倾斜时流动的溶胶;倾斜45°不流动的均匀凝胶;具有脱水收缩现象的蛋白质沉淀。绘制WPC的溶胶-凝胶状态图。
1.3.4 动态流变性质测试
移取适量不同pH值(2.0、4.5、7.0、9.0)不同质量浓度(10、40、110、150 mg/mL)的WPC溶液,置于动态流变仪样品台。采用直径50 mm的平行板夹具PP50,设置平行板与样品台的间隙为1 mm,振荡频率1 Hz,振荡应变0.5%。将多余样品用刮刀移走,并用硅油密封边缘,以防水分蒸发。样品于25 ℃恒温3 min,然后以1.6 ℃/min升温至60 ℃(或85 ℃),恒温30 min,最后以1.6 ℃/min降温至25 ℃。记录过程中弹性模量(′)、黏性模量(″)和损耗角正切值(tan)。
1.3.5 微流变学性能的测定
参照Su Jiaqi等的方法并适当修改,取20 mL 150 mg/mL WPC溶液,采用1.3.3节方法调整溶液pH值至2.0、4.5、7.0、9.0后,加入光学微流变仪玻璃管中,并立即置于流变激光器的腔室中。设置初始温度30 ℃,升温速率1.83 ℃/min,升温至85 ℃后恒温30 min,最后自动降温至30 ℃。记录WPC胶凝过程中颗粒的均方位移(mean squared displacement,MSD)曲线随加热时间的变化,并采用仪器自带软件RheoSoft Master 1.4.0.0计算弹性指数(elasticty index,EI)、宏观黏度指数(macroscopic viscosity index,MVI)、固液平衡值(solid-liquid balance,SLB)。
1.3.6 CD分析
蛋白质二级结构的测定参照Yu Yali等的方法并适当修改,取质量浓度为150 mg/mL的WPC溶液,采用1.3.3节方法调整溶液pH值至2.0、4.5、7.0、9.0,分别在60 ℃和85 ℃水浴加热1 h并冰浴后进行破碎,稀释成质量浓度为0.5 mg/mL的WPC凝胶悬浊液。置于0.1 cm石英比色皿中,超纯水作空白对照,用紫外-可见分光光度计在远紫外光范围(波长190~260 nm)进行扫描。测试温度25 ℃,扫描速率1 nm/s,响应时间0.5 s,带宽1 nm。采用仪器自带CDNN软件计算蛋白质二级结构的含量。
1.3.7 荧光光谱分析
参照Xiao Yaqing等的方法并适当修改。制备与1.3.6节中相同的WPC凝胶悬浊液,使用荧光分光光度计和1 cm石英比色皿,扫描蛋白质的内源荧光光谱。测试温度25 ℃,激发波长295 nm,发射波长范围310~450 nm,发射和激发波长狭缝均为5 nm,扫描速率1 500 nm/min。
1.3.8 凝胶微观结构的观察
参照He Zhendong等的方法并适当修改。取质量浓度为150 mg/mL的WPC溶液,采用1.3.3节方法调整溶液pH值至2.0、4.5、7.0、9.0,在85 ℃水浴加热1 h形成WPC凝胶,切成1 cm×1 cm×1 cm凝胶块,-80 ℃超低温冷冻12 h后,真空冷冻干燥48 h。置于离子溅射仪中进行抽真空、喷金处理,使用扫描电子显微镜分别放大200、6 000 倍观察WPC凝胶微观结构,加速电压为5 kV。
1.3.9 相互作用力分析
取1.3.1节配制的40 mg/mL WPC溶液,调节pH值至2.0,量取4 等份40 mL溶液,分别加入蒸馏水、6 mol/L尿素溶液、0.5%十二烷基硫酸钠(sodium dodecyl sulfonate,SDS)溶液和30 mmol/L二硫苏糖醇(dithiothreitol,DTT)溶液各2 mL,混匀。所得溶液一分为二,分别于60 ℃和85 ℃水浴加热1 h,用冰水浴迅速冷却,得到WPC微凝胶悬浊液,加入10 倍体积的蒸馏水稀释,用紫外-可见分光光度计测定600 nm波长处的透光率。重复上述步骤,分别调节pH值至4.5、7.0和9.0,测定不同pH值的WPC微凝胶悬浊液透光率,分析氢键、疏水相互作用及二硫键对WPC凝胶形成的影响。
1.4 数据处理
所有实验均重复3 次。利用Excel 2010及Origin 2018软件绘图,用SPSS 17.0软件对数据进行单因素方差分析,<0.05,差异显著。
2 结果与分析
2.1 pH值对WPC溶液α的影响
如图1所示,pH值的降低使WPC的||先减小后增大,pH 4.5时,=0。Božič等发现,-乳球蛋白的净电荷会随环境pH值的变化而变化。Ako等发现电荷斥力在等电点(pI)处最小,改变pH值可使豌豆蛋白和-乳球蛋白更接近=0的等电点。这可能是因为pH值能改变蛋白质构象,进而改变蛋白质的。

图1 WPC质量浓度和pH值对α的影响Fig.1 Effect of WPC concentration and pH on α
由图1可以看出,WPC质量浓度对的影响与pH值有关。<0时,增加WPC质量浓度会使减小;而>0时,WPC质量浓度的增加会使增加;在=0附近,WPC质量浓度对的影响较小。Kharlamova等研究发现相同pH值下,乳清蛋白的一定程度上取决于蛋白质溶液的浓度。这可能是因为接近pI(pH 4.5)时,蛋白质本身的较低,所以浓度对蛋白质的影响不明显;远离pI时,蛋白质较高,分子之间的相互作用增强,所以浓度对蛋白质的影响增强。
2.2 WPC的溶胶-凝胶状态分析
如图2B所示,热诱导温度为85 ℃时,WPC溶液质量浓度小于30 mg/mL时不能形成凝胶;WPC质量浓度在50~80 mg/mL时,可在pH 4.0~6.0范围内形成均匀凝胶;WPC质量浓度在100~120 mg/mL时,可在pH 2.0~6.0范围内形成均匀凝胶;WPC质量浓度超过130 mg/mL时,则可在pH 2.0~9.0范围内形成均匀凝胶。Acosta等研究表明高浓度的蛋白能增强蛋白质之间、蛋白质与水之间的相互作用力,形成更好的凝胶网络结构。

图2 不同条件下WPC的溶胶-凝胶状态图Fig.2 Sol-gel state diagram of WPC under different conditions
WPC溶液的pH值能够影响形成凝胶的蛋白质量浓度范围。由图2B可知,热诱导温度为85 ℃、pH 4.5时(对应=0),形成均匀凝胶所需的蛋白质量浓度最低,为40 mg/mL;当pH 5~6时,形成均匀凝胶所需的蛋白质量浓度则增加至50 mg/mL;当pH≥7时,形成均匀凝胶所需的蛋白质量浓度超过120 mg/mL。由此可以看出,WPC易在酸性条件下形成凝胶,且接近于0时,更容易形成凝胶。Acosta等认为pH值通过调整蛋白质之间引力和斥力的平衡影响蛋白质的凝胶化。pH值的变化可以引起蛋白质的变化,进而影响凝胶的形成。不同时形成的蛋白凝胶状态不同,降低蛋白质的||使蛋白质分子间的斥力减弱,分子间的相互作用增强,可以促进凝胶的形成;而||较高时,蛋白质分子间静电斥力增强,能抑制蛋白质的聚集。
由图2A、B可知,与60 ℃的热诱导温度相比,WPC在85 ℃加热时,可形成均匀凝胶的蛋白质量浓度范围、pH值范围(范围)更大。Nicolai等也发现在低于70 ℃加热乳清分离蛋白悬浊液时,胶凝效果不理想。这表明较高的热诱导温度能促进蛋白质分子链的展开,增强蛋白质分子间的疏水相互作用和静电吸引力,形成更好的三维凝胶网络。
为进一步研究WPC胶凝特性,根据图2B中WPC凝胶形成所需的不同pH值范围及蛋白质量浓度,选择10 mg/mL(在酸性、碱性范围内均不能形成凝胶的质量浓度)、40 mg/mL(能够形成凝胶的最小质量浓度)、110 mg/mL(在酸性范围内能够形成凝胶的质量浓度)、150 mg/mL(在酸性、碱性范围内均能形成凝胶的质量浓度)的WPC溶液,研究在酸性、等电点、中性和碱性(pH 2.0、4.5、7.0和pH 9.0)环境中凝胶的动态流变性质。
2.3 WPC凝胶化的动态流变性质分析
根据加热过程中WPC溶液的′、″和tan等黏弹性行为的变化,可判断凝胶体系的形成情况。通常,当′>″或tan<1时,凝胶开始形成,且tan值越小,样品胶凝的程度越高。
如图3B所示,85 ℃热诱导的凝胶,在初始加热阶段(25~55 ℃),WPC的′和″均较低,且′<″;在一定范围内,随着温度的升高,′和″没有明显变化;温度升高至55 ℃时,′明显升高,且′>″,凝胶开始形成,该温度为凝胶温度,所用时间(33 min)即为凝胶时间(表1)。在恒温和降温过程中,′和″持续增加,表明降温过程能进一步强化WPC的凝胶网络结构。Xiao Yaqing和Li Quanyang等也发现,乳清蛋白凝胶在冷却过程中′和″会显著增加;Pouzot等研究发现球状蛋白达到凝胶温度后,′迅速增加,冷却过程中又升高了2~3 倍。Xia Wenjie等发现大豆分离蛋白凝胶过程中也有类似的′、″变化规律。这可能是热诱导温度高于凝胶温度时,蛋白质分子展开并聚集,形成具有一定空间结构的凝胶网络,温度的升高使更多蛋白质分子加入到凝胶网络中,引起凝胶网络结构的重排,′和″持续增加;恒温过程中,越来越多的蛋白质分子参与到蛋白质网络结构的形成中,凝胶网络结构进一步增强,′持续升高;降温过程中,蛋白质分子间及分子内的氢键作用力增强,使′进一步增加。另外,降温过程可以降低蛋白质聚集体的迁移率,有利于进一步完善凝胶结构。

图3 pH 2、WPC质量浓度150 mg/mL条件下WPC凝胶形成过程中的动态流变曲线Fig.3 Rheological curves of WPC gels with WPC concentration of 150 mg/mL and at pH 2.0

表1 WPC质量浓度和pH值对凝胶时间的影响Table l Effects of WPC concentration and pH on the gel formation time of WPC
对比图3A和3B,热诱导温度不同,WPC溶液的流变曲线略有差异。85 ℃热诱导时,WPC在升温过程中已形成凝胶,而60 ℃热诱导时,到达恒温阶段才形成凝胶。此外,85 ℃热诱导的凝胶,′可超过70 000 Pa,远高于60 ℃热诱导的′(50 000 Pa);85 ℃热诱导凝胶的″也高于60 ℃,说明85 ℃热诱导的凝胶黏弹性更强。Wang Wenqiong等报道70 ℃处理的乳清蛋白凝胶的′高于65 ℃和60 ℃,认为高温可以增加蛋白凝胶的弹性和黏性。这可能是因为温度影响蛋白质的变性和展开程度,较高温度能增强蛋白变性程度和聚集程度,使凝胶网络结构更加致密,凝胶′更大。
由表1可知,相同热诱导温度和pH值时,WPC质量浓度越高,凝胶时间越短。Pouzot等研究发现乳清蛋白和乳球蛋白的凝胶时间均随蛋白溶液浓度的降低而延长,蛋白溶液浓度过低时难以形成凝胶。Khemakhem等发现蛋白溶液只有达到一定浓度时才能形成凝胶,且浓度越高,胶凝速率越快。这可能是因为蛋白质的肽链在加热过程中展开,而随着蛋白质浓度的升高,蛋白质肽链之间存在折叠、缠绕等现象,胶凝速度快,形成的凝胶结构更加稳定。
根据表1,WPC质量浓度和热诱导温度相同时,pH值会影响WPC凝胶时间,pH 4.5时(等电点),凝胶时间最短。Acosta和Young等研究表明,pH值通过影响蛋白质分子电荷分布,改变分子间静电引力和斥力的平衡,进而影响蛋白质的胶凝速度。这可能是因为在等电点附近,蛋白质分子间相互碰撞的机会增加,形成的氢键和疏水相互作用更强,能够促进凝胶的形成。远离等电点时,蛋白质分子间静电排斥作用增加,限制了蛋白的聚集,所以蛋白质凝胶时间延长。
2.4 WPC凝胶化的微流变学性质分析
由宏观溶胶-凝胶状态图(图2)和动态流变性质结果可知,WPC质量浓度为150 mg/mL、热诱导温度为85 ℃时,WPC形成凝胶的pH值范围最广。为进一步描述WPC凝胶形成动力学性质,采用不损伤WPC凝胶结构的微流变学方法,探究WPC质量浓度为150 mg/mL、热诱导温度为85 ℃时的凝胶特征。
光学微流变技术通过布朗运动中粒子的运动速度和运动范围反映体系黏度和弹性,具有灵敏度高、受外界干扰小等优点,可以在无损条件下测定凝胶的黏弹特性。粒子的MSD是去相关时间的函数,随着去相关时间的延长,黏性样品的MSD呈线性增长,而弹性样品中的颗粒被限制在网络结构中,MSD呈非线性增长。
图4可反映WPC溶液在升温→恒温→降温过程(图中MSD曲线颜色由蓝色渐变为红色的过程)中逐步形成WPC凝胶的过程。不同pH值条件下的MSD曲线中,WPC粒子首先呈现出斜率较高的蓝色线性曲线,随着加热的进行,曲线斜率逐渐降低,变为绿色曲线,并逐步形成MSD比较稳定的平台区。这表明,开始时WPC粒子可以在溶液中自由移动,MSD曲线呈现为高斜率的直线,即WPC粒子在一段较短的去相关性时间内具有很大的MSD变化,WPC粒子运动剧烈;随着加热的进行,曲线斜率的降低说明WPC粒子间相互作用增强,溶液黏度升高,WPC粒子的运动受限;平台区的出现说明在一段较长的去相关性时间内,WPC粒子保持较小的运动变化,即WPC凝胶已经形成。平台区的高度(MSD值)越小,说明凝胶网格越小,网络结构越紧密,凝胶弹性越强。平台区之后,MSD继续升高意味着WPC粒子能够摆脱WPC凝胶网络束缚(出现粒子迁移现象),此时,凝胶粒子平均速度的大小可反映凝胶的宏观黏度。比较不同pH值下MSD曲线平台区的出现时间可以发现,pH 4.5时,平台区出现在加热40 min 40 s时(图4中箭头所示黑色MSD曲线),加热时间最短,说明pH 4.5时,WPC溶液最容易形成凝胶。


图4 不同pH值下WPC凝胶化过程的MSD曲线Fig.4 MSD curves of WPC gelation process at different pH values
SLB反映样品的类固体和类液体行为的占比,位于0~1之间。SLB>0.5时,类液体行为占主导地位;SLB<0.5时,类固体行为占主导地位。如表2所示,不同pH值的WPC溶液加热前的SLB在0.67~0.81之间,呈液态性质,85 ℃加热后,SLB显著降至0.19~0.30之间,类固体行为占主导地位,说明形成了WPC凝胶。pH 2.0、4.5时形成的WPC凝胶,其SLB小于pH 7.0、9.0时凝胶的SLB,说明pH 2.0、4.5时有利于形成弹性更强的WPC凝胶。He Jun等研究表明,酸奶形成凝胶后,弹性增强,SLB值降低。

表2 不同pH值下WPC凝胶化的SLB、MVI和EI值Table 2 SLB,MVI,and EI values for WPC gelation process at different pH values
在微流变学中,EI反映粒子在网络结构中可移动的平均范围,表征样品的弹性性能。EI越大,粒子可移动范围越小,凝胶的弹性越强。MVI对应网络结构中粒子的平均运动速度,表征零剪切条件下样品的宏观黏度。MVI越大,粒子完成一定位移所需时间越长,意味着粒子的迁移率越低,黏度越大。由表2可以看出,不同pH值的WPC溶液经85 ℃热诱导后,EI与MVI均显著升高100~10 000 倍,说明加热处理使WPC分子链展开并发生聚集,形成了致密的凝胶网络,导致粒子间的运动阻力增加。与pH 7.0、9.0相比,WPC溶液在pH 2.0、4.5时形成的WPC凝胶具有更高的EI和MVI,说明WPC溶液在酸性条件下形成的凝胶具有更强的弹性和黏性。He Jun等研究表明,在酸奶加工过程中,形成凝胶结构后,EI和MVI均明显升高。在WPC等电点附近时,粒子之间的静电斥力小,蛋白质分子容易聚集,蛋白质网络结构重排,会引起额外的蛋白质簇并入已形成的凝胶网络结构中,使EI和MVI升高。
2.5 WPC凝胶的蛋白二级结构分析
如图5所示,pH 7.0时,未加热诱导的WPC凝胶在190 nm波长处有一个正峰,是典型的-螺旋结构的特征峰;在208~222 nm范围内有较宽的负峰吸收带,表明存在-螺旋、-折叠和无规卷曲等蛋白质二级结构。由表3可知,pH 7.0时,未加热诱导的WPC凝胶中-螺旋、-折叠、-转角和无规卷曲等二级结构的相对含量分别为11.3%、44.6%、19.3%和29.5%。

表3 不同制备条件下WPC凝胶的蛋白二级结构的相对含量Table 3 Secondary structure composition of WPC gels prepared under different conditions

图5 不同制备条件下WPC凝胶的CD图Fig.5 CD spectra of WPC gels prepared under different conditions
由图5可知,60 ℃加热对WPC凝胶的CD图吸收峰的位置和强度影响较小。但85 ℃加热时吸收峰强度显著降低。由表3可知,pH 7.0时,85 ℃热诱导制备的WPC凝胶的-螺旋含量由11.3%降至9.2%,无规卷曲含量则由29.5%升高至31.1%。这可能是因为加热会破坏-螺旋结构中的氢键,导致-螺旋含量显著降低;热诱导温度超过85 ℃时,蛋白质发生不可逆变性,蛋白质结构迅速展开,无规卷曲结构含量增加。
从图5还可以看出,pH值对WPC凝胶的CD图吸收峰强度的影响较大,190 nm处吸收峰在pH 4.5时强度最小,pH 2.0时强度最大,pH 7.0、9.0时强度相近。由表3可知,当WPC溶液的pH值远离等电点时,-螺旋含量显著增加,-折叠含量显著减少。中性pH值条件下85 ℃热诱导的WPC凝胶的-螺旋含量9.2%,-折叠含量43.6%,无规卷曲含量31.1%。这些结果表明蛋白质分子的展开和聚集与溶液的pH值有关。因此,热诱导和pH值能引起WPC分子二级结构的展开、重新排列和聚集,影响蛋白质的有序结构(如-螺旋和-折叠等)。
2.6 WPC凝胶的蛋白三级结构分析
色氨酸残基位于蛋白质初级结构的疏水区域,色氨酸内发色团对其环境的极性有高度敏感性,已被广泛应用于分析蛋白质的三级结构变化。如图6所示,环境pH值对WPC内源荧光光谱谱线位置和强度有较大影响。未加热处理的样品,WPC溶液在等电点条件下(pH 4.5)的最大荧光强度波长位置()为329 nm,荧光强度最低,发生荧光猝灭现象;远离等电点时,荧光强度明显增强;pH 2.0、9.0时,明显红移至332 nm。发生红移表明环境pH值的改变引起WPC构象的变化,使疏水区域的更多色氨酸残基暴露于溶剂中。Sun Chanchan等发现pH值由3.5升至8.5时,乳清蛋白由333 nm红移至339 nm。远离等电点的酸性或碱性环境可能会引起蛋白质多肽链的展开,使更多色氨酸残基暴露,荧光强度增强;在WPC等电点附近(pH 4.5),蛋白质的聚集引起微环境变化,导致色氨酸基团被“掩盖”或处于非极性环境中,荧光强度最低。
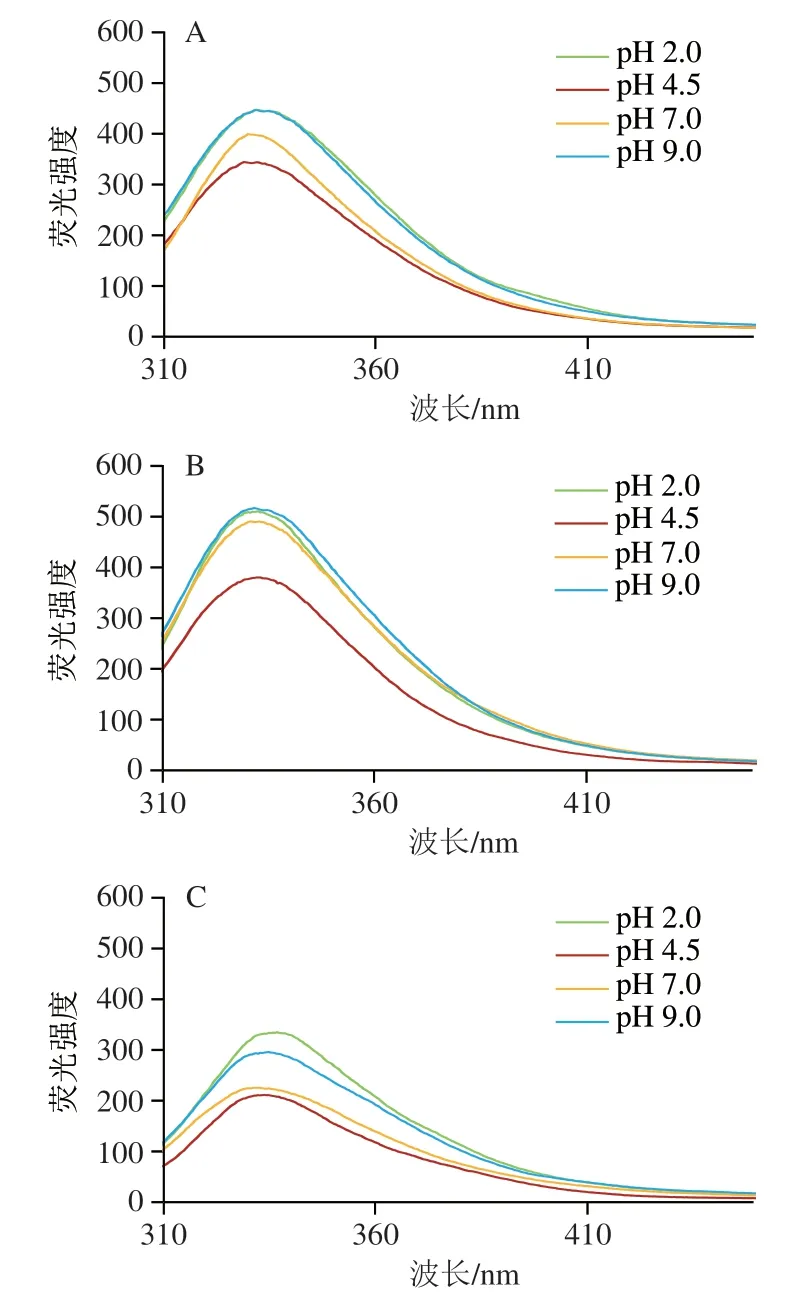
图6 不同制备条件下WPC内源荧光光谱Fig.6 Intrinsic fluorescence spectra of WPC prepared under different conditions
由图6可知,加热处理也会引起WPC的红移,且热诱导温度越高,红移现象越明显,而等电点附近的WPC溶液尤为明显。在pH 4.5时,经60 ℃和85 ℃热诱导后,WPC的从329 nm分别升高至333 nm和334 nm。Momen等研究发现热处理会使乳清蛋白红移。Klost等发现豌豆蛋白经热处理后会暴露更多的色氨酸残基,引起红移。
不同温度的热处理对WPC荧光强度的影响明显不同,经60 ℃热处理的WPC荧光强度明显高于经85 ℃热处理的,即85 ℃热处理能引起荧光猝灭。Wang Wenqiong等发现,在碱性条件下加热乳清蛋白,其荧光强度随温度的升高呈现先升高后降低的趋势。Jiang Shanshan等的研究也表明,乳清蛋白的荧光强度会随着温度的升高而增加,但温度超过90 ℃时,荧光强度反而会降低。这可能是因为热处理能够促进乳清蛋白分子的展开,使色氨酸暴露,疏水基团暴露的数量增加,但过高的诱导温度会使乳清蛋白暴露过多的疏水基团,疏水基团间的相互作用增强,导致分子聚集、疏水基团被掩埋,荧光强度反而降低。
2.7 WPC凝胶的微观结构分析
如图7A所示,WPC溶液pH值在远离等电点时(pH 2.0、7.0、9.0),WPC凝胶表面光滑,结构细腻,呈半透明状态;但在等电点附近(pH 4.5)时,WPC凝胶表面粗糙、孔洞较多、有明显的颗粒感,为白色不透明凝胶。因此,蛋白质凝胶的网络结构与环境pH值有关。Homer等也发现乳清分离蛋白溶液在远离等电点时(pH 3.0、7.0)形成由细链结构聚集体组成的光滑、半透明凝胶;在等电点附近(pH 5.0)形成的凝胶外观呈白色颗粒状,质地较为粗糙。
放大6 000 倍观察WPC凝胶的表面(图7B)可以发现,pH值远离等电点条件下形成的WPC凝胶微观表面光滑,存在细链状聚集体;但在等电点附近,形成的WPC凝胶表面分布有大量尺寸较大的球状颗粒聚集体,颗粒聚集体堆积成多孔、片层状微观表面。Wang Yaosong等发现pH值远离等电点时,乳清蛋白形成表面光滑的链状凝胶;Langton等发现中性条件下蚕豆蛋白可形成致密、细腻的凝胶结构,而在等电点附近(pH 5.0)形成的凝胶具有颗粒结构。pH值对凝胶结构的影响可能是因为pH值能够改变,影响分子静电斥力,从而改变蛋白质的聚集状态。在等电点附近,接近于零,蛋白质分子静电斥力最小,分子聚集加剧,容易形成球形颗粒状凝胶结构,质地粗糙。pH值远离等电点时,蛋白质分子表面大,静电斥力增强,蛋白质分子不易聚集,分子链容易伸展,有利于分子间相互交联形成细链状凝胶结构。

图7 WPC凝胶横切面照片(A)及扫描电镜图(×6 000)(B)Fig.7 Photographs (A) and scanning electron micrographs (×6 000) (B) of WPC gels
2.8 WPC分子间相互作用力分析
如图8所示,pH值对WPC凝胶悬浊液透光率有很大影响。pH 4.5时,WPC凝胶悬浊液透光率最低,静置后极易形成肉眼可见的沉淀,说明等电点附近容易形成尺寸较大的聚集体,使WPC凝胶悬浊液浊度升高。pH 2.0、4.5时,热诱导温度对WPC凝胶悬浊液透光率影响不明显,但pH 7.0、9.0时,经85 ℃热诱导的WPC凝胶悬浊液透光率明显低于经60 ℃热诱导,且3 种解离剂的加入并没有改变这种规律。这可能是因为pH 2.0、4.5时,60 ℃和85 ℃均能诱导形成WPC凝胶,但pH 7.0、9.0时,只有85 ℃才能诱导形成WPC凝胶(图2)。Shen Xue等也发现当pH值接近乳清蛋白等电点时,凝胶悬浊液浊度增加明显。Young等则发现乳清蛋白在远离等电点时形成的凝胶悬浊液可以较长时间保持稳定。这很可能是因为pH值能显著改变蛋白质分子表面的,从而影响蛋白质颗粒的形成,引起凝胶悬浊液浊度的变化:在等电点时,乳清蛋白分子所带净电荷接近于零,静电排斥作用很弱,蛋白质分子极易聚集而形成沉淀;远离等电点时,蛋白质分子带有大量同种电荷,静电排斥作用强,蛋白质分子不易聚集,这也说明静电排斥力在蛋白分子聚集体形成方面发挥重要控制作用。
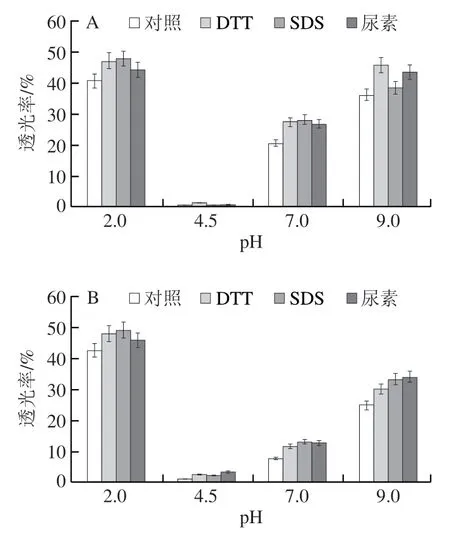
图8 解离剂对WPC凝胶悬浊液透光率的影响Fig.8 Effect of dissociation agents on light transmittance of WPC gel suspensions
从图8还可以看出,与对照(不添加解离剂)相比,不同的制备条件(温度、pH值)下,加入尿素、SDS和DTT等蛋白解离剂后制备的WPC凝胶,其凝胶悬浊液透光率均明显升高,说明3 种解离剂的加入能破坏维持WPC凝胶稳定的氢键、疏水相互作用、二硫键作用。3 种相互作用的强度与凝胶制备的热诱导温度有关。pH 2.0、85 ℃制备凝胶时,3 种解离剂的加入使凝胶悬浊液透光率分别升高12%、15%和7%,而60 ℃制备时,透光率分别上升16%、18%和9%,即85 ℃热诱导的凝胶具有更强的抗解离效果,说明温度的升高可以明显增强WPC凝胶中的氢键、疏水相互作用、二硫键作用,使凝胶更加稳定。Alavi等研究表明80 ℃或90 ℃的热诱导温度可以使更多蛋白质分子展开,并在疏水相互作用和二硫键等作用下发生聚集。Yang Chen等研究也表明,较高的热诱导温度能促使更多的疏水基团参与油菜籽蛋白凝胶的形成,使凝胶更加稳定。Young等研究表明,当诱导温度大于凝胶温度时,热处理可以明显增强乳清蛋白中蛋白质分子间、蛋白质与水分子间的相互作用。这可能因为提高热诱导温度会促使乳清蛋白分子链展开得更充分,使更多疏水残基暴露于蛋白质表面,从而增强蛋白质分子间的氢键和疏水相互作用。此外,冷却过程也有利于增强氢键和二硫键作用。上述结果表明,氢键、二硫键及疏水相互作用在WPC凝胶的形成过程中起着非常重要的作用。
3 结论
热诱导温度和pH值都能影响WPC凝胶的形成,但二者的影响机理不同。与60 ℃相比,热诱导温度为85 ℃时,能形成凝胶的WPC溶液质量浓度、pH值范围更大,所得凝胶的′较高。较高的热诱导温度能促使WPC分子充分展开,降低-螺旋含量(pH≥4.5),使无规卷曲含量升高,红移,促进蛋白分子之间碰撞,从而可能使分子间疏水相互作用、氢键与二硫键作用增强,形成致密的网络结构和黏弹性强的WPC凝胶。pH值可能通过改变WPC分子、蛋白分子二级和三级结构的展开影响凝胶网络结构。在WPC分子等电点(pH 4.5)附近,净电荷减少,分子间静电斥力降低,容易聚集并形成粗糙颗粒状凝胶;远离等电点时,蛋白质分子表面大,静电斥力强,分子不易聚集,有利于形成细链状结构的凝胶。这为研究乳清蛋白凝胶体系及其在不同环境中的实际应用提供理论基础。

