野生灵芝驯化前后子实体活性成分比较
张彬彬,王慧真,刘晓雪,郭金英,王春霞,郑素月*
(1.河北工程大学园林与生态工程学院,河北 邯郸 056021;2.河北工程大学生命科学与食品工程学院,河北 邯郸 056021)
灵芝是一种具有食用和药用价值的传统真菌[1]。灵芝子实体含有丰富的活性成分,如灵芝多糖、三萜类化合物、蛋白质和微量元素等,多年来受到国内外学者的广泛关注和深入研究[2]。已经证实灵芝活性成分具有抗氧化[3-5]、抗肿瘤[6-7]、保肝护肝[8]、预防糖尿病[9]、改善抑郁行为[10]、提高机体免疫力[11]、抑制肥胖[12]等多种生物活性。
目前,研究表明人类的许多慢性疾病和衰老现象均与人体内的自由基水平失衡有关。清除自由基等抗氧化研究越来越受到重视[13]。1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-picrylhydrazyl radical,DPPH)是一种很稳定的氮中心的自由基[14],被广泛用于评价天然化合物的抗氧化活性。
野生灵芝和栽培灵芝活性成分及药理作用是否存在显著差异,学术界意见不统一。曹恒生等[15]研究表明野生灵芝的多糖含量比栽培灵芝的高;周春红等[16]认为栽培灵芝和野生灵芝的活性成分差异不是很大;莫峥嵘等[17]对海南栽培灵芝与野生灵芝的5个样本的总糖含量进行比较分析,得出结论为栽培海南赤芝和栽培信州赤芝的总糖含量比野生海南赤芝的低,但高于野生黄边灵芝和野生海南灵芝的总糖含量;孟国良等[18]研究表明同一菌株栽培的子实体多糖和三萜含量明显高于相应的野生子实体。目前大多研究都是对不同菌株的野生灵芝与栽培灵芝主要活性成分的比较研究,但对于同一菌株野生灵芝子实体及驯化后子实体进行比较的研究较少。本研究以采自河南省南召县的30个野生灵芝为研究对象(30个灵芝的种质鉴定和出芝试验已另文报道[19]),对其中能驯化出芝的25个灵芝菌株驯化前后的子实体主要活性成分差异进行了研究,为进一步开发高活性的野生灵芝资源提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验材料
供试野生灵芝菌株25个(采集自河南省安阳市南召县),由河北工程大学食用菌实验室分离和保藏,菌株编号见表1。
表1 供试菌株Table 1 Strains for test
1.1.2 试剂
甲醇(分析纯):莱阳经济技术开发区精细化工厂;三氯乙酸(分析纯):天津市大茂化学试剂厂;高氯酸(分析纯):国药集团化学试剂有限公司;冰醋酸(分析纯):天津欧博凯化工有限公司;铁氰化钾(分析纯)、重蒸酚(C6H6O,分析纯)、香草醛(分析纯)、熊果酸(分析纯):生工生物工程(上海)股份有限公司;牛血清蛋白、考马斯亮蓝G-250(生物染色剂)、DPPH:天根生化科技(北京)有限公司。
1.2 仪器与设备
电热鼓风干燥箱(DHG-9070):上海一恒科学仪器有限公司;722S可见分光光度计:上海仪电分析仪器有限公司;凯特离心机(TG18G):盐城市凯特试验仪器有限公司。
1.3 试验方法
1.3.1 样品制备
按照栽培袋培养基配方(棉籽壳86%、麦麸12%、石灰1%、石膏1%)准确称取配料,制作培养袋,接种后25℃恒温培养25 d,长满袋后生理后熟10 d进入出菇管理。将菌袋移至出菇棚内,棚室要求有少量散射光,空气湿度保持在80%~90%,温度保持在25℃~28℃,最高温度不超过30℃。采收第一潮子实体并剪碎、80℃烘干至恒重,粉碎,过20 mm筛,保存在干燥器中备用。
1.3.2 灵芝多糖含量测定
采用传统热水回流提取法提取灵芝多糖,并参考文献[20]所述用苯酚-硫酸法进行多糖含量测定。
1.3.3 灵芝三萜含量测定
采用乙醇回流提取法提取灵芝三萜[21],并参考文献[22]所述用香草醛-高氯酸-冰乙酸显色法测定灵芝三萜的含量。
1.3.4 灵芝粗蛋白含量测定
采用凯氏定氮法测定灵芝粗蛋白含量[23]。
1.3.5 灵芝可溶性蛋白含量测定
采用考马斯亮蓝法测定灵芝可溶性蛋白含量[24]。
1.3.6 灵芝灰分含量测定
采用马弗炉灼烧法测定灵芝灰分含量[25]。
1.3.7 灵芝水提取液体外抗氧化活性测定
DPPH自由基清除率测定参照Hu等[26]的方法;总还原力测定参照Tulsawani等[27]的方法。
1.4 数据处理
用SPSS统计分析软件对数据进行差异显著性分析。
2 结果与分析
2.1 不同菌株灵芝子实体营养成分的测定结果
2.1.1 采集野生灵芝子实体营养成分对比分析
不同菌株野生灵芝活性成分含量分析见表2。

表2 不同菌株野生灵芝活性成分含量分析Table 2 Analysis of active components in wild Ganoderma lucidum
由表2可知,25个野生灵芝的多糖含量为33.20%~57.30%,YL-14最高达到 57.30%,YL-31最低,为 33.20%;三萜含量为 2.65 mg/g~11.30 mg/g,YL-40最高,YL-37最低;粗蛋白含量为6.52%~15.63%,YL-68最高,YL-37最低;可溶性蛋白含量为1.78 mg/g~6.29 mg/g,YL-82最高,YL-37最低;灰分含量为1.33%~3.91%,YL-8最高,YL-51最低。不同菌株之间活性成分含量多数存在显著性差异。
2.1.2 驯化后灵芝子实体活性成分测定结果
不同菌株驯化后灵芝活性成分含量分析见表3。

表3 不同菌株驯化后灵芝子实体活性成分含量分析Table 3 Analysis of active components in Ganoderma lucidum fruiting bodies after domestication by different strains
由表3可知,25个栽培灵芝的多糖含量为31.55%~49.40%,YL-89最高达到49.40%,YL-57最低为 31.55%;三萜含量为 5.59mg/g~9.90mg/g,YL-42最高,YL-49最低;粗蛋白含量为8.65%~15.85%,YL-83最高,YL-81最低;可溶性蛋白含量为2.48 mg/g~10.04 mg/g,YL-18最高,YL-8最低;灰分含量为0.98%~2.22%,YL-18最高,YL-31最低。不同菌株之间活性成分含量多数存在显著性差异。
2.2 同一菌株野生灵芝菌株驯化前后子实体营养成分对比
2.2.1 多糖含量对比分析
同一菌株野生灵芝驯化前后子实体的多糖含量分析见图1。

图1 同一野生灵芝菌株驯化前后子实体多糖含量对比Fig.1 Comparison of polysaccharide content in fruiting bodies of the same wild Ganoderma lucidum strain before and after domestication
由图1可知,同一菌株野生灵芝驯化前后子实体的多糖含量差异较大,除菌株YL-68和YL-61外,其他菌株野生灵芝多糖含量均高于其栽培灵芝的多糖含量,并且均呈现显著或极显著性差异。
2.2.2 三萜含量对比分析
同一菌株野生灵芝驯化前后子实体的三萜含量分析见图2。
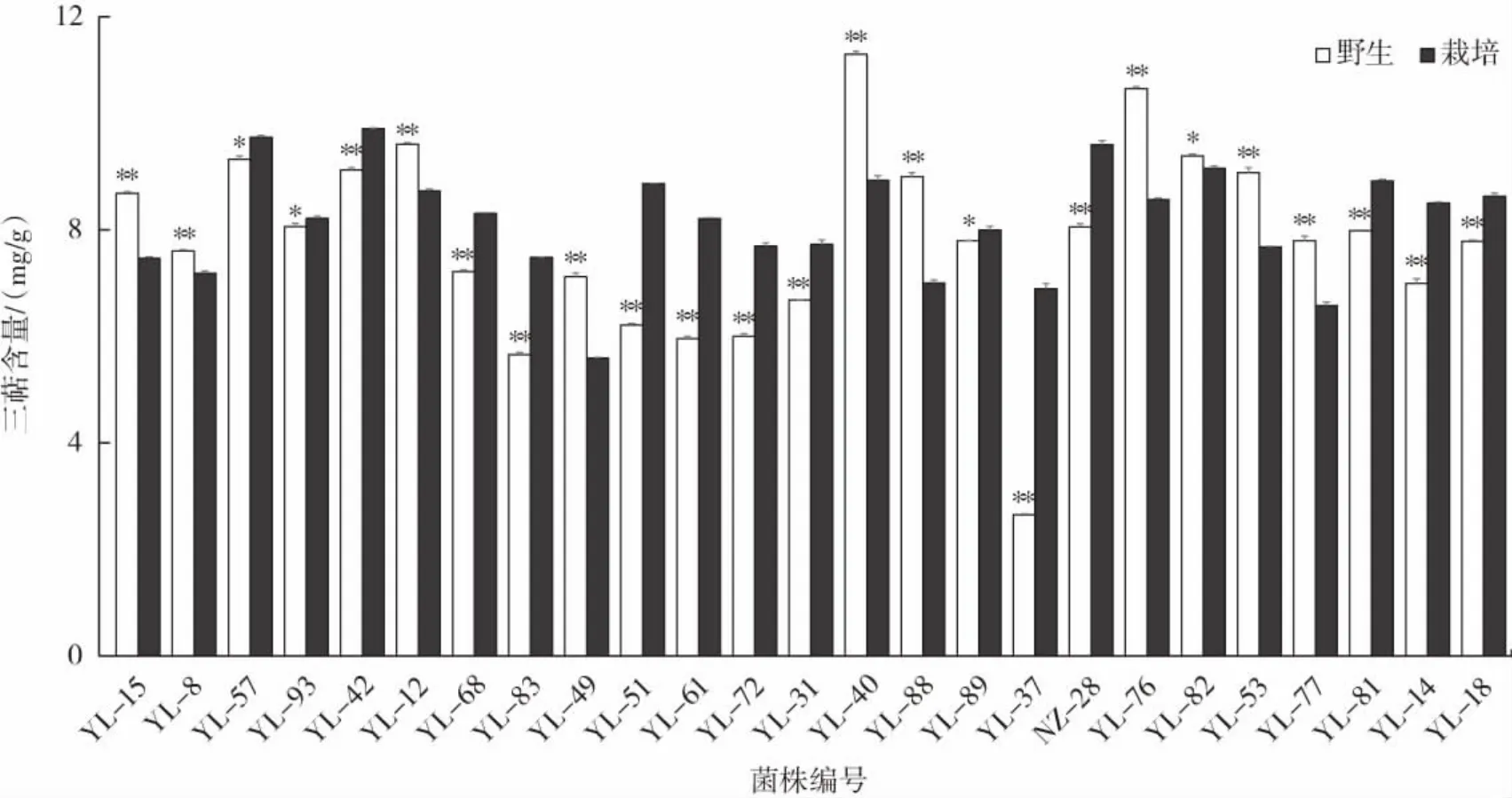
图2 同一野生灵芝菌株驯化前后子实体三萜含量对比Fig.2 Comparison of triterpenoid contents in fruiting bodies of the same wild Ganoderma lucidum strain before and after domestication
由图2可知,同一菌株野生灵芝驯化前后子实体的三萜含量差异较大,与多糖含量不同,YL-15、YL-8等10个菌株的野生灵芝三萜含量高于其栽培灵芝的三萜含量。
2.2.3 粗蛋白含量对比分析
同一菌株野生灵芝驯化前后子实体的粗蛋白含量分析见图3。
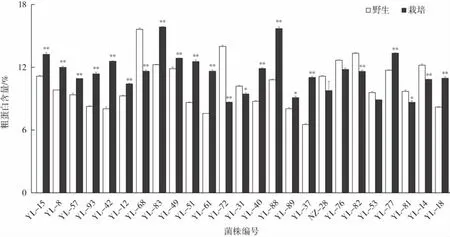
图3 同一野生灵芝菌株驯化前后子实体粗蛋白含量对比Fig.3 Comparison of crude protein content in fruiting bodies of the same wild Ganoderma lucidum strain before and after domestication
由图3可知,野生灵芝粗蛋白含量高于其驯化后子实体的菌株只有9个,占比仅36%,驯化后灵芝菌株YL-83和YL-88子实体表现出较高的粗蛋白含量潜力。
2.2.4 可溶性蛋白含量对比分析
同一菌株野生灵芝驯化前后子实体的可溶性蛋白含量分析见图4。
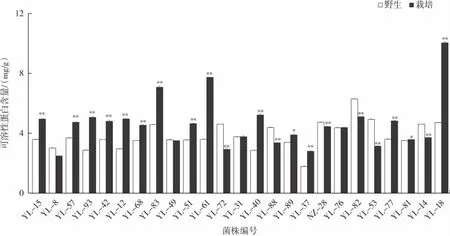
图4 同一野生灵芝菌株驯化前后子实体可溶性蛋白含量对比Fig.4 Comparison of soluble protein content in fruiting bodies of the same wild Ganoderma lucidum strain before and after domestication
由图4可知,多数野生灵芝可溶性蛋白含量低于其驯化后子实体的含量,且驯化后灵芝菌株YL-83、YL-61和YL-18表现出高可溶性蛋白含量潜力。
2.2.5 灰分含量对比分析
同一菌株野生灵芝驯化前后子实体的灰分含量分析见图5。
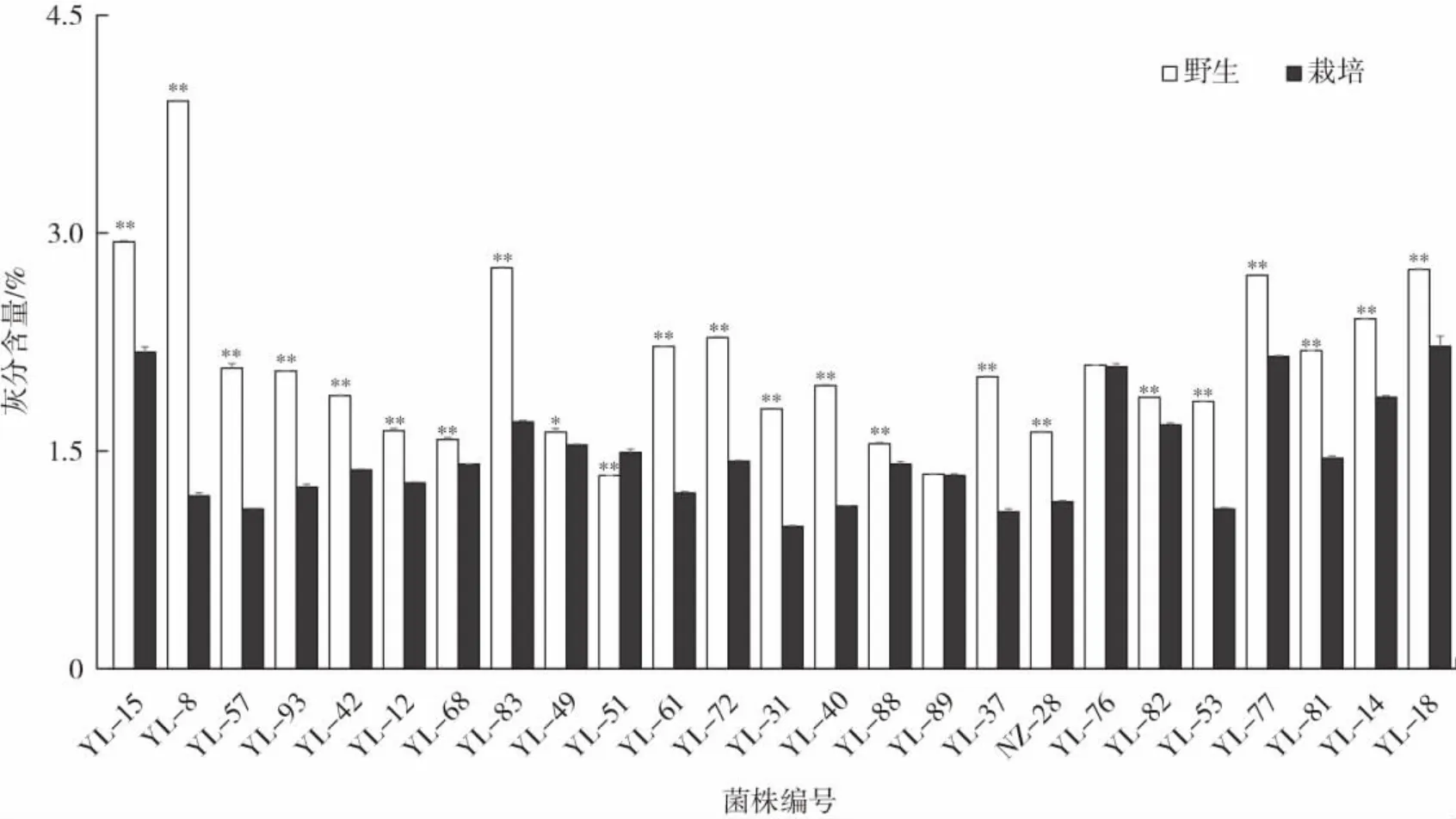
图5 同一野生菌株驯化前后子实体灰分含量对比Fig.5 Comparison of ash content in fruiting bodies of the same wild Ganoderma lucidum strain before and after domestication
由图5可知,大部分野生灵芝菌株的灰分含量高于其驯化后子实体,且存在极显著性差异,菌株YL-8的驯化前灰分含量最高,菌株YL-89和YL-76的野生灵芝灰分与驯化后子实体灰分含量接近,无显著性差异。
2.3 体外抗氧化活性
不同菌株灵芝子实体水提取液体外抗氧化活性分析见表4。

表4 不同菌株灵芝水提取液体外抗氧化活性Table 4 Antioxidant activity of Ganoderma lucidum aqueous extract in vitro
由表4可知,野生灵芝驯化前后子实体的水提液都具有一定的抗氧化活性,不同菌株之间DPPH自由基清除率存在较大差异,驯化前后水提液的DPPH自由基清除率范围分别为55.40%~88.54%和36.60%~64.90%;不同菌株灵芝水提取液对Fe2+具有一定的还原力,并且与DPPH自由基清除率的趋势一致,驯化前子实体水提液的体外抗氧化活性均高于驯化后子实体,其中YL-8、YL-68和YL-40表现出较好的抗氧化能力。
3 讨论与结论
本研究发现,不同灵芝菌株之间及同一菌株驯化前后子实体之间营养成分含量存在显著性差异,大部分野生灵芝的多糖和灰分含量高于其驯化后子实体,而大部分菌株驯化后子实体的三萜、粗蛋白和可溶性蛋白含量高于野生灵芝。驯化前水提液的体外抗氧化活性均高于驯化后子实体,造成这种现象的原因,可能是由于灵芝多糖易溶于水,而灵芝三萜不易溶于水,所以灵芝水提液的体外抗氧化活性与灵芝多糖含量测定结果的趋势较为接近,例如YL-8、YL-68和YL-40表现出较好的抗氧化能力。
不同种类灵芝、灵芝不同部位以及灵芝不同的生长阶段所含的灵芝活性成分含量和种类会有所差异[28],一些关于野生蘑菇的报告称,环境因素和自然生境可能是影响活性成分含量及构成的重要因素,如Zhang等[29]发现热胁迫可促进灵芝三萜的生物合成,Stojkovi等[30]证明灵芝的化学和生物活性特性高度依赖于样品的来源。因此简单地说野生灵芝价值高于栽培灵芝较片面。本研究对野生灵芝和栽培灵芝提出更客观的认识,为理性消费市场上灵芝产品提供参考依据,同时充分挖掘利用南召县丰富野生灵芝资源的潜在价值,为野生灵芝驯化必要性提供理论依据。

