多根多段肋骨骨折对新西兰兔侧肺损伤及生物学指标变化影响研究
黄素伟,张伟巍,逯 娜,张 雁,徐昌富
张家口市第一医院 胸外科,河北 张家口 075041
急性肺损伤(acute lung injury,ALI)多由直接和间接致伤因素导致肺泡上皮细胞及毛细血管内皮细胞损伤,造成弥漫性肺间质及肺泡水肿,进而出现急性低氧性呼吸功能不全[1-5]。有研究表明,炎症因子白细胞介素4(interleukin 4,IL-4)、白细胞介素8(interleukin 8,IL-8)与toll 样受体4(toll like receptor 4,TLR4)炎性信号通路相关,通过刺激巨噬细胞的激活干预ALI 的进展[6-7]。在急性肺损伤的治疗中,IL-4、白细胞介素10(interleukin 10,IL-10)和白细胞介素13(interleukin 13,IL-13)也发挥重要作用[8]。由此可见,炎症因子是ALI 的重要生物学标志物,同时有研究表明,炎症因子可能通过诱导肺部细胞凋亡对ALI进行干预[9-10]。本研究建立新西兰兔单根多根多段ALI 模型,旨在探讨多根多段与单根肋骨骨折ALI 炎症生物学标志物的变化差异,并分析多根多段肋骨骨折是否会影响肺组织细胞的凋亡。现报道如下。
1 材料与方法
1.1 材料与仪器 60 只8 月龄新西兰兔,体质量(3.0±0.2)kg,雌雄各30 只,购于北京市海淀兴旺动物养殖场[SYXK(京)2019-0054]。所有新西兰兔月龄相近、体质量相差不超过0.1 kg 雌雄各半。将新西兰兔随机分为3 组,对照组、单根组和多根组每组各20 只。本实验通过医院伦理委员会审核。PM7000 心电监护仪(深圳迈瑞生物医疗电子股份有限公司),AVlCOMPACT3 型血气分析仪(瑞士雷度公司),LECA-RM2135 型石蜡切片机(德国莱卡公司),olympus bx40 光学显微镜(日本奥林巴斯公司),KS50R 低速离心机(凯达科学仪器有限公司),680 全自动ELISA 仪(美国BIO-RAD 公司)。
1.2 研究方法
1.2.1 新西兰兔模型构建、分组及处理 实验前,新西兰兔禁食6 h。用3% 戊巴比妥钠注射液(40 mg/kg)腹腔注射麻醉后,取仰卧位固定于动物固定台上,脱去胸部及上腹部兔毛。将单根组新西兰兔置于BIM-Ⅵ型生物撞击机下,采用重362.8 g、直径4.4 cm钢球自撞击机钢管从1.0 m 高处,以自由下落方式撞击动物右侧胸壁处致伤,多根组从1.5 m 高处,以自由下落方式撞击动物右侧胸壁处致伤,对照组仅麻醉不撞击,连接心电监护仪记录各组新西兰兔伤前和伤后的呼吸频率变化。
1.2.2 新西兰兔血气分析 在致伤后24 h,用1.0 ml 动脉血气针抽取各组新西兰兔股动脉血液样本0.5 ml,在AVlCOMPACT3 型全自动血气分析仪上测定肺泡动脉氧分压(arterial partial pressure of oxygen,PaO2),动脉血二氧化碳分压(arterial partial pressure of carbon dioxide,PaCO2),血氧饱和度(blood oxygen saturation,SaO2)。
1.2.3 酶联免疫吸附法检测炎症标志物表达 新西兰兔取动脉血2 ml,4℃下3 000 r/min 离心10 min,收集上清液,分装到EP 管中,严格按照试剂盒说明采用酶联免疫吸附法检测血清中IL-4(RAB0301,美国sigma 公司)、IL-8(RAB1110,美国sigma 公司)和IL-10(RAB0802,美国sigma 公司)表达水平,于吸光度450 nm 下进行各样本吸光度检测,每个样本3 个复孔。
1.2.4 苏木精-伊红染色法检测肺病理损伤 取各组新西兰兔肺组织的石蜡包埋组织,用石蜡切片机切4 μm 厚度切片,60℃烘5 min;二甲苯Ⅰ脱腊20 min,二甲苯Ⅱ脱腊10 min,1/2 二甲苯+1/2 无水乙醇-100%-95%-85%-70%-50% 乙醇各1 min,自来水冲洗15 s;苏木素染色5 min,自来水冲洗1 min,使切片变蓝;1% 盐酸乙醇分化10 s,自来水冲洗1 min;1% 稀氨水返蓝10 s,自来水洗1 min;伊红染色1 min,自来水洗30 s;依次运用不用浓度的50%、70%、80% 乙醇脱水各1 min,再用95% 乙醇漂色1 min,无水乙醇脱水5 min,最后放入二甲苯Ⅰ3 min,二甲苯Ⅱ3 min;中性树胶封片后显微镜下进行观察。
1.2.5 蛋白免疫印迹法检测凋亡标志蛋白表达 取适量肺组织在液氮中研磨并取总蛋白,使用BCA 法测定蛋白浓度,采用5×十二烷基硫酸钠的蛋白上样缓冲液在98℃上煮沸10 min 后储存于-80℃冰箱备用。实验时将各样本加入不同的泳道,浓缩胶电压80 V 10 min,分离胶电压110 V 2 h,后转至PVDF 膜,5% 脱脂奶粉封闭2 h。加入特异性一抗B 淋巴细胞瘤-2 基因(B-lymphocytoma-2 gene BCL2)、BCL2-associated X 的蛋白质(BCL2-associated X protein,BAX)、半胱氨酸天冬氨酸蛋白酶3(Caspase3)和GAPDH(1∶2 000,bs-0755R,北京Bioss 有限公司)于4℃冰箱过夜。TBST 洗膜3 次,每次5 min,加入特异性二抗,孵育1 h。TBST 洗膜3 次,每次5 min,采用ECL 化学发光液曝光显影,使用Photoshop 图像分析软件系统进行半定量分析。
1.3 统计学方法 采用SPSS 23.0 软件进行统计学分析。符合正态分布的计量资料以均数±标准差()表示,组间比较采用双尾独立样本t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 各组新西兰兔的呼吸频率比较 建模前,3 组新西兰兔的呼吸频率比较,差异无统计学意义(P>0.05)。建模后,与对照组比较,单根组和多根组新西兰兔呼吸频率显著升高,且多根组显著高于单根组,差异均有统计学意义(P<0.05)。见表1。
表1 3 组新西兰兔呼吸频率变化情况比较(,次/min)
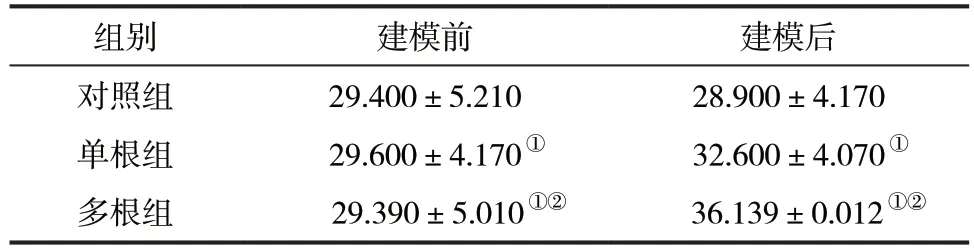
表1 3 组新西兰兔呼吸频率变化情况比较(,次/min)
注:与对照组比较,①P<0.05;与单根组比较,②P<0.05
2.2 各组新西兰兔骨动脉血气比较 与对照组比较,单根组和多根组PaO2、SaO2显著降低,PaCO2显著升高,差异具有统计学意义(P<0.05);与单根组比较,多根组PaO2和SaO2显著降低,PaCO2显著升高,差异有统计学意义(P<0.05)。见表2。
表2 各组新西兰兔动脉血气变化情况比较()

表2 各组新西兰兔动脉血气变化情况比较()
注:与对照组比较,①P<0.05;与单根组比较,②P<0.05;1 mmHg=0.133 kPa
2.3 各组新西兰兔血清炎症因子表达水平比较 与对照组比较,单根组和多根组IL-4、IL-8 和IL-10 表达水平显著升高,且多根组较单根组升高更明显,差异均有统计学意义(P<0.05)。见表3。
表3 各组新西兰兔血清炎症因子表达水平比较(,pg/ml)
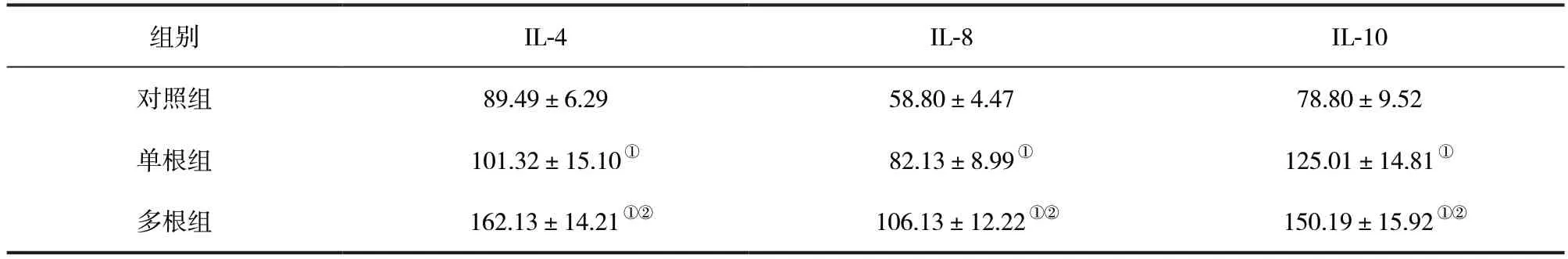
表3 各组新西兰兔血清炎症因子表达水平比较(,pg/ml)
注:与对照组比较,①P <0.05;与单根组比较,②P <0.05
2.4 各组新西兰兔肺病理学比较 与对照组比较,单根组和多根组均出现急性肺损伤表现,肺组织明显淤血,肺泡萎陷并呈局灶性、梅花样的肺不张表现,肺组织可见大小不一的不规则点、片状出血区域,切面可见红色渗液溢出,并伴有炎性细胞浸润;多根组病理学结果严重程度高于单根组,肺泡萎陷增加,出血区域扩大,炎性细胞浸润增加,提示多根肋骨骨折造成了严重的肺部损伤和肺部细胞凋亡。见图1。

图1 各组新西兰兔肺病理学结果比较(苏木精-伊红染色×200)
2.5 各组新西兰兔肺部组织凋亡信号通路分子的比较 蛋白免疫印迹法检测结果显示,与对照组比较,单根组和多根组B 淋巴细胞瘤-2 基因(B-lymphocytoma-2 gene BCL2)-associated X 的 蛋白质(BCL2-associated X protein,BAX)、Casepase3蛋白表达水平显著上升,BCL2 表达水平降低,差异有统计学意义(P<0.05);与单根组比较,多根组BAX、Casepase3 蛋白表达水平显著上升,BCL2 表达水平降低,差异有统计学意义(P<0.05)。见图2。
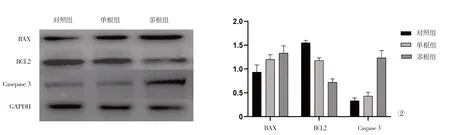
图2 各组新西兰兔肺部组织凋亡信号通路分子的比较
3 讨论
ALI 的临床特征为肺容积减少、肺顺应性降低、通气/血流比例失调,伴有进行性低氧血症和呼吸窘迫,肺部影像学表现为非均一性的渗出性病变[11-12]。胸部撞击伤致ALI 的致伤机制尚不完全清楚,有研究认为,直接暴力撞击时强大的外力压迫胸壁,使胸腔体积迅速缩小,胸腔内压力快速升高,压迫肺组织,使其出血、水肿,当外力撤除后,胸廓回弹,在产生胸腔内负压的同时,受压肺组织快速复张,加重肺组织原来受损区域的损伤,过度和失控的炎症反应导致肺组织发生继发性损伤。炎症反应及炎性因子释放在胸部撞击伤致急性肺损伤的发展过程中起关键的作用,也是肺损伤后病情复杂的重要原因[13-17]。但白细胞介素在创伤造成的多根多段肋骨骨折所致肺损伤中发挥的作用尚不清晰。本研究结果显示,单根组和多根组新西兰兔肺损伤加剧,呼吸频率显著升高,PaO2和SaO2显著降低,PaCO2显著升高。这提示肺部功能的损伤。结合HE 病理分析,多根组出现肺组织淤血,肺泡萎陷及肺不张等炎性细胞浸润表现,证实了多根多段肋骨骨折会造成显著的肺细胞损伤。本研究结果显示,单根组和多根组新西兰兔外周血IL-4、IL-8、IL-10 等炎性因子均显著增加,且多根组显著高于单根组。这提示炎症因子的释放与骨折损伤程度存在一定关系。
BAX 和BCL2 是参与细胞凋亡的重要基因[18]。有研究表明,BAX/BCL2/Caspase9/Caspase3 途径可以显著调控非小细胞肺癌癌细胞增殖、凋亡过程,且参与肺癌细胞周期调控[19]。本研究结果显示,单根组和多根组BAX、Casepase3 蛋白表达水平显著上升,BCL2 表达水平降低,且多根组各蛋白表达水平的改变程度均高于单根组。这提示,BAX、BCL2 及Caspase3 分子是机械损伤致多根多段肋骨骨折造成肺组织损伤的重要调控因子,其参与了炎性诱导的肺损伤过程。
综上所述,本研究证实了多根多段肋骨骨折会造成新西兰兔肺部严重病理损伤,炎症标志物表达水平上升,凋亡标志物表达水平发生显著变化,且生物标志物改变水平可能与损伤程度有一定的相关性。

