婴幼儿配方粉中生物素提取方法与微生物法测定精密度的研究
刘旸, 刘九阳, 李原野, 王淼, 房玉国, 张丽宏, 黄晓林, 夏行昊, 齐会娟
(1.黑龙江省绿色食品科学研究院, 哈尔滨 150028;2.东北农业大学食品学院, 哈尔滨 150036;3.黑龙江惠丰乳品有限公司大庆分公司, 黑龙江 大庆 163000)
0 引言
生物素B7是一种无色或白色结晶粉末物质[1-6], 是水溶性B族维生素[7-10]。生物素在人体中主要以羧化酶辅酶[11-13]的形式参与细胞中脂肪、蛋白质以及糖类代谢等一切生命活动[14-15]。生物素不能人体合成, 必须通过含有或添加生物素的食品中获得。经研究发现, 一般用1.0 mol/L硫酸提取植物源性食品中生物素[16];而对动物源性食品中生物素则采用3.0 mol/L硫酸进行提取[17]。GB 5009.259-2016《食品安全国家标准 食品中生物素测定》对婴幼儿配方食品中生物素则是采用3 %(约0.5 mol/L)硫酸进行提取[18]。为验证3种不同浓度的硫酸对婴幼儿配方奶品中生物素的提取效果, 用微生物法测定进行比较。最后基于该提取生物素方法, 通过实验室间比对的方式, 对微生物法测定婴幼儿配方食品中生物素的精密度进行研究。
1 材料与方法
1.1 材料与试剂
氯化钠(AR)、无水乙醇(AR)、硫酸(98%)(AR)、氢氧化钠(AR), 天津市科密欧化学试剂有限公司;生物素标准品(C10H16N2O3S, CAS:58-85-5, 纯度≥98 %), 西格玛奥德里奇(上海)贸易有限公司;乳酸杆菌琼脂培养基, 美国BD Difco;乳酸杆菌肉汤培养基, 美国BD Difco;生物素测定用培养基, 美国BD Difco。
1.2 仪器与设备
恒温培养箱, 德国MMM;722分光光度计, 上海光谱仪器;电子分析天平, 北京赛多利斯;pH计, 北京赛多利斯;盖勃离心机;破壁料理机, 美国Westinghouse。
1.3 方法
1.3.1 菌悬液的制备[18-22]
将实验用植物乳杆菌(Lactobacillus plantarum,ATCC 8014)菌株活化后, 接种到乳酸杆菌琼脂培养基上, 36±1℃培养16~24 h, 再转种2代~3代来增强活力。将24 h内活化后的菌株接种到乳酸杆菌肉汤培养基中, 36±1℃培养16~24 h, 以大于3 000转/min离心5 min, 弃去上清液, 加入10 mL生理盐水, 用涡旋混合器振荡该悬液。再离心5 min, 弃去上清液。如前操作清洗2~3次后, 再加10 mL生理盐水, 混匀。吸取0.5~1.0 mL该菌悬液于10 mL生理盐水中, 混匀制成测试菌悬液。以生理盐水做空白, 用分光光度计于550 nm波长下测定测试菌悬液透光率T(%), 调整上述菌液加入量, 使测试菌悬液透光率在60%~80%。
1.3.2 测定用样品及制备和保存
1.3.2.1 测定用样品信息
1#婴幼儿配方粉(中国检验检疫科学研究院测试评价中心的质控样品, 证书编号为803IP04051, Lot 2017.09.19);特殊医学用途婴儿配方奶粉:2#氨基酸配方, 适用于食物蛋白过敏婴儿, 0~12个月适用, 未添加乳糖(Lot 2017.09.19);3#无乳糖配方粉, 0~12个月乳糖不耐受婴儿(Lot 20180114);4#早产儿/低体重出院后配方粉, 0~12个月出院后的早产儿(Lot 20180205);5#乳蛋白深度水解配方(Lot 05/26/11);6#乳蛋白部分水解婴儿配方乳粉, 0~1个月(Lot 2017.09.12)。6个样品用1#~6#表示。
1.3.2.2 测定用样品制备和保存
1#婴幼儿配方粉, 每个包装冷冻到-20℃存放, 使用前恢复室温使用。
特殊医学用途婴儿配方食品2#~6#, 均质后分装成小包装, 室温避光封口保存。
1.3.2.3 参与实验室间比对的实验
A为本实验室(北方), B为本地社会第三方实验室(北方), C为本地质监系统实验室(北方), D为质检系统实验室(南方);E为药监系统实验室(南方)。
5家实验室用A-E表示。
1.3.3 实验方法
1.3.3.1 样品的测定
1#婴幼儿配方粉和2#~6#特殊医学用途婴儿配方食品:分别加入50 mL 3、1 mol/L和0.5 mol/L硫酸在121℃下水解30 min。
以上样品经硫酸高压水解后, 取出迅速水浴冷却至室温。用氢氧化钠溶液调节pH至4.5±0.2, 移入250 mL容量瓶中用水定容至刻度。用定量滤纸过滤, 最初约10 mL滤液应弃去, 吸取5 mL滤液于100 mL烧杯中, 加水约20 mL, 用氢氧化钠溶液调节pH至6.8±0.2, 移入100 mL容量瓶中加水定容至刻度。标准曲线和样品测定参照GB 5009.259-2016《食品安全国家标准 食品中生物素测定》[18、23-26]。
1.3.3.2 实验室间重复性和再现性证实实验[27-29]
实验室间方法验证方法参照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30]。算上本中心共5家实验室参与本次实验室间验证, 其中6个样品为6个水平, 每个样品测定7次。
2 结果与分析
2.1 食品中生物素提取条件的确定
用1#婴幼儿配方粉分别进行提取预试验, 3个样品分别同时用0.5 mol/L硫酸溶液、1 mol/L硫酸溶液和3 mol/L硫酸溶液进行121℃下水解30 min前处理, 水解后, 快速冷却到室温后观察, 见表1。

表1 1#样品在不同浓度硫酸水解的结果比对试验
2.2 精密度值(重复性和再现性)证实实验[30]
2.2.1 原始数据和实验室内均值
为方法验证各个实验室的原始数据, 并求出了实验室内算术均值。验证数据为各个实验室独立测定并出具, 加盖各个实验室公章, 见表2。
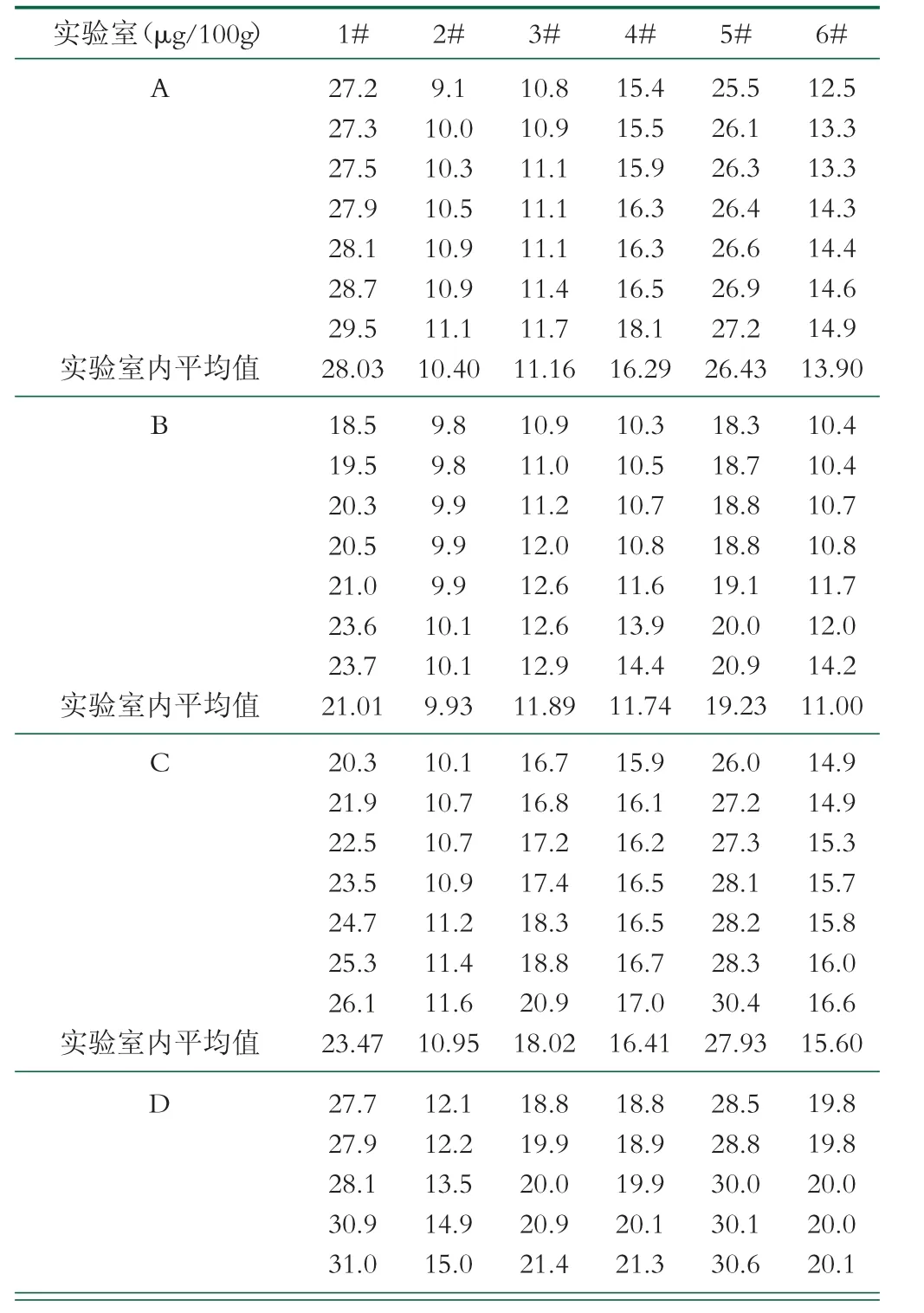
表2 原始数据和实验室内均值

(续表2)
2.2.2 一致性和离群值的检验
根据表2进行一致性和离群值的检查, 采用了检验一致性的方法(曼德尔h统计量和曼德尔k统计量), 和检验离群值的数值方法(科克伦检验Cochran和格拉布斯检验Grubbs)。具体计算公式参照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30]计算出曼德尔统计量k和h, 并绘制出图1和图2。并根据2.2.3.4(1)显著水平为5 %、1 %时曼德尔统计量h的临界值和2.2.3.5(1)显著水平为5 %、1 %时曼德尔统计量k的临界值进行判定。
2.2.2.1 曼德尔h统计量和曼德尔k统计量
由表2可知, 对每个实验室的每个水平, 计算实验室间的一致性统计量h(曼德尔h统计量), 如图1所示。
由图1可知, 5个实验室都处于正确值范围内, 可以进一步验证, 对每个实验室, 计算实验室内的一致性统计量k(曼德尔k统计量), 如图2所示。

图1 实验室进行分组的实验室间一致性曼德尔统计量
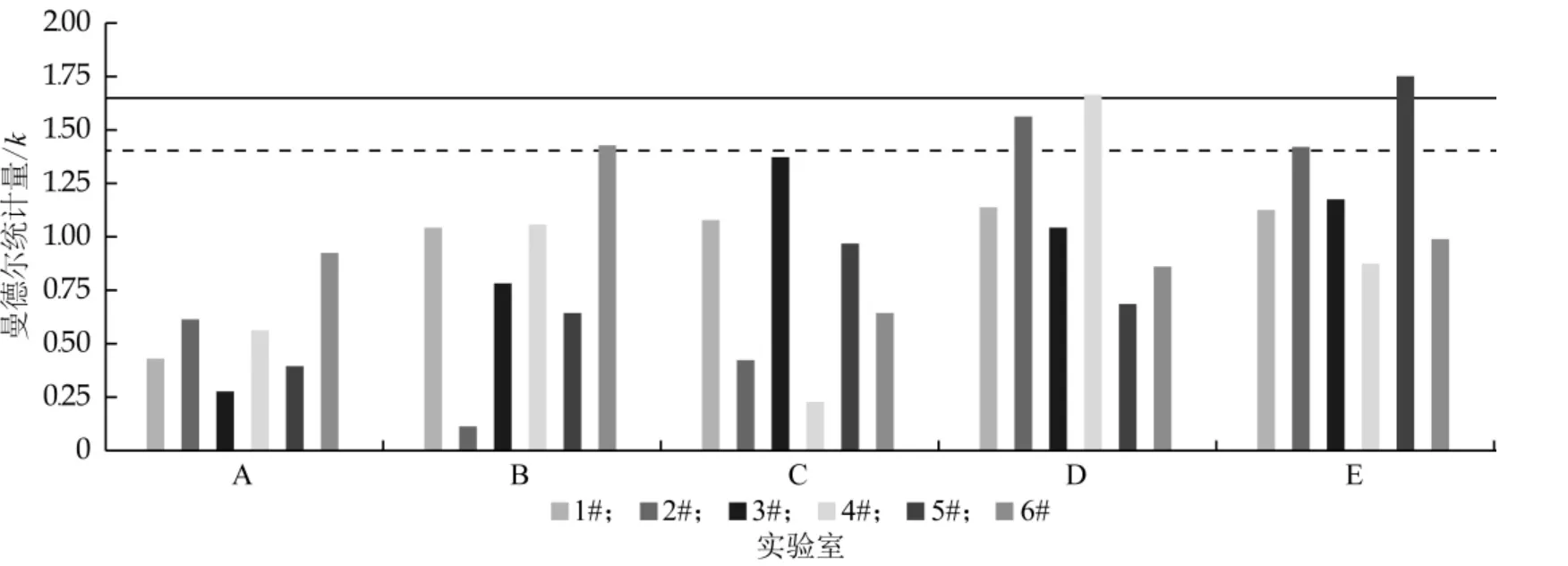
图2 实验室进行分组的实验室间一致性曼德尔统计量
由图2可知, 根据B实验室、第6水平和E实验室第2水平为歧离值;D实验室的第2、4水平为统计离群值;E实验室第5水平为统计离群值。
2.2.2.2 科克伦检验(Cochran离群值检验)
科克伦检验为实验室内变异的检验, 根据表2具体计算公式参照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30], 并根据表3柯克伦检验的临界值进行判定。
由表3可知, D实验室第2、4水平是歧离值;E实验室第5水平是统计离群值, 与曼德尔的k统计量一致。
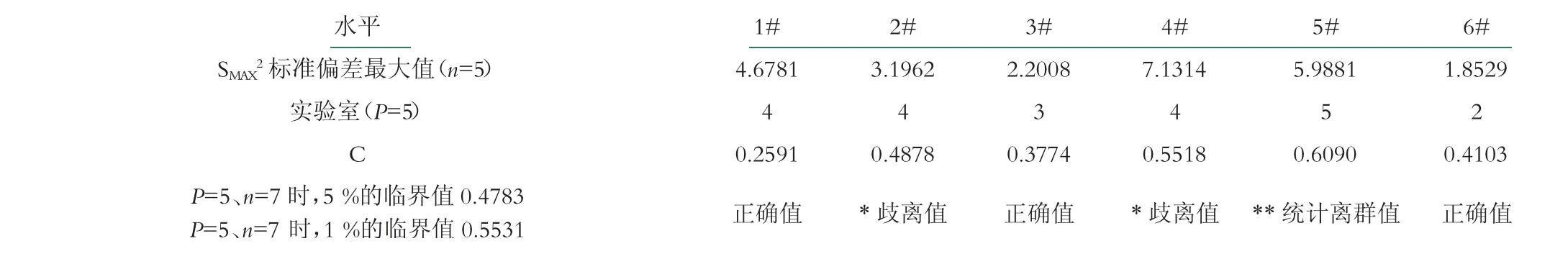
表3 科克伦统计量(C)
2.2.3 格拉布斯检验(Grubbs检验)
根据表2, 当实验室数量为5个时, 具体计算公式参照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30]中格拉布斯检验的临界值如(1)、(2)进行判定:
(1)一个最大(小)值GP(G1):上5 %点的临界值=1.715, 上1 %点的临界值=1.764;
(2)两个最大(小)GP-1,P(G1,2)值:下1 %点的临界值=0.0018, 下5 %点的临界值=0.0090。
2.2.3.1 实验室内部格拉布斯检验
(1)根据表2和表3中的歧离值, D实验室第2水平和D实验室第4水平进行实验室内部格拉布斯检验。
(2)根据表2和曼德尔k统计量中的歧离值, 对B实验室第6水平, E实验室第2水平这两个歧离值进行法格拉布斯检验, 经判定B实验室第6水平7个数据中最大值14.2μg/100 g的离散度和标准偏差大于其他数据, 按标准要求, 予以剔除。E实验室第2水平7个数据都是正确值, 均保留。
2.2.3.2 实验室间的格拉布斯检验
按照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30]中的规定, 科克伦统计量(C)、曼德尔h统计量、曼德尔k统计量中出现的统计离群值, 考虑剔除部分数据或者该实验室全部数据。对歧离值在优化实验的基础上考虑保留或者剔除。
(1)根据表2、曼德尔k统计量中以及表3的统计离群值, 进行第2水平5个实验室进行格拉布斯检验。由2.2.3.1(1)可知, D实验室第2水平7个数据进行实验室内部格拉布斯检验也均为正确值。对D实验室剔除后, 按照其余4个实验室的总平均值升序重新排序B 9.93μg/100 g<A 10.40μg/100 g<C 10.95μg/100 g<E 13.43μg/100 g, 再进行格拉布斯检验。经判定第2水平D实验室所有数据是否剔除, 不影响第2水平的格拉布斯的检验结果, 可以剔除。
(2)根据表2和曼德尔k统计量中的统计离群值, 进行第2水平5个实验室进行格拉布斯检验。由2.2.3.1(2)可知, E实验室第2水平7个数据进行实验室内部格拉布斯检验也均为正确值。对E实验室剔除后, 按照其余4个实验室的总平均值升序重新排序B 9.93μg/100 g<A 10.40μg/100 g<C 10.95μg/100 g<D 14.34μg/100 g, 再进行格拉布斯检验。经判定第2水平E实验室所有数据是否剔除, 不影响第2水平的格拉布斯的检验结果, 可以剔除。
(3)根据表2和曼德尔k统计量中的统计离群值, 进行第2水平5个实验室进行格拉布斯检验。由2.2.3.1可知, 对D、E两个实验室剔除后, 按照其余3个实验室的总平均值升序重新排序B 9.93μg/100 g<A 10.40μg/100 g<C 10.95μg/100 g, 再进行格拉布斯检验。经判定第2水平D、E两个实验室所有数据是否剔除, 不影响第2水平的格拉布斯的检验结果, 可以剔除。但是(1)~(3)是否合理, 还需要进一步验证。
(4)根据表2、曼德尔k统计量中以及表3的统计离群值, 进行第4水平5个实验室进行格拉布斯检验。由2.2.3.1(1)可知, D实验室第4水平7个数据进行实验室内部格拉布斯检验也均为正确值。对D实验室剔除后, 按照其余4个实验室的总平均值升序重新排序E 11.13μg/100 g<B 11.74μg/100 g<A 16.29μg/100 g<C 16.41μg/100 g, 再进行格拉布斯检验。第4水平D实验室所有数据是否剔除, 不影响第4水平的格拉布斯的检验结果, 可以剔除。
(5)根据表2、曼德尔k统计量中以及表3的统计离群值, 对E实验室第5水平, 进行格拉布斯检验, 经判定E实验室第5水平7个数据中最大值26.6μg/100 g的离散度和标准偏差大于其他数据, 按标准要求, 歧离值考虑剔除。
(6)根据表2、曼德尔k统计量中以及表3的统计离群值, 第5水平的E实验室的整组数据需要剔除。但是为了谨慎起见, 先对第5水平的5个实验室分别进行格拉布斯检验, 按照5个实验室的总平均值升序重新排序B 19.23μg/100 g<E 21.68μg/100 g<A 26.43μg/100 g<C 27.93μg/100 g<D 29.94μg/100 g, 经判定5个实验室格拉布斯检验都合格。
(7)根据表2、曼德尔k统计量中以及表3的统计离群值, 对第5水平5个实验室进行格拉布斯检验。由(6)可知, 最大值26.6μg/100 g先考虑剔除, 再参与5个实验室的格拉布斯检验。剔除后的6组数据平均值依然为21.68μg/100 g。将剔除后的数据, 按照5个实验室的总平均值升序重新排序, 发现排序与(2)一致, 再进行格拉布斯检验。E实验室第5水平7个数据的最大值26.6μg/100 g是否剔除, 都不影响格拉布斯检验, 可以剔除。
(8)根据表2和曼德尔k统计量中的统计离群值, 进行第6水平5个实验室进行格拉布斯检验。由2.2.3.2可知, 将剔除后的数据按照5个实验室的总平均值升序重新排序E 10.2μg/100 g<B 11.00μg/100 g<A 13.90μg/100 g<C 15.60μg/100 g<D 20.37μg/100 g, 进行格拉布斯检验, 经判定5个实验室格拉布斯检验都符合条件。
2.2.3.3 5个实验室及6个样品水平的格拉布斯检验结果
根据《表3科克伦统计量(C)》和曼德尔k统计量, 分别对歧离值、统计离群值进行实验室内部、实验室间的格拉布斯检验得出结论, 见表4。

表4 5个实验室及6个样品水平的格拉布斯检验结果
根据表4我们将重新进行曼德尔h统计量、曼德尔k统计量、柯克伦(C)检验, 再次对剔除值、剔除实验室进行判定。
2.2.3.4 曼德尔h统计量再次判定
由于曼德尔h统计量只考查实验室间的一致性, 所以显著水平不用考虑剔除值对其的影响。
(1)当P=5显著水平5 %临界线±1.57, 显著水平1 %临界线±1.72;
(2)当P=4显著水平5 %临界线±1.42, 显著水平1 %临界线±1.49;
(3)当P=3显著水平5 %临界线±1.15, 显著水平1 %临界线±1.15。见表5。

表5 曼德尔的h统计量(实验室间一致性)
由表5可知, 第2水平、第4水平, 按照(2)判定, 均为正确值;其余水平按照(1)判定, 均为正确值。
2.2.3.5 曼德尔k统计量再次判定
由于曼德尔k统计量考查实验室内部的一致性, 所以显著水平不仅要考虑剔除实验室对其的影响, 还要考虑实验数据个数对其的影响。
(1)当P=5, n=7显著水平5 %临界线1.39, 显著水平1 %临界线1.55;
(2)当P=5, n=6显著水平5 %临界线1.42, 显著水平1 %临界线1.59;
(3)当P=4, n=7显著水平5 %临界线1.37, 显著水平1 %临界线1.51;
(4)当P=3, n=7显著水平5 %临界线1.34, 显著水平1 %临界线1.46, 见表6。

表6 曼德尔的k统计量(实验室内部一致性)
由表6可知, 其中第5水平、第6水平, 按照(1)、(2)判定, 其中第2水平、第4水平按照(3)判定, 其中第2水平E实验室为歧离值, 其余均为正确值;其余按照(1)判定, 均为正确值。
2.2.3.6 柯克伦(C)检验再次判定
由于柯克伦(C)检验考查实验室内部的变异, 所以显著水平不仅要考虑剔除实验室对其的影响, 还要考虑实验数据个数对其的影响。
(1)当P=5, n=7显著水平5 %临界线0.4783, 显著水平1 %临界线0.5531;
(2)当P=5, n=6显著水平5 %临界线0.5060, 显著水平1 %临界线0.5880;
(3)当P=4, n=7显著水平5 %临界线0.5598, 显著水平1 %临界线0.6410;
(4)当P=3, n=7显著水平5 %临界线0.6771, 显著水平1 %临界线0.7606, 见表7。
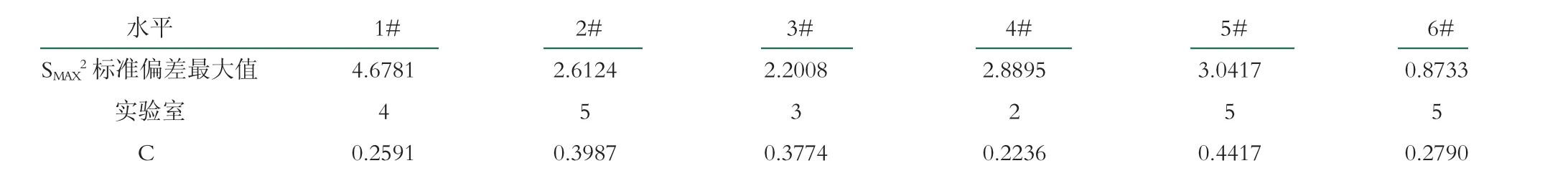
表7 科克伦统计量(C)
由表7可知, 第5水平、第6水平, 按照(1)、(2)判定, 均为正确值;第2水平、第4水平按照(3)判定, 均为正确值;其余按照(1)判定, 均为正确值。
由2.2.3.4~2.2.3.6可知, 曼德尔h统计量、曼德尔k统计量、柯克伦(C)检验完全验证了之前的格拉布斯检验对5个实验室、6个样品水平的数据剔除、实验室剔除的正确性。我们只需再对曼德尔k统计量中其中第2水平E实验室这个歧离值, 进行实验室内部、实验室间的格拉布斯检验, 就可以知道这两个值是否进行取舍。
2.2.3.7 对曼德尔k统计量再次判定的歧离值进行格拉布斯检验
对第2水平E实验室进行实验室内部和实验室间的格拉布斯检验。根据2.2.3.2(1)~(3)可知, 第2水平剔除E实验室后, 不影响其格拉布斯检验结果, 但是是否剔除E实验室, 还要根据最后的重复性方差和再现性方差决定。
2.3 总平均值和方差Srj、SRj的计算[30]
具体计算公式参照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30]计算出总平均值和方差Srj、SRj。由2.2.3.3~2.2.3.6可知, 进行未剔除第2水平D实验室和第4水平E实验室和剔除第2水平D实验室和第4水平E实验室的总平均值和标准差Srj、SRj的比较。见表8和表9。
由表8可知, 当第2水平未剔除E实验室时, 重复性标准差Srj=5.4956, 再现性标准差SRj=5.4965。
表8 未剔除第2水平E实验室的总平均值和标准差Srj、SRj

表8 未剔除第2水平E实验室的总平均值和标准差Srj、SRj
项目(μg/100 g) 1# 2# 3# 4# 5# 6#总平均值images/BZ_54_1552_442_1584_472.png 25.32 11.18 15.32 13.89 25.04 14.21重复性方差S2rj 130.0011 30.2013 41.9920 52.1229 1.3197 0.6316再现性方S2Rj=S2rj+S2Lj 130.0303 30.2113 41.9341 52.0963 2.5585 1.6698 Srj 11.4018 5.4956 6.4801 7.2196 1.1488 0.7947 SRj=(S2rj+S2Lj)1/2 11.4031 5.4965 6.4757 7.2178 1.5995 1.2922
由2.2.3.7可知, 再计算剔除第2水平E实验室的总平均值, 见表9。
表9 剔除第2水平E实验室后的总平均值和标准差Srj、SRj

表9 剔除第2水平E实验室后的总平均值和标准差Srj、SRj
项目(μg/100 g) 1# 2# 3# 4# 5# 6#总平均值images/BZ_54_1552_442_1584_472.png 25.32 10.43 15.32 13.89 25.04 14.21重复性方差S2rj 130.0011 8.9198 41.9920 52.1229 1.3197 0.6316再现性方S2Rj=S2rj+S2Lj 130.0303 8.8997 41.9341 52.0963 2.5585 1.6698 Srj 11.4018 2.9866 6.4801 7.2196 1.1488 0.7947 SRj=(S2rj+S2Lj)1/2 11.4031 2.9832 6.4757 7.2178 1.5995 1.2922
由表9可知, 当第2水平剔除E实验室时, 重复性标准差Srj=2.9866, 再现性标准差SRj=2.9832。第2水平E水平剔除歧离实验室后的重复性标准差和再现性标准差明显小于未剔除前, 即第4水平剔除E实验室全部数据。
根据2.2~2.3可知, 我们对5个实验室对6个样品水平的实验数据进行取舍, 最后得出如下的结论, 见表10。

表10 5个实验室及6个样品水平实验数据进行取舍的最后结果
2.4 精密度值(重复性和再现性)和平均水平之间的函数关系的建立
表11 总平均值升序排列
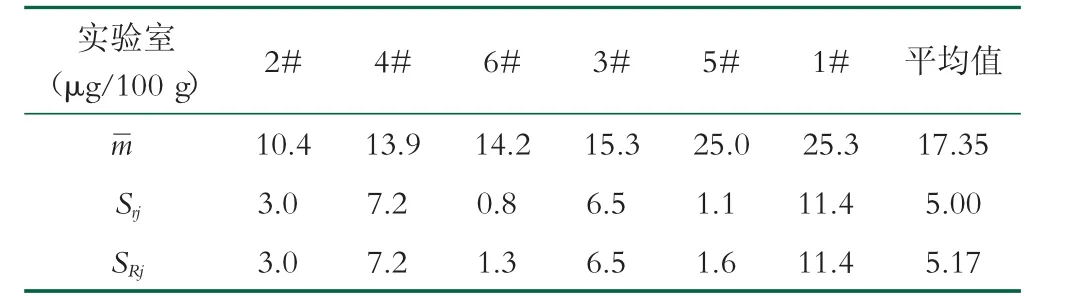
表11 总平均值升序排列
实验室(μg/100 g)2# 4# 6# 3# 5# 1# 平均值images/BZ_54_1552_442_1584_472.png 10.4 13.9 14.2 15.3 25.0 25.3 17.35 Srj 3.0 7.2 0.8 6.5 1.1 11.4 5.00 SRj 3.0 7.2 1.3 6.5 1.6 11.4 5.17
由表11可知, 具体公式以及判定参照GB/T 6379.2-2004《测量方法与结果的准确度(正确度与精密度)第2部分:确定标准测量方法重复性与再现性的基本方法》[30], 对重复性标准差Srj和再现性标准差SRj考虑以下3种类型的关系式:
(1)关系式Ⅰ:s=bm(通过原点的直线);
(2)关系式Ⅱ:s=a+bm(截距为正的直线);
关系式Ⅲ:lgs=c+dlgm(或s=Cmd), d≤1(指数关系), 见表12。
由表12可知, 根据相关系数R2判定, 关系式关系式Ⅰ和关系式Ⅱ最好。但是根据变异系数(100 S/m)%是一个常数的要求, 关系式Ⅰ:重复性标准差Srj=30%和再现性标准差SRj=31%。当min=10.4μg/100g和max=25.3μg/100g时, 关系式Ⅱ:重复性标准差Srjmin=112.9 %、Srjmax=117.08%和再现性标准差SRjmin=150.52%、SRjmax=169.89%, 显然不理想。所以关系式Ⅰ:重复性标准差Srj=30 m和再现性标准差SRj=31 m最好。
表12 精密度值(重复性和再现性)和平均水平之间的函数关系

表12 精密度值(重复性和再现性)和平均水平之间的函数关系
关系式 Ⅰ Ⅱ ⅢSrj SRj Srj=0.30m相关系数R2=1.0000 SRj=0.31m相关系数R2=1.0000 Srj=1.1+0.0028m相关系数R2=1.0000 SRj=1.37+0.013m相关系数R2=1.0000 lgSrjj=0.28-0.086gm(或Srj=0.28m-0.086)相关系数R2=0.9999 lgSRj=0.31+0.14gm(或SRj=0.31m0.14)相关系数R2=0.9930
3 结论
3.1 婴幼儿配方食品中生物素提取条件的确定
0.5、1 、3 mol/L 3种硫酸溶液处理后的1#样品颜色深浅为0.5 mol/L<1 mol/L<3 mol/L, 颜色逐渐加深, 并且样品都能过滤且正常, 可见这3个浓度的硫酸溶液都可以使用。对于1#婴幼儿配方粉(质控样品), 生物素标准值为28.0μg/100 g。用0.5 mol/L硫酸溶液进行121℃下水解30 min前处理后, 两次测出的结果分别为28.2μg/100g、28.7μg/100g。通过实验可以看出随着硫酸溶液的浓度提高, 生物素的含量下降, 所以婴幼儿配方食品用0.5 mol/L硫酸溶液进行前处理。

