驴乳粉修复皮肤屏障作用研究及安全性评价
樊雨梅, 赵海晴, 帖航, 苏宁, 廖峰
(1.国家胶类中药工程技术研究中心, 东阿阿胶股份有限公司, 山东 东阿, 252201;2.中国检验检疫科学研究院, 北京 100176)
0 引言
皮肤作为人体最大的屏障, 能够保护人体免受环境伤害和维持人体内环境稳态。皮肤屏障功能受损, 皮肤会出现潮红、丘疹、鳞屑、瘙痒和刺痛。许多皮肤疾病都与皮肤屏障功能受损密切相关, 比如湿疹[1]、特应性皮炎[2]、银屑病[3]、痤疮[4]、黄褐斑[5]等。因此, 皮肤屏障功能的修复对缓解皮肤干燥、炎症、预防和治疗皮肤疾病有着重要的意义。
乳及乳制品有修复皮肤屏障的作用。研究表明, 乳及乳制品能够改善湿疹[6]、尿布皮炎[7]、银屑病斑块[8]、皮肤屏障损伤[9]、红斑和脂溢性痤疮[10]等。由于牛乳蛋白易引起过敏反应, 限制了牛乳在皮肤修复中的应用。驴乳因营养成分与母乳类似、致敏性低[11], 驴乳的皮肤生理活性研究成为了研究热点。Kocic[12]等研究发现, 驴乳在伤口愈合、皮肤再生方面有着重要的作用。包裹脱脂驴乳的纳米面霜也具有显著的瞬时和长效保湿的效果[13]。然而到目前为止, 关于驴乳皮肤用安全性的相关研究还少有报道。因此, 本研究在系统评价驴乳外用安全性的基础上, 通过3D皮肤模型对驴乳修复皮肤屏障的功能进行评价, 以期为驴乳在修复皮肤屏障的应用和安全性提供一定的科学依据。
1 材料与方法
1.1 材料与试剂
驴乳粉(批号:20190102)由东阿阿胶股份有限公司提供;永生化人角质形成细胞(HaCaT), 协和细胞库3111C0001CCC000373;人 皮 肤 成 纤 维 细 胞(NHDFs), ATCC PCS-201-010;Balb/c小鼠成纤维细胞系(3T3), ATCC CRL-6587;人3D表皮皮肤模型(EpiKutis, 批号:ES181003)、人角质形成细胞(KC细胞, 批号:PC2011), 广州博溪生物科技有限公司;SPF鸡胚, 勃林格殷格翰维通, 生产许可证SCXK(京)2014-0002。
DMEM培养基、胎牛血清(FBS)、0.25%胰蛋白酶/EDTA、青霉素/链霉素, Gibco公司;FM培养基, Sciencell公司;EpiRecovery培养基、EpiGrowth培养基, 广州博溪生物科技有限公司;中性红, 索莱宝生物科技有限公司;十二烷基硫酸钠(SLS, ω≥98.5%)、地塞米松(ω≥97%), Sigma-Aldrich公司;CCK-8试剂盒, 碧云天生物科技有限公司;人IL-6 ELISA试剂盒、人IL-8 ELISA试剂盒, NOVUS公司;IL-1α试剂盒, Abcam公司。
1.2 仪器
371二氧化碳培养箱, Agilent公司;MULTISKAN GO酶标仪, Thermo公司。
1.3 方法
1.3.1 样品前处理
精密称取驴乳粉样品5.0000 g, 加入40 mL热超纯水, 涡旋振荡至完全溶解, 漩涡振荡至完全溶解后, 加超纯水补足至50 g, 4 000 r/min离心30 min, 取上清溶液, 即为10%(w/w)驴乳溶液。
1.3.2 安全性分析
细胞毒性评估[14]。采用人表皮层细胞HaCaT和人真皮层细胞NHDFs评价驴乳粉对人皮肤细胞的毒性作用。将正常培养稳定的HaCaT细胞和NHDFs细胞分别以1×105/mL和6×104/mL的密度铺板于96孔板, 培养24 h形成单层细胞后, 分别加入10%、5%、2.5%、1.25%、0.63%、0.31%、0.16%和0.08%浓度梯度的驴乳溶液继续培养24 h和48 h。按照CCK-8试剂盒的检测方法测定细胞相对活性, 以不含驴乳粉的培养基处理的细胞作为阴性对照。细胞相对活性采用下面进行计算。当相对细胞活性≥80%, 认为受试物在该浓度下无细胞毒性。
细胞相对活性(%)=(实验组OD值-空白组OD值)/(阴性对照组OD值-空白对照组OD值)×100%
促表皮细胞炎症反应检测。将正常培养稳定的HaCaT细胞/KC细胞以1×105/mL的密度铺板于12孔板, 培养24 h形成单层细胞后, 加入1%驴乳溶液继续培养48 h。利用试剂盒检测HaCaT细胞IL-6、IL-8和PEG2的分泌情况, 以不含驴乳粉的培养基处理的细胞作为阴性对照。
光毒性评估参考《化妆品安全技术规范(2015年版)》的《化妆品用化学原料体外3T3中性红摄取光毒性试验方法》进行检测[15]。眼刺激/腐蚀性评估参照SN/T2329-2009《化妆品眼刺激性/腐蚀性的鸡胚绒毛尿囊膜试验》规定的方法进行测定[16]。皮肤刺激性/腐蚀性利用SN/T 4577-2016《化妆品皮肤刺激性检测重建人表皮模型体外测试方法》进行检测[17]。
1.3.3 皮肤屏障修复效果评价[18]
将复苏好的人3D表皮模型转移至含有0.9 mL EpiGrowth培养液的6孔板中, 吸取2倍检测浓度的驴乳粉溶液与4 mg/mL的SLS溶液等体积混合, 将SLS-驴乳粉溶液混合液25μL缓慢滴加于模型表面。以未处理的模型作为阴性对照, 以2 mg/mL的SLS作为模型对照, 以SLS-地塞米松混合液作为阳性对照, 每组9个平行。给药结束后在培养箱(37℃, 5% CO2)中培养24 h。使用装有无菌PBS的洗瓶清洗每个模型15次, 然后使用1%的TritonX-100溶液分别刺激0、1、3 h, 每个时间点3个模型。刺激结束后清洗模型15次, 使用MTT法, 以阴性对照组刺激0 h的存活率为100%, 以异丙醇作为空白对照, 以吸光值作为检测指标按照下面公式计算驴乳粉处理后模型的组织存活率。同一实验分组内, 取组织活力为50%左右的两个时间点数据进行绘图, 计算直线回归方程, 根据回归方程计算组织活力为50%的时间, 即为屏障指数(ET50)。ET50大于模型对照组ET50的样品, 具有屏障修复效果。

1.3.4 抗刺激效果评价[19]
将复苏好的模型转移至含有0.9 mL EpiGrowth培养基的6孔板中, 吸取2倍检测浓度的驴乳粉溶液与4 mg/mL的SLS溶液等体积混合, 将SLS-驴乳粉溶液混合液25μL缓慢滴加于模型表面, 以未处理的模型作为阴性对照, 以2 mg/mL的SLS作为模型对照, 以SLS-地塞米松混合液作为阳性对照, 每组9个平行。给药结束后在培养箱(37℃, 5% CO2)中培养24 h。收集模型培养液, 使用ELISA法检测并计算模型IL-1α含量。
1.3.5 数据处理与统计分析
所有的数据均用均值±SD表示。采用统计软件SPSS 21.0对数据进行分析处理, 组间比较采用单因素方差分析, 设定检验的显著性水平为P<0.05。
2 结果与分析
2.1 驴乳粉安全性分析
2.1.1 细胞毒性检测结果
不同浓度的驴乳粉对HaCaT及NHDFs细胞毒性检测结果如图1所示。与对照组相比, 10%以下的驴乳粉对HaCaT细胞和NHDFs细胞均无细胞毒性(P>0.05)。浓度范围为0.08%~10%的驴乳粉有促进HaCaT细胞和NHDFs细胞增殖的作用。
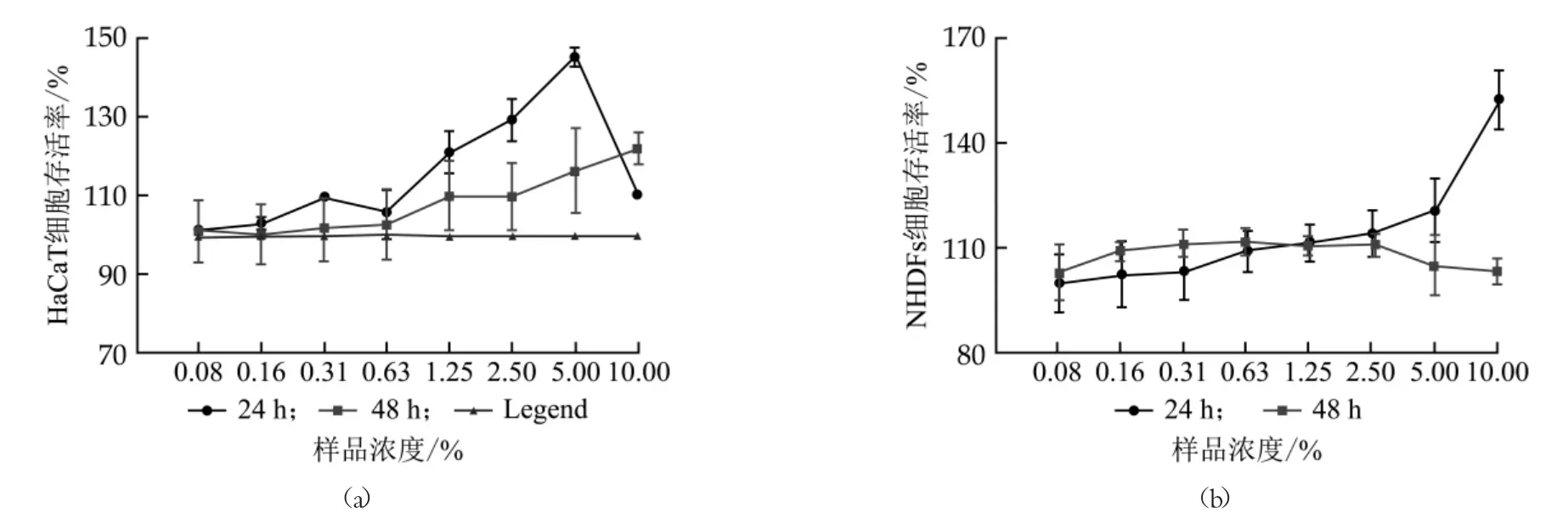
图1 驴乳粉对HaCaT、NHDFs细胞的细胞毒性作用
2.1.2 促表皮细胞炎症反应检测结果
使用角质形成细胞对驴乳粉进行皮肤早期炎症因子IL-6和IL-8, 以及中期炎症因子PEG2的诱导表达情况检测, 结果见表1。与空白对照组相比, 1%驴乳粉溶液诱导角质形成细胞的IL-6、IL-8和PEG2的表达量下降, 差异不具有统计学意义。可见, 驴乳粉不会引起表皮细胞炎性因子上升。Kocic[12]等也报道驴乳能够显著下调核因子-κB/p65(nuclear factor of kappa B, NF-κB)蛋白的表达, 发挥抗炎作用。

表1 驴乳粉促表皮细胞炎症因子表达情况
2.1.3 体外3T3细胞中性红摄取光毒性试验结果
采用体外3T3细胞评价驴乳粉对中性红摄取光毒性的影响, 见表2。依据标准, 化妆品原料的光毒性可通过光刺激因子(PIF)和平均光效应(MPE)预测模型进行预测。由PIF预测模型可知, 驴乳粉在浓度10%及以下, 可得到PIF=*1, 推测驴乳粉无潜在光毒性。而由MPE预测模型可知, 驴乳粉MPE在0.1~0.15之间, 可能具有光毒性。两种预测模型得出的结果不同, 可能与驴奶粉加工过程中引入的干扰物有关, 需进一步研究, 比如驴乳粉皮肤吸收性和累积的可能性。

表2 驴乳粉光毒性数据
2.1.4 鸡胚绒毛尿囊膜眼刺激/腐蚀性评价结果
采用HET-CAM(鸡胚绒毛尿囊膜实验)终点法对驴乳粉进行眼刺激性/腐蚀性毒性预测, 受试物ES(Effective Score, 刺激分数)≤12, 为无/轻刺激性;12<受试物ES<16, 为重度刺激性;受试物ES≥16, 为强刺激性/腐蚀性。结果显示, 驴乳粉ES评分为0, 表明驴乳粉对眼部为“无/轻刺激性”。图2为相应的眼刺激鸡胚尿囊膜图片。

图2 驴乳粉对鸡胚尿囊膜的影响
2.1.5体外皮肤刺激性3D皮肤模型试验
采用3D皮肤模型法预测驴乳粉对人皮肤刺激性的效应, 见表3。驴乳粉处理后的皮肤模型相对组织活性为128.79%, SD值为1.47, 可见驴乳粉不具有皮肤刺激性。

表3 3D皮肤模型刺激性结果
2.2 驴乳修复皮肤屏障效果评价
2.2.1 屏障修复效果评价结果
为探究驴乳粉对受损皮肤屏障的修复作用, 利用MTT法测定驴乳粉保护SLS-EpiKutis损伤模型在1%TritonX-100不同作用时间下的相对组织活力, 并计算屏障指数(ET50), 见表4。实验结果表明, 2%驴乳粉和地塞米松作用后, SLS-EpiKutis损伤模型的ET50分别从12.21 min延长至29.92 min和26.44 min。可见, 驴乳粉能够有效促进皮肤屏障修复, 效果优于阳性对照地塞米松。

表4 SLS-EpiKutis损伤模型ET50结果
2.2.2 抗刺激效果评价结果
IL-1α主要由巨噬细胞、角质形成细胞、单核细胞等分泌, 能够参与炎症反应的发生, 也可促进成纤维细胞的增殖[20]。低浓度的SLS作用于角质层, 可导致皮肤屏障功能受损, 并释放IL-1α等炎性因子介导皮肤炎症反应[21-22]。实验结果表明, 使用SLS损伤EpiKutis后, IL-1α含量显著升高, 明显高于未损伤组, 这与喻欢[19]和Falcone[23]报道一致。与模型组相比, 地塞米松和2%驴乳粉作用后, SLS-EpiKutis损伤模型的IL-1α均下降, 从323.95±20.92ρg/mL分别下降到229.73±18.76ρg/mL和210.12±19.62ρg/mL, 差异均具有统计学意义(P<0.01)。地塞米松与2%驴乳粉的作用效果, 差异不具有统计学意义(P>0.05)。可见, 驴乳粉对SLS-EpiKutis损伤模型的IL-1α合成具有抑制作用, 与地塞米松效果类似。

表5 SLS-EpiKutis损伤模型IL-1α含量检测结果
3 结论
本研究对驴乳粉的安全性和修复皮肤屏障效果进行了初步研究。通过对驴乳粉进行系统性的体外化妆品毒理学评估发现, 驴乳粉无表皮细胞致炎性、眼刺激性/腐蚀性、皮肤刺激性和细胞毒性, 但两种光毒性预判模型对驴乳粉的光毒性判定不一致, 需做进一步的研究。浓度范围在0.08%~10%的驴乳粉对HaCaT细胞和NHDFs细胞有促增值作用。此外, 利用3D皮肤模型评价驴乳粉修复皮肤屏障的效果, 研究结果显示, 2%驴乳粉能够修复皮肤屏障, 使刺激物屏障弱化模型的ET50从12.21 min延长至29.92 min, 效果优于地塞米松;2%驴乳粉对SLS-EpiKutis损伤模型的IL-1α合成具有抑制作用, IL-1α水平从323.95±20.92 ρg/mL下降到210.12±19.62ρg/mL, 与地塞米松的效果类似。本研究对驴乳粉进行了较为系统的化妆品安全性和皮肤屏障修复效果评价, 为驴乳粉开发提供了基础的毒理学数据和科学依据。

