FLCN通过AMPK-mTOR信号轴调节奶牛乳腺上皮细胞能量代谢
张 娜,符海鑫,曹 慧,王伟华
(东北农业大学乳品科学教育部重点实验室,哈尔滨 150030)
乳腺是哺乳动物特有哺育后代的功能器官,奶牛乳腺发育及泌乳需充足能量供应,能量供应不足导致乳品质降低,因此能量代谢对乳腺组织发育和泌乳至关重要[1]。
AMPK是哺乳动物细胞中高度保守的丝氨酸/苏氨酸蛋白激酶,参与细胞代谢和能量调节。葡萄糖供应减少等应激条件可激活AMPK[2]。AICAR等激活剂可激活AMPK,天然小分子化合物CompoundC可抑制AMPK[3]。AMPK是所有真核生 物 细胞能量状态传感器,也在维持上皮细胞连接中发挥重要作用[4]。AMPK参与乳腺上皮细胞能量代谢调节。AMPK调控主要下游信号通路是mTOR信号通路。mTOR是一类丝/苏氨酸蛋白激酶,在进化中高度保守,mTOR在各种生物细胞中广泛存在,且分布于胞浆中。当AMPK被激活时,mTOR活性被抑制。mTOR信号通路在细胞中发挥重要作用,主要有控制蛋白质合成、细胞增殖和代谢[5]。
FLCN有两种相互作用蛋白,相互作用蛋白1(FNIP1)和FLCN同源蛋白2(FNIP2/FNIPL)[6]。Takagi等证实AMPK与FNIP1相互作用,AMPK导致FNIP1和FLCN磷 酸 化[7]。研 究 表 明,FLCN可 与FNIP1/FNIP2和AMPK形成复合物[8]。Yan等在对秀丽隐杆线虫研究中发现FLCN敲除可增加AMPK活性[9]。Possik等在小鼠肾脏和肌肉研究中发现,FLCN敲除导致AMPK表达增加[10]。此外,Collodet等在对小鼠胚胎成纤维细胞和肿瘤细胞系研究中发现FLCN敲除可激活AMPK[11]。以上结果提示FLCN是AMPK通路负调控因子。Wada等最新研究证实FLCN可调控mTOR信号通路[12]。Hartman等在人类胶质瘤细胞中证实,FLCN敲除导致S6K磷酸化水平降低[13],此结果提示FLCN是mTOR通路正调控因子。FLCN在奶牛乳腺上皮细胞中如何调控AMPK信号通路和mTOR信号通路尚未阐明。FLCN在奶牛乳腺上皮细胞中研究较少,其作用分子机制尚不清楚。本研究通过干扰和过表达FLCN,检测下游蛋白表达情况,探讨FLCN在奶牛乳腺上皮细胞中功能,丰富乳腺上皮细胞代谢及泌乳调节网络,为进一步提高乳品质提供理论基础。
1 材料与方法
1.1 材料与试剂
本试验所用细胞均为乳品科学教育部重点实验室前期保存的荷斯坦奶牛乳腺上皮细胞[14]。AMPKα抗体、Phospho-AMPKα抗体(购自美国Cell Signaling Technology公司),FNIP1抗体(购自Abcam公司),β-actin、mTOR抗体、p-mTOR抗体、兔IgG/FITC、caspase3抗体(购自北京博奥森生物技术有限公司),胎牛血清(FBS)、DMEM/F12(购自美国GIBCO公司),Lip 2000试剂、Trizol(购自美国Invitrogen公司),HRP辣根酶标记山羊抗兔IgG二抗、ECL发光检测试剂(购自北京兰杰柯科技有限公司)。
1.2 细胞培养
奶牛乳腺上皮细胞(BMECs)分离自荷斯坦奶牛乳腺组织。奶牛乳腺上皮细胞在DMEM/F12中添加10%胎牛血清和两种抗生素(青霉素10 mg·L-1,链霉素10 mg·L-1)中培养。细胞在DMEM/F12培养液中培养24 h,然后处理。以AMPK激活剂AICAR(0.5 mmol·L-1)和抑制剂Compound C(20μm·L-1)作用BMECs 60 min,D-Hanks盐溶液作为对照。葡萄糖饥饿时,磷酸盐缓冲液洗涤细胞两次,然后在不含葡萄糖和丙酮酸的DMEM培养液中孵育。以DMEM/F12全培养基作为对照。
1.3 免疫荧光试验
冷冻切片机打开至-20℃,将冷冻的各时期组织取出,修剪为1 cm3块状,包埋,冷冻切片,厚度约为8μm。将组织切片用4%多聚甲醛溶液固定,去除4%多聚甲醛并用含有0.1%吐温的磷酸盐缓冲液清洗,封片剂在室温封片1 h。FLCN一抗在4℃条件下封闭组织12 h,磷酸盐缓冲液清洗3次后用FITC标记的山羊抗兔二抗37℃避光孵育1 h,弃二抗后清洗3次,用含有DAPI抗荧光淬灭剂滴加至组织切片上,激光共聚焦观察组织切片。
1.4 免疫共沉淀
弃掉细胞培养瓶中培养液,磷酸盐缓冲液清洗3次,细胞刮刀将含有RIPA裂解液的细胞刮下。细胞裂解液在4℃摇晃60 min,14 000 g离心5 min,以清除细胞碎片等。含等量蛋白(200μg)裂解液分别用FLCN和IgG抗体在4℃下孵育过夜,用protein A+G琼脂糖凝珠在4℃下孵育3 h。用裂解缓冲液洗涤3次。回收在SDS样品缓冲液中相关蛋白复合物并进行后续Western blot试验。
1.5 Western blot
将细胞用细胞裂解液刮下,14 000 g离心5 min,加入5×上样缓冲液,95℃下煮15 min备用。取200μg蛋白电泳,电泳后将凝胶转移至NC膜上,脱脂牛奶封闭2.5 h后,一抗过夜孵育,用TBST洗膜3次后,37℃孵育二抗1 h,清洗后在NC膜上滴加发光液,在化学发光成像仪中显影。
1.6 统计分析
所有数值均表示为平均值±标准误差。定量数据通过对数变换归一化,并使用SPSS 16.0软件进行One Way ANOVA对组间均值作统计学比较。其中“*”表示P<0.05,差异显著;P<0.05被认为具有统计学意义。
2 结果与分析
2.1 FLCN在牛乳腺中免疫组织学定位
为探究FLCN在奶牛乳腺组织青春期、泌乳期、干奶期的表达情况,本试验采用免疫荧光检测方法,分析青春期、泌乳期、干奶期奶牛乳腺组织中FLCN表达情况。DAPI标记细胞核,异硫氰酸荧光素(FITC)标记FLCN。激光共聚焦结果显示,FLCN蛋白在乳腺导管上皮细胞表达,由图1可知,青春期(图1B)和泌乳期(图1D)绿色荧光信号多于干奶期(图1F)。由此得出结论,FLCN在青春期和泌乳期表达量高于干奶期。说明FLCN可能参与乳腺发育和泌乳。
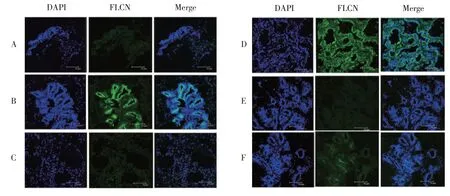
图1 FLCN在奶牛乳腺发育各时期定位Fig.1 Location of FLCN in mammary gland development of dairy cows
2.2 FLCN通过FNIP1与AMPK结合
为证实AMPK与FLCN、FNIP1作用,采用AMPK、FNIP1特异性抗体及同源IgG抗体进行免疫共沉淀,Western blot检测沉淀中AMPK、FLCN、FNIP1蛋白表达情况。制备AMPK抗体(AMPK组)和兔IgG抗体(IgG组)样品,采用SDSPAGE电泳分离,质谱检测。SDS-PAGE电泳结果表明,不同分子质量蛋白均较好分离。与对照组相比,免疫共沉淀组在63和135 ku处出现不同靶条带(见图2),根据蛋白量推测蛋白可能是FLCN和FNIP1。用AMPK抗体进行Co-IP试验,细胞全蛋白Input组和IP组检测到FLCN和FNIP1;以FNIP1抗体进行Co-IP实验,细胞全蛋白Input组和IP组检测到AMPK和FLCN。Co-IP结果显示AMPK与FLCN和FNIP1之间有特异性结合,证明AMPK与FLCN和FNIP1有相互作用。

图2 SDS电泳结果Fig.2 Result of SDS electrophoresis
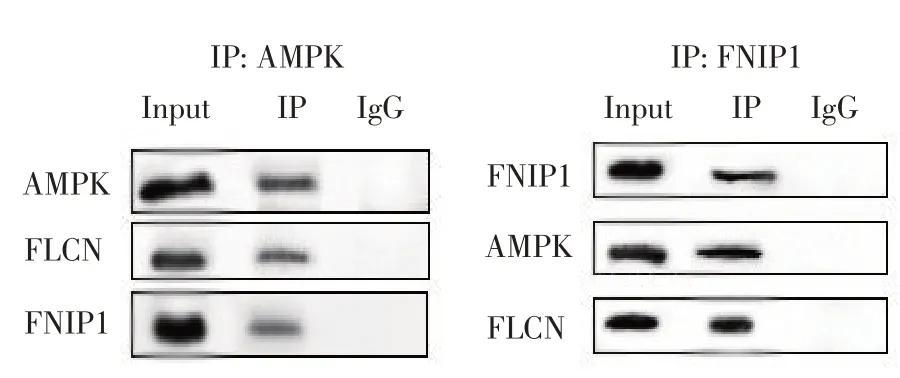
图3 IP组为AMPK和FNIP1时检测AMPK、FLCN、FNIP1蛋白Fig.3 AMPK,FLCN and FNIP1 proteins were detected when THE IP group was AMPK and FNIP1
2.3 FLCN干扰对AMPK/mTOR信号通路的影响
为进一步验证FLCN对AMPK的调节作用,将试验分为阴性对照组(NC)、FLCN干扰组(KD)、添加AMPK激活剂组(AICAR)、FLCN干扰同时添加AMPK激活剂组(AICAR-siFLCN)、添加AMPK抑制剂组(Compound C)、FLCN干扰同时添加AMPK抑制剂组(Compound C-siFLCN)。常规转染48 h后,更换培养基,分别加入AMPK激活剂阿卡地新(Acadesine,AICAR)和抑制剂化合物C(Compound C),培养后收集蛋白样品。Western blot检测FLCN、AMPK、p-AMPK、mTOR、p-mTOR、CyclinD1和β-酪蛋白(CSN2)的表达。如图4所示,当沉默FLCN,AMPK、p-AMPK表达升高,FLCN、mTOR、p-mTOR、CyclinD1和CSN2表达降低。说明FLCN负调控AMPK,正调控mTOR,促进细胞增值殖和乳蛋白合成。在沉默FLCN的同时,添加AMPK激活剂结果显示,AMPK、p-AMPK表达升高,FLCN、mTOR、p-mTOR、CyclinD1和CSN2表达降低。在沉默FLCN的同时,添加AMPK抑制剂结果显示,FLCN、AMPK、p-AMPK表达升高,p-mTOR表达降低。综上,FLCN负调控AMPK,正调控mTOR,AMPK正调控FLCN。

图4 FLCN干扰分别与AICAR和Compound C共同处理时相关蛋白表达及灰度扫描分析Fig.4 Related protein expression and gray scan analysis when FLCN interference was co-processed with AICAR and Compound C
2.4 FLCN过表达对AMPK/mTOR信号通路的影响
试验分为空载体组(EV)、FLCN过表达组(FLCN OE)、添加AMPK激活剂组(AICAR-EV)、FLCN过表达同时添加AMPK激活剂组(AICAROE)、添加AMPK抑制剂组(Compound C-EV)、FLCN过表达同时添加AMPK抑制剂组(Compound C-OE)。常规转染48h后,更换培养基,加入AMPK激活剂(AICAR)和抑制剂(Compound C),收集蛋白样品。Western blot检测FLCN、AMPK、p-AMPK、mTOR、p-mTOR、CyclinD1和CSN2变化情况。如图所示,当FLCN过表达时,与对照组相比,AMPK、p-AMPK表达降低,FLCN、mTOR、p-mTOR、CyclinD1和CSN2表达升高。当加入AMPK激活剂时,FLCN、AMPK、p-AMPK表达升高,p-mTOR表达降低。当加入AMPK抑制剂时,FLCN、AMPK、p-AMPK表达降低,p-mTOR表达升高。根据FLCN过表达及FLCN过表达与AMPK激活抑制剂联合处理结果,可得出FLCN负调控AMPK,正调控mTOR,AMPK正调控FLCN,负调控mTOR。AMPK与FLCN形成负反馈关系。
2.5 FLCN-AMPK信号通路调节乳腺上皮细胞的能量代谢
无糖处理培养后收集细胞,提取细胞总蛋白。Western blot检测AMPK和FLCN蛋白表达。与对照组相比,无糖组培养后AMPK和FLCN蛋白表达量显著增加。试验分为空白对照组(Blank)和无糖处理组(Glucose free)。当细胞达到瓶底70%~80%时,更换无糖培养基,继续培养1 h后,收集细胞样本。Western blot检测FLCN、AMPK、p-AMPK、mTOR、p-mTOR、CyclinD1、p-ACC和CSN2。与对照组相比,经过无糖处理后,FLCN、AMPK、p-AMPK蛋白表达显著升高,mTOR、pmTOR、CyclinD1、CSN2和p-ACC表达降低。

图5 FLCN过表达分别与AICAR和Compound C共同处理时相关蛋白表达及灰度扫描分析Fig.5 Expression of related proteins and gray scan analysis when FLCN overexpression was co-processed with AICAR and Compound C

图6 无糖处理后乳蛋白合成和细胞增殖相关蛋白表达及灰度分析Fig.6 Milk protein synthesis and expression of cell proliferation-related proteins and gray scale analysis after glucose-free treatment
3 讨论
FLCN分子质量为64 ku,编码579个氨基酸,具有肿瘤抑制功能。FLCN在不同物种中均为高度保守蛋白。目前已知FLCN参与多种代谢途径和细胞过程的调控,并在肾脏、乳腺等组织中表达[15]。但目前FLCN在奶牛乳腺上皮细胞中研究较少。
免疫荧光结果显示FLCN在乳腺上皮细胞的细胞质中表达。Laviolette等研究表明FLCN在溶酶体表达[16]与本试验结果一致。本试验结果还表明,FLCN在青春期和泌乳期高表达,干奶期低表达。哺乳动物乳腺呈动态性变化,主要过程包括青春期、妊娠期、泌乳期和干奶期。青春期,乳腺组织发育和代谢缓慢,主要由不规则脂肪和结缔组织构成。泌乳期时,上皮细胞开始增殖和分化,合成乳糖和乳脂所需酶开始出现;泌乳开始后,光镜下可见小叶内充满含乳汁的腺泡,小叶内导管较明显。FLCN在青春期和泌乳期高表达说明其功能可能与乳腺组织发育及泌乳相关。
为进一步探讨FLCN在奶牛乳腺上皮细胞中作用,本研究通过免疫共沉淀试验检测与FLCN相互作用的蛋白,结果显示AMPK抗体沉淀产物中检测到FNIP1和FLCN,FNIP1抗体沉淀产物中检测到AMPK和FLCN。这与Baba等研究发现FLCN及其结合蛋白FNIP1与AMPK相互作用[6],Reyes等研究发现FNIP1与AMPK存在相互作用[17]结果相同,表明FLCN、FNIP1和AMPK存在相互作用。FLCN可能是通过AMPK信号通路在奶牛乳腺上皮细胞中发挥作用。
为明确FLCN在奶牛乳腺上皮细胞中作用,采用沉默和过表达FLCN,同时添加AMPK激活剂和抑制剂,结果表明AMPK激活时,FLCN蛋白表达升高,mTOR、p-mTOR、Cyclin D1和CSN2表达降低。AMPK活性抑制时结果则相反。研究结果表明AMPK正调控FLCN表达,负调节mTOR表达及活性,抑制细胞增殖和乳蛋白合成。结合前人研究结果FLCN过表达抑制AMPK表达及磷酸化,AMPK激活反而促进FLCN表达,表明AMPK与FLCN形成负反馈作用。Gingras等研究表明AMPK信号是FLCN的正调控因子[18],与本研究结果一致。基因干扰和过表达试验表明FLCN是mTOR、cyclin D1、caspase3、CSN2信号通路的正调控因子,同时也受AMPK正调控,与之前报道一致[19]。AMPK激活剂和抑制剂在FLCN干扰和过表达时刺激AMPK的表达水平,本试验结果表明AMPK正调控FLCN表达,FLCN抑制AMPK表达。说明FLCN参与AMPK和mTOR信号通路,在细胞能量调节中发挥作用,促进乳蛋白表达。mTOR是调节细胞生长和增殖途径关键信号通路,在奶牛乳腺上皮细胞中,营养物质可通过mTOR信号通路调节乳蛋白合成。Li等研究表明,沉默FLCN降低mTOR水平表达[20],Hartman等研究表明,沉默FLCN导致mTORC1的活性标志蛋白核糖体蛋白S6K磷酸化水平降低[21],这些结果表明FLCN正调控mTOR信号通路,与本试验研究结果一致。但Wada等研究表明,沉默FLCN导致小鼠胚胎mTORC1活性升高[22],与本试验结果相反。推测原因为细胞类型和实验条件等因素,或是沉默FLCN初期,mTOR被抑制,随之被其他因素影响而激活mTOR,后续仍需试验证实。
为进一步阐明FLCN在乳腺上皮细胞中能量代谢调节作用,分别将奶牛乳腺上皮细胞在正常和无糖条件下培养。无糖处理后FLCN、AMPK和p-AMPK表达升高,mTOR、p-mTOR CyclinD1、CSN2和p-ACC表达降低。AMPK是哺乳动物细胞重要的能量感受器,当细胞能量供应不足时,AMPK信号通路被激活。结果表明,无糖处理后激活AMPK信号通路,抑制mTOR信号通路,细胞周期蛋白和乳蛋白合成被抑制。结果表明,当细胞经无糖处理能量缺乏时,细胞能量感受器AMPK被激活,同时FLCN表达升高调节AMPK活性,用于维持细胞存活。Baba等研究结果表明,FLCN参与mTOR信号通路和细胞能量代谢调控[6]。本试验结果表明,FLCN参与奶牛乳腺上皮细胞的能量代谢调节,FLCN充当mTOR功能的正调节子和AMPK功能的负调节子参与细胞内能量代谢。FLCN和AMPK之间存在负反馈调节,保证细胞内能量代谢稳定调节,维持内环境的稳态。
综上所述,本试验表明AMPK是FLCN正调控因子,FLCN被鉴定为AMPK负调控因子。Schmidt等在线虫研究中,FLCN缺失导致AMPK结构性激活,增加自噬以及增加能量和代谢应激的激活[23]。FLCN与AMPK之间存在负反馈调节,这对于维持细胞代谢稳定以及内环境至关重要。本研究首次证明FLCN通过AMPK-mTOR信号轴参与乳腺上皮细胞能量代谢调控,明确FLCN在乳腺发育中作用,为人工改善乳品质、提高乳产量提供理论基础。

