不同白粉病抗性甜瓜材料叶片组织病理学及接种后ROS代谢相关酶基因表达分析
高 鹏,徐 楠,张曼琳,刘 泰,丁 卓,崔浩楠,张泰峰
(1.农业农村部东北地区园艺作物生物学与种质创制重点实验室,哈尔滨 150030;2.东北农业大学园艺园林学院,哈尔滨 150030;3.河北科技师范学院园艺科技学院,河北 昌黎 066600)
甜瓜(Cucumis meloL.)为葫芦科甜瓜属一年生草本作物,种植规模较大[1]。白粉病为植物生长阶段普遍发生的真菌病害,在露地以及温室条件下广泛发生,造成产品品质与产量降低。甜瓜白粉病发病时叶片表面产生大量白色斑粉,严重时全株遍布白粉,影响叶片光合能力,产生生产抑制,造成植株减产,甚至绝产[2]。目前,世界范围内致使白粉病发生的主要是二孢白粉菌(Golovinomyces cichoracearumL.,Gc)和单囊壳白粉菌(Podosphaera xanthii,Px)[3],分别分化出2个和11个生理小种,我国以单囊壳白粉菌1号和2F生理小种为主[4]。白粉菌侵染植物时,先由植物表皮侵入植物体内,然后分生孢子萌发芽管和吸器在表皮细胞定植进而在细胞间隙产生大量菌丝。因此,植物组织形态结构在与病原菌对抗过程中具有关键作用[5]。张咏梅等研究证实,在白粉菌侵染苜蓿后,不同抗性苜蓿材料栅栏细胞及叶肉细胞均发生一定程度形态改变,抗病苜蓿材料在被白粉菌侵染后,栅栏细胞排列逐渐松散且形状由原来的长圆形变为圆形[6]。王方等研究证实,在炭疽病侵染枣树叶片后,抗病性强品种上表皮和栅栏组织厚度大,对炭疽病抗性也越强[7]。不同抗性苦瓜材料叶片结构研究发现,野生抗病苦瓜材料在茸毛数量及气孔密度上均低于感病栽培材料,但在结构紧密度上却高于高感栽培材料[8]。李敏等研究证实,柑桔在溃疡病菌胁迫下,抗性与叶片下表皮气孔存在显著差异,4份柑桔材料气孔密度与抗性呈正相关,此结构可在早期有效筛选柑桔是否抗溃疡病[9]。植物被病原菌侵染后,超氧化物歧化酶(Superoxide dimutase,SOD)、过氧化氢酶(Catalase,CAT)、过氧化物酶(Peroxidase,POD)等酶类可高效去除活性氧物质(Reactive oxygen species,ROS)[10]。枯萎病菌胁迫下南瓜材料中CAT、POD、SOD活性均出现上升或下降情况,南瓜抗性与早期SOD和POD活性呈正相关[11]。郭艳红等研究证实,月季被黑斑病侵染后,抗病月季材料与感病月季材料中SOD和POD活性均出现上升情况,接菌后抗病月季中SOD和POD活性一直处于较高水平,说明高水平SOD和POD活性更有利于抵抗病原菌[12]。
本研究分析抗感甜瓜材料叶片组织结构、表皮细胞、气孔等方面差异;利用考马斯亮蓝和DAB染色方法观察叶片上白粉病菌形成和H2O2累积;测定甜瓜白粉菌侵染后叶片中与ROS产生相关的CAT、SOD和POD基因表达量,阐明不同白粉病抗性甜瓜叶片组织结构、ROS积累差异。
1 材料与方法
1.1 甜瓜材料与病原菌准备
供试甜瓜材料由东北农业大学园艺园林学院西甜瓜分子遗传育种研究室提供。根据实验室前期抗感性试验结果,选择抗病材料M4-125和M4-118与感病材料M4-116和M1-101。供试材料均为纯合自交系,且M1-101为薄皮甜瓜,其余均为厚皮甜瓜。供试材料种植于东北农业大学设施园艺工程中心,每份材料种植5株,3次重复;本研究试验病菌P.xanthii的1号生理小种的采集纯化也在此处完成。试验过程中温度22~27℃,湿度60%~70%,采取双蔓整枝方式对甜瓜材料作田间管理。
1.2 甜瓜材料病菌接种与抗性分级
在供试甜瓜未感病叶片上均匀喷洒浓度为1×106孢子悬浮液,14 d调查发病情况,每份材料重复5次。发病情况参考马鸿艳等[13]标准并统计病情指数(DI),每株取3片真叶用于统计分析,生物学重复3次。抗性(Resistance,R)程度分为高抗、中抗、中感、高感四类,相对抗病指数为0~30、30~60、60~90和90以上。

1.3 甜瓜叶片组织结构观察
1.3.1 甜瓜叶片细胞特征观察
取长势良好甜瓜未感病且叶面积一致叶片用于石蜡切片观察,具体操作参考杨捷频方法[14]。通过操作物镜微尺(ZX-CX40M)测定叶片上表皮细胞厚度(Upper epidermal cell thickness,UCT)、下表皮细胞厚度(Lower epidermal cells thickness,LCT)、栅栏组织厚度(Palisade tissue thickness,PT)、海绵组织厚度(Spongy tissue thickness,ST)和叶片厚度(Leaf thickness,LT),15次重复。计算结构紧密度(CTR)=(PT/LT)×100%、疏松度(SR)=(ST/LT)×100%。
1.3.2 甜瓜叶片表皮结构观察
利用东北农业大学公共基础教学实验中心一楼试验室扫描电镜观察并拍摄未感病甜瓜叶片表皮细胞及气孔形态;具体操作参考Graham等方法[15]。表皮细胞紧密度(EC)=视野总表皮细胞个数/视野总面积(mm2)×100%。
1.4 甜瓜叶片接菌后考马斯亮蓝染色和DAB染色观察
利用光学显微镜(ZX-CX40M)(10×40倍)观察白粉菌侵染后从0 h开始截止72 h,间隔24 h,共4个时间点,记录甜瓜叶片染色情况。具体操作参考饶维桥等[16]和Daudi等[17]方法。
1.5 甜瓜叶片接菌后指标测定
根据试剂盒(ELISA,武汉)说明书测定H2O2含量、CAT、SOD和POD活性。从0 h开始截止72 h,间隔24 h,共4个时间点,生物学重复和技术重复均3次。
1.6 ROS代谢相关酶(CAT、SOD、POD)基因表达量测定
利用试剂盒(Toyobo,东京)作荧光定量PCR,确定接种白粉菌后4个时间点活性氧(ROS)代谢相关酶基因表达情况,生物学与技术重复均3次。
1.7 数据分析与处理
采用Microsoft Excel 2010、GraphPad Prism 8.0和SPSS 25.0作数据分析与处理。
2 结果与分析
2.1 不同甜瓜抗性分级及白粉菌侵染过程观察
通过在温室中对2份抗病材料与2份感病材料开展白粉病接种鉴定,其DI如表1所示,其中M4-116、M1-101、M4-118、M4-125对应DI分别为90.75、73.58、42.56、25.33,对应白粉病抗性分别为HS、MS、MR、HR。抗病和感病材料与前期抗感性试验选育情况一致。
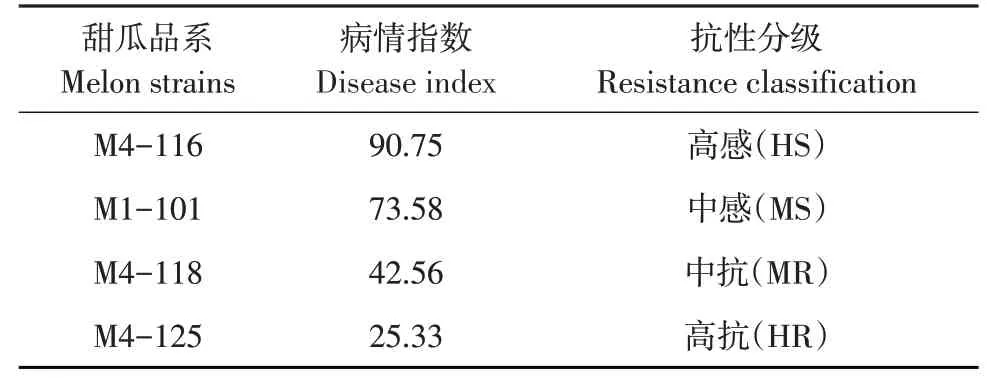
表1 不同甜瓜品系白粉菌侵染后抗感鉴定分析Table 1 Identification and analysis of resistance to powdery mildew infection in different melon strains
如图1所示,感病材料M4-116和M4-101在白粉菌侵染后0 h,分生孢子未萌发吸器和菌丝;24 h后可观察到吸器与菌丝出现;48 h观察到萌发管出现分支,菌丝不断增加并向周围扩散;当受白粉菌侵染后72 h大量分生孢子梗出现。抗病材料M4-118和M4-125受白粉菌侵染0 h后与感病材料情况相同,白粉菌侵染24 h后出现分生孢子萌发但未发展产生初级菌丝。相比感病材料存在差异,M4-118在白粉菌侵染后48~72 h分生孢子菌丝发育被限制,未观察到萌发管分支产生,也未见菌丝大规模扩散(见图1K-L),抗病材料M4-125遭受白粉菌侵染后48 h,菌丝逐渐向周围扩散,白粉菌侵染72 h后菌丝生长情况较为缓慢,未观察到分生孢子梗出现(见图1O-P)。

图1 不同抗性甜瓜品系白粉菌丝发育特征Fig.1 Characteristics of mycelia development of melon strains with different resistance
2.2 甜瓜品系叶片纵切面结构特征
石蜡切片观察结果如图2所示,可观察到在抗病与感病材料中,叶片上表皮和下表皮细胞均呈现单层结构,且在每份甜瓜材料中细胞排列情况不同。与2份感病材料相比,可看出抗病材料M4-125与M4-118上下表皮细胞整齐程度较感病材料M4-116和M1-101差,但栅栏组织整齐度和清晰度优于感病材料M4-116和M1-101,且在海绵组织中也观察到同样现象。
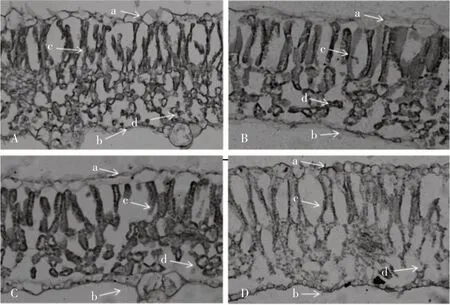
图2 甜瓜品系叶片纵切面结构特征Fig.2 Characteristics of longitudinal section structure of melon strains leaf
如表2所示,对4份材料分析可知感病材料M1-101上表皮、海绵组织、叶片厚度高于其他3份材料,且与抗病材料M4-125和M4-118上表皮、海绵组织、叶片厚度相比差异显著。感病材料M1-101叶片栅栏组织厚度最高,且与抗病材料M4-118存在显著差异。2份抗病甜瓜材料与2份感病甜瓜材料CTR及SR统计分析表明,抗病材料M4-125和M4-118叶片结构致密,紧密度高;而感病材料M4-116和M1-101叶片结构较为松散,其SR也显著高于抗病材料M4-125和M4-118。
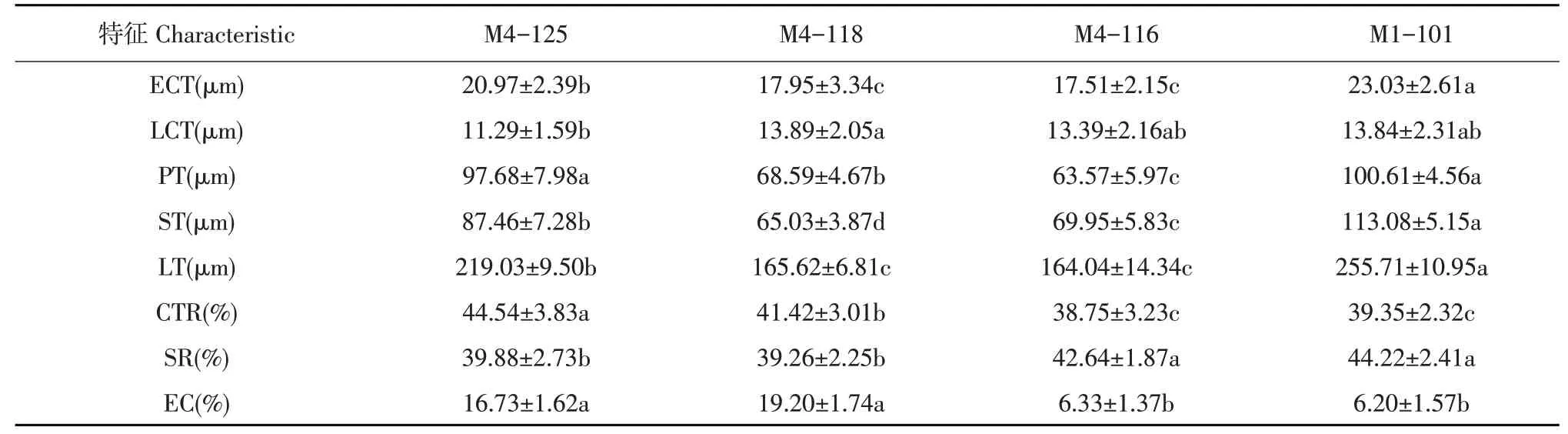
表2 甜瓜品系叶片结构之间显著性差异Table 2 Significant differences in leaf structure among melon strains
2.3 甜瓜品系表皮细胞紧密度与气孔分析
分析2份抗病材料和2份感病材料叶片EC可知(见表3),叶片EC最大的是抗病材料M4-118,其紧密程度为19.20±1.74;其次是抗病材料M4-125,紧密程度为16.73±1.62。且2份抗病材料叶片EC显著高于感病材料M4-116和M1-101。根据扫描电镜观察(见图3),可发现抗感材料气孔形态均为长椭圆形。由表3可知,在气孔数量方面感病材料M4-116与抗病材料差异显著;同时感病材料在气孔长度上与抗病材料相比也存在显著差异。

图3 甜瓜品系表皮细胞与气孔形态Fig.3 Morphology of epidermal cells and stoma in melonstrains

表3 不同甜瓜品系气孔数量与气孔长度分析Table 3 Analysis of stoma number and stoma length in different melon strains
2.4 甜瓜品系对白粉病抗性与叶片结构之间相关关系
选择2份抗病材料与2份感病材料作白粉病抗性与叶片结构之间相关关系分析,根据表4可知,与甜瓜白粉病抗性之间存在极显著相关,分别为CTR、SR及EC,相关性分别是正相关、负相关和正相关,相关系数分别为0.844、-0.927和0.973。
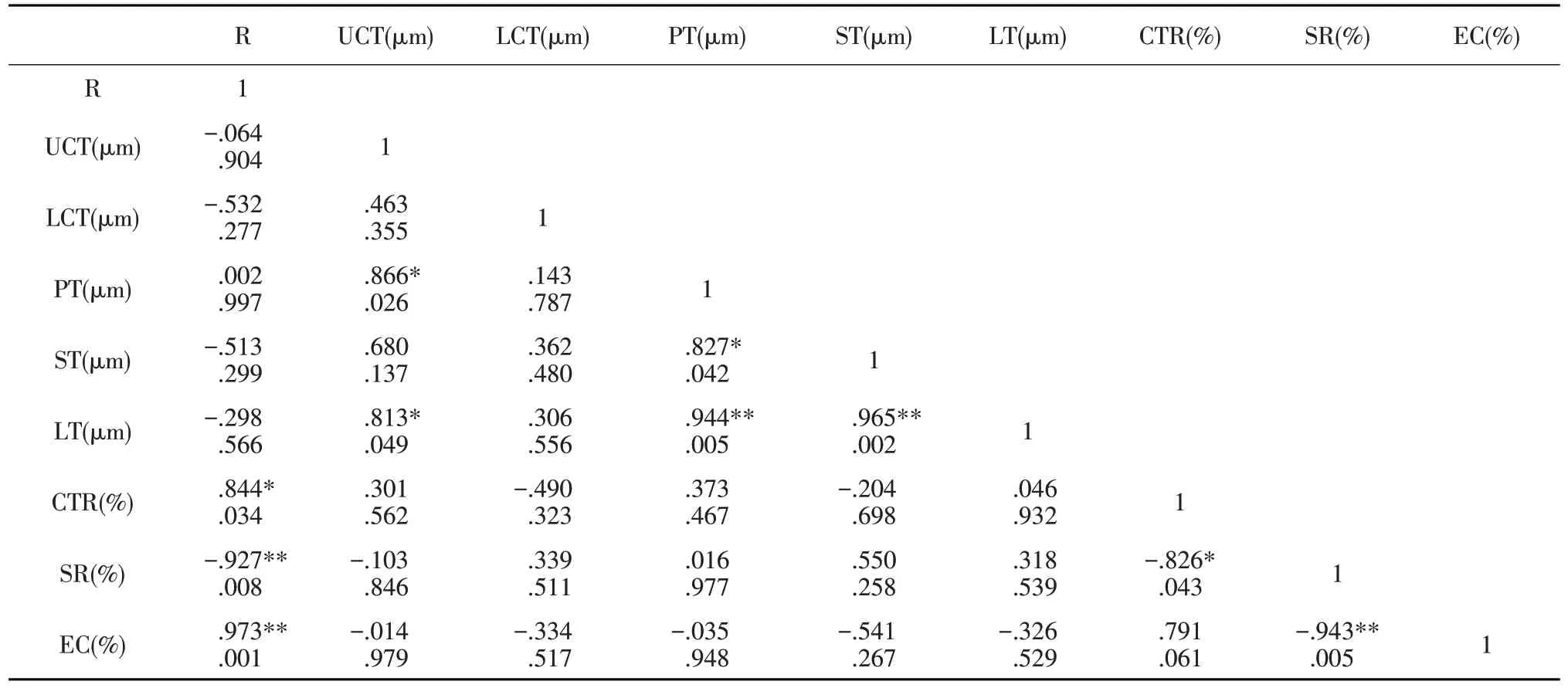
表4 甜瓜品系对白粉病抗性与叶片结构之间相关关系Table 4 Correlation between leaf structure and powdery mildew resistance of melon strians
2.5 不同白粉病抗性甜瓜品系叶片H2O2含量及酶活性测定
利用DAB染色观察白粉菌侵染抗感甜瓜后叶片活性氧迸发情况,记录叶片中H2O2变化过程。根据图4可知,高感材料M4-116、中感材料M4-101和中抗材料M4-118在接菌后48和72 h可检测到细胞中少量H2O2存在。而高抗材料M4-125叶片细胞在白粉菌侵染后0~24 h并未检测到H2O2,侵染后48~72 h,在细胞中检测到较多H2O2。

图4 白粉病菌侵染后甜瓜品系叶片中H2O2变化过程Fig.4 Changes of H2O2 in melon strains leaves after powdery mildew infection
采集白粉菌胁迫后4个时期甜瓜叶片,根据图5A可知H2O2变化情况,高感材料M4-116、中感材料M4-101以及中抗材料M4-118遭受白粉菌胁迫后H2O2变化情况无显著差异;而高抗材料M4-125遭受白粉菌胁迫后,H2O2含量在48 h有明显上升趋势且72 h时下降;H2O2测定和DAB染色结果表明白粉菌胁迫后48 h存在大量H2O2。根据图5B可知,白粉菌侵染后24 h中抗材料M4-118的CAT活性上升,其他3份材料均显著下降,且高抗材料M4-125降低程度小于感病材料;接种后72 h,高抗材料M4-125的CAT活性在4份甜瓜材料中最低。根据图5C可知,2份抗病甜瓜材料被白粉菌侵染后SOD活性呈逐渐上升趋势,但在接菌后4个时间点上升和下降情况并不一致。白粉菌胁迫下高感材料M4-116和中感材料M1-101的SOD活性变化较为复杂且无规律可循,但侵染后48~72 h活性均出现降低。根据图5D可知,白粉菌侵染后4份甜瓜材料POD活性持续上升,且感病材料在白粉菌侵染后0~48 h,POD活性水平始终大于2份抗病材料,但不同抗病材料之间抗性与POD活性在4个时间点变化不同。
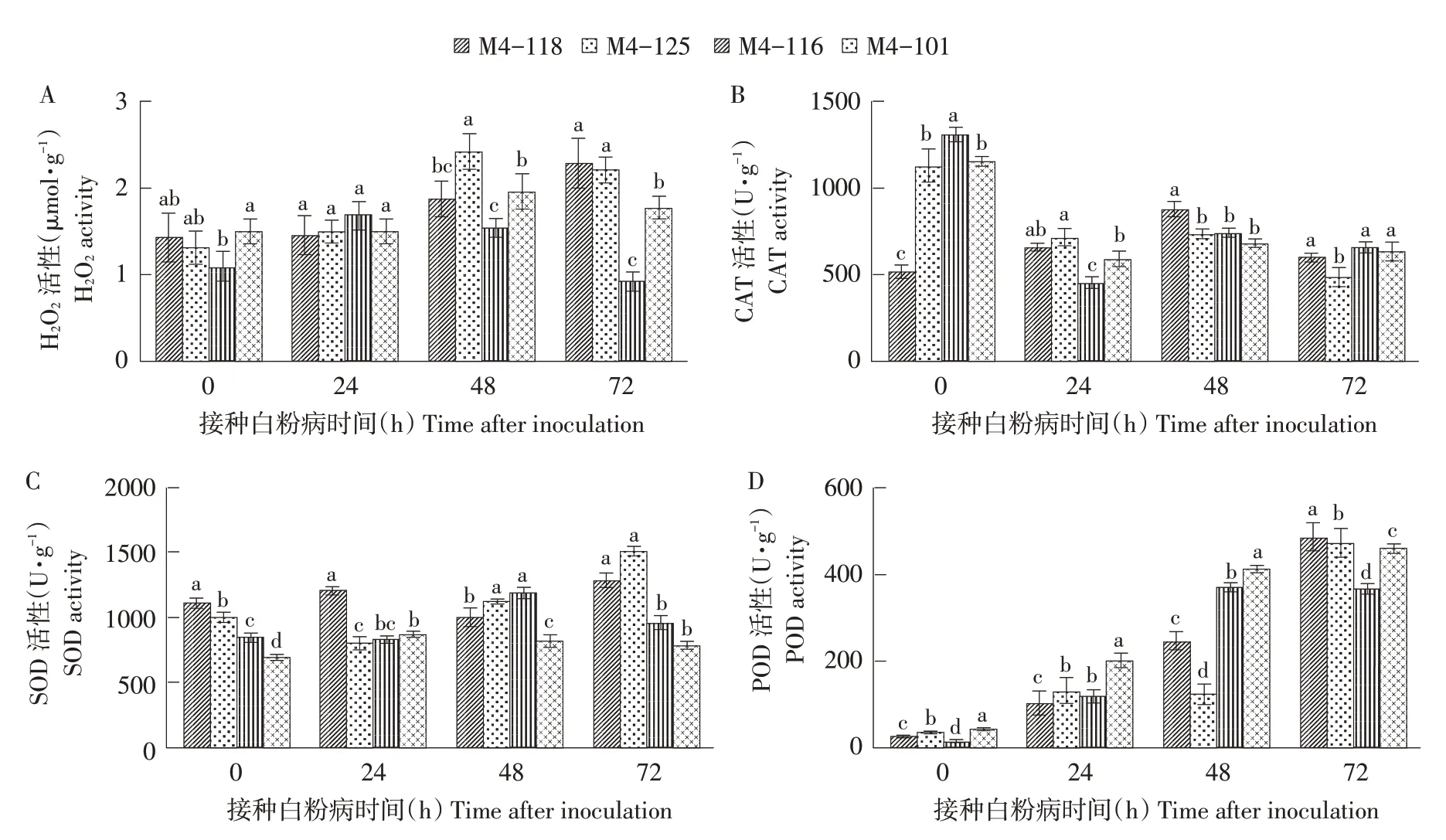
图5 4份甜瓜品系白粉菌侵染后H2O2、CAT、SOD和POD活性变化Fig.5 Changes of H2O2,CAT,SOD and POD activities in four melon strains infected with powdery mildew
2.6 白粉菌侵染后甜瓜活性氧代谢相关基因表达
本试验利用荧光定量PCR技术测定高抗材料M4-125和高感材料M4-116在白粉菌侵染后4个时间点CAT、SOD、POD基因表达量。从本实验室甜瓜抗白粉病转录组研究成果中(NCBI登录号:SRX2442184和SRX2442273),筛选出对白粉病有明显响应活性氧代谢相关基因。分别为CAT基因MELO3C026532、MELO3C017024、MELO3C014643,SOD基 因MELO3C014007、MELO3C020487和POD基 因MELO3C014655、MELO3C018672。由 图6可知,白粉菌侵染后3个CAT基因在高抗材料M4-125中表达量均出现明显升高趋势;而在高感材料M4-116中MELO3C017024基因在接菌24 h后表现明显下降趋势,其他两个基因表达量并未明显下降。由图6可知,白粉菌侵染后48 h在高抗材料M4-125中MELO3C014007和MELO3C020487基因表达量均出现明显增加趋势,但MELO3C020487在72 h表达量略下降;而MELO3C014007和MELO3C020487基因在高感材料M4-116接菌后0~48 h,表达量未表现升高或降低,但在48~72 h基因MELO3C020487表达量显著上调。由图6可知,2个POD基因在白粉菌侵染后表达量变化在高抗材料M4-125中也有所区别,其中MELO3C014-655基因表达量出现明显升高趋势,而MELO3C018672基因在白粉菌侵染48 h后表达量才开始逐渐上升,且在72 h时表达量又出现下降趋势,在高感材料M4-116中ME-LO3C014655基因表达量呈先升高后降低,而MELO3C018672基因表达量并未出现明显上升或下降。

图6 白粉菌侵染后甜瓜活性氧代谢相关基因表达Fig.6 Expression of genes related to ROS metabolism in melon after powdery mildew infection
3 讨论
陈夕军等研究证实,在黄瓜抵御白粉菌侵染过程中,黄瓜叶细胞是否整齐以及细胞壁薄厚程度均在此过程中发挥重要作用[18]。张咏梅研究发现,庆阳苜蓿整齐紧实的栅栏组织,细胞致密的海绵组织在抵御病原菌侵入时发挥积极作用[6]。田丽波等研究证实,抗白粉病苦瓜品系叶结构紧密度较高,栅栏及海绵组织相比于感病苦瓜品系更密实,且苦瓜对白粉病抗性与叶片厚度及上下表皮厚度存在相关性[8],上述研究成果均证实叶片结构紧密性、结构松散程度与植株抗病性密切相关,在植株抵御病原菌入侵过程中发挥重要功能。本研究扫描电镜结果表明,2份抗病材料栅栏组织与海绵组织清晰度高于2份感病材料;2份感病材料叶片紧密程度显著低于2份抗病材料,疏松程度则反之,与前人研究成果相同[6,8,18]。4份甜瓜材料叶片、上下表皮差异不显著,推测是与本试验所用材料叶片结构有关。
本研究中不同甜瓜品系叶片表面气孔数量和长度存在差异,与不同猕猴桃品系叶片研究结果一致[19]。通过石蜡切片可知,2份抗病材料叶片表皮细胞排列不规则且单位面积表皮细胞数高于2份感病材料。本研究分析表皮细胞紧密度相关性发现,该结构与抗性之间呈正相关。因此,表皮细胞结构紧密程度在抑制白粉菌对甜瓜侵染过程中发挥关键作用。
ROS作为一种信号分子,含量过高致使植株细胞出现膜脂过氧化,影响膜结构和功能[20]。本试验表明,不同甜瓜材料对白粉病菌胁迫响应存在区别。研究表明,CAT、POD和SOD在植物抵御病害侵染过程中发挥重要作用[21-22]。陈亮等研究发现西瓜在被枯萎病菌侵染后,CAT活性呈现先升后降的趋势[23],与本研究中抗材料M4-118 CAT活性变化一致。
一般情况下,生物胁迫导致植物POD活性升高,如瓠瓜[24]、小麦[25]、豌豆[26]等,且POD活性随抗病能力增强而升高,本研究4份材料POD活性在白粉菌入侵过程中均显著升高,但POD活性变化与抗性并无相关性。本研究4份材料在白粉菌胁迫72 h后,SOD活性均上升,这与赵卫星等在病毒病侵染西瓜叶片的研究中结论相符[27]。但高抗材料M4-125的H2O2活性在白粉菌侵染后0~48 h逐步递增,结合染色观察及SOD酶活性变化,推测H2O2过量加速被感染叶细胞死亡从而抵御白粉病菌胁迫。综上所述,CAT、POD和SOD不同酶在抵御白粉菌入侵过程中发生反应,且该反应协同发生导致。
高抗材料M4-125的CAT与SOD基因表达量0~48 h呈升高趋势,推测是因病菌胁迫导致植物叶片活性氧快速产生,引起表达量上升,这与郭静在蔓枯病侵染甜瓜研究中结论一致[28]。祁静静等研究证实,CsKat01在感病柑橘中表达量与CAT活性呈正相关,H2O2含量呈负相关;推测CsKat01影响CAT活性及H2O2含量,从而决定柑橘是否抗病[29]。本研究高抗材料M4-125在接种白粉菌后48 h,POD基因表达量上升,推测高抗材料在白粉菌侵染后,固有防御系统被激活。曹璐璐研究证实,荔枝在霜疫霉胁迫下部分POD基因在抗病性强材料中表达量低,且在中抗和中感材料中均为部分被诱导表达[30]。
本研究表明,抗感材料由于自身调控抗性基因不同,导致有关酶活性存在差异,造成ROS相关基因表达不一致。
4 结论
a.分析CTR、SR以及EC与白粉病抗性相关性发现,这3个方面均与白粉病抗性呈显著相关。
b.通过测定2份抗病材料与2份感病材料在白粉菌侵染后4个时间点CAT、SOD、POD活性变化,表明甜瓜抗病材料叶片受白粉病侵染时SOD、POD活性均呈显著升高变化,但CAT活性却降低,说明POD、SOD活性升高与CAT活性降低有利于甜瓜抵御白粉菌入侵。
c.高抗材料M4-125中ROS代谢相关酶基因对白粉菌具有一致的响应,即在白粉菌侵染后表达量显著上调。

