基于高通量测序的猕猴桃根腐病根际土壤真菌群落研究
林庆柱,林芬,蔡林生 ,李振宇,朱友聪
(1.浙江亚米农业开发有限公司,浙江衢州 324102;2.浙江同济科技职业学院,浙江杭州 311231)
猕猴桃(Actinidia)为猕猴桃科猕猴桃属落叶藤本果树,果实因营养丰富、特别是高维生素C含量深受消费者喜爱[1]。中国是世界上最大的猕猴桃生产国[2], 江山市是浙江省最大的猕猴桃生产区域,种植面积在1 600 hm2左右,目前猕猴桃已成为江山市县域经济的优势产业。近年来,猕猴桃根腐病的发生正成为困扰该区域猕猴桃生产的主要问题,致使树势变弱、产量降低、品质变差[3]。
高通量测序作为第2代测序技术,具有操作简单、成本低、结果可信度高等优势,一次可对几百万条,甚至上千万条DNA序列分别进行测序,有助于准确分析环境中微生物的组成和分布[4]。笔者采用高通量测序的方法,研究猕猴桃根腐病植株根际土壤真菌群落多样性和群落结构特征,为生物防治此病害提供理论依据。
1 材料与方法
1.1 样品采集
猕猴桃种植园位于江山市塘源口乡仓坂村,地处中亚热带北部湿润季风气候区,光照充足,降雨充沛,雨热同期,多年平均气温17 ℃,无霜期249.7 d,地貌为山地丘陵。于2020年9月12日在猕猴桃种植园内采集土壤样品。选取面积10 m×10 m,间隔6 m的相邻的3个小区,每小区的土壤类型、肥力水平、施肥条件以及栽培管理措施均一致。在每个小区内随机选取3株具有典型发病症状的猕猴桃植株,同时选取3株生长健康、未感病的猕猴桃植株作为对照。用无菌手套采用抖落法收集粘附在感病植株与未感病植株细根上的土壤作为土壤样品,去除杂质,用直径2 mm的网筛过筛。取10 g土置于已消毒的自封袋中,利用冰盒保存,用于高通量测序。
1.2 土壤 DNA 提取与真菌ITS基因扩增
采用E.Z.N.A. Soil DNA Kit试剂盒法(D5625,美国Omega公司),提取土样的总DNA。经1%琼脂糖凝胶电泳检测DNA提取质量,采用Nano Drop ND-1000紫外分光光度计(美国Nano Drop公司)对DNA进行定量测定。各样品的5份DNA样品随机取3份等量混均,分别制成3个平行样品,于-20 ℃保存备用。使用的引物为ITS1FI2(5’-GTGARTCATCGAATCTTTG-3’)和ITS2 (5’-TCCTCCGCTTATTGATATGC-3’),对真菌ITS2可变区进行PCR扩增。PCR扩增产物通过2%琼脂糖凝胶电泳进行检测,并对目标片段进行回收,采用 AxyPrep PCR Cleanup Kit回收试剂盒。纯化后的PCR产物采用Quant-iT PicoGreen dsDNA Assay Kit在Qbit荧光定量系统上对文库进行定量,合格的文库浓度应在2 nM以上。将合格的文库(Index序列不可重复)梯度稀释后,根据所需测序量按相应比例混合,并经NaOH变性为单链进行上机测序,使用NovaSeq测序仪进行2×250 bp的双端测序[5]。
1.3 数据处理
经过 QIIME( V1.8.0) 软件过滤、拼接、去除嵌合体后,聚类为用于物种分类的OTU,并将所有样品进行抽平。采用 RDP classifier 贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,置信度阈值为0.7,选用Silva数据库,得到分类学信息[6]。
2 结果与分析
2.1 门水平上感病与未感病植株根际土壤真菌优势菌群
经检测,猕猴桃未感病植株根际土壤真菌的第一优势门为担子菌门,其他依次为子囊菌门、未分类菌门和接合菌门。感病植株根际土壤真菌的第一优势门为子囊菌门,其他的依次为担子菌门、未分类菌门和接合菌门。感病植株的子囊菌门的相对丰度为96.55%,比未感病植株高51.79%,为极显著性差异(P<0.01)。感病植株的担子菌门、接合菌门的相对丰度分别为2.71%和0.18%,比未感病植株低48.05%和0.94%,为极显著性差异(P<0.01)。
2.2 纲水平上感病和未感病植株根际土壤真菌优势菌群
在纲水平上,猕猴桃根腐病感病植株根际土壤真菌的第一优势菌纲为粪壳菌纲,其他的依次为座囊菌纲、散囊菌纲、伞菌纲。未感病植株的第一优势菌纲为伞菌纲,其他的依次为粪壳菌纲、座囊菌纲、盘菌纲。感病植株的粪壳菌纲相对丰度90.22%,比未感病植株高52.64%,为极显著性差异(P<0.01)。感病植株与未感病植株的座囊菌纲相对丰度差异不显著。感病植株的散囊菌纲相对丰度为1.23%,比未感病植株高0.77%,为极显著性差异(P<0.01)。感病植株的伞菌纲、盘菌纲相对丰度分别为1.20%、0.94%,比未感病植株分别低49.36%、1.76%,均为极显著性差异(P<0.01)。
2.3 目水平上感病和未感病植株根际土壤真菌优势菌群
在目水平上,猕猴桃根腐病感病植株根际土壤真菌的第一优势菌目为肉座菌目,相对丰度84.89%,比未感病植株增加了66.24%,为极显著性差异(P<0.01)。其他的依次为Sordariales、小囊菌目、散囊菌目。未感病植株根际土壤真菌的第一优势菌目为未分类的伞菌纲,其他的依次为肉座菌目、Sordariales、Trexhisporales、小囊菌目。感病植株根际土壤Sordariales的相对丰度为3.09%,比未感病植侏低了7.17%,为极显著性差异(P<0.01)。
2.4 科水平上感病和未感病植株根际土壤真菌优势菌群
在科水平上,猕猴桃根腐病感病植株根际土壤真菌的第一优势菌科为赤壳科,相对丰度81.15%,比未感病植株高72.35%,为极显著性差异(P<0.01)。其他依次为假散囊菌科、肉座菌科、毛球壳科、囊菌科。未感病植株根际土壤真菌的第一优势菌群为未分类的伞菌纲,相对丰度38.78%,其他的依次为刺孢菌科、赤壳科、毛球壳科、囊菌科。感病植株的毛球壳科、囊菌科相对丰度分别为2.38%、1.75%,比未感病植株降低6.27%、5.04%,均为极显著性差异(P<0.01)。
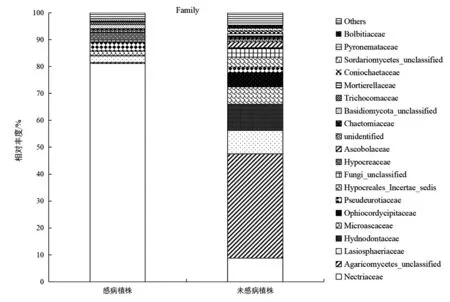
图1 科水平上感病和未感病植株根际土壤真菌优势群落
2.5 属水平上感病与未感病植株根际土壤真菌优势菌群
在属水平上,猕猴桃根腐病感病植株根际土壤真菌的第一优势菌属为赤霉菌属,相对丰度27.86%,比未感病植株高19.79%,为极显著性差异(P<0.01)。其他的依次为丛赤壳属、镰刀菌属、假裸囊菌属、肉座菌属、枝鼻菌属。未感病植株根际土壤真菌的第一优势菌群为未分类菌纲,其相对丰度为38.78%,其他的依次为粗糙孔菌属、赤霉菌属、枝鼻菌属、Ophiocordyceps,枝孢属等。感病植株根际土壤丛赤壳属、镰刀菌属的相对丰度分别为24.88%、6.19%,比未感病植株高857.93倍、88.43倍,为极显著性差异(P<0.01)。
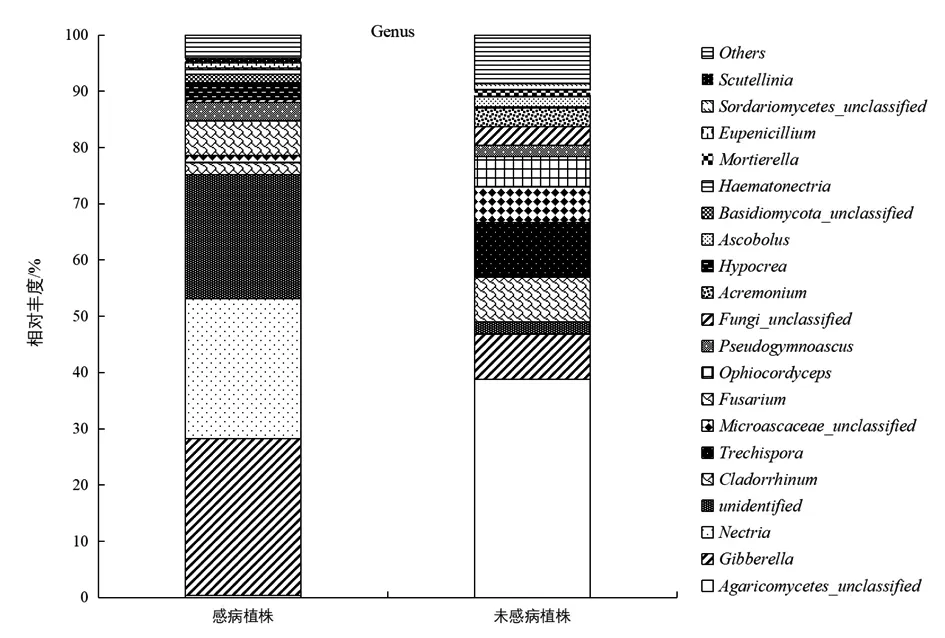
图2 属水平上感病和未感病植株根际土壤真菌优势群落
3 小结与讨论
农田土壤中的子囊菌门包含了很多作物病原菌。谢玉清等[7]采用高通量测序法分析了新疆吉木萨尔县大蒜根腐病发生时其植株根际土壤真菌的群落结构变化特征,认为高丰度的子囊菌门菌群与大蒜根腐烂病害发生有着密切的关系,在根腐病发生最严重的大蒜抽苔期,感染根腐病的大蒜植株根际土壤维持着较高丰度的接合菌门。宋旭红等[8]采用Illumina高通量测序技术分析了黄连根腐病根际土壤真菌群落结构组成,发现病株土壤中子囊菌门菌群的相对丰度显著高于健康株的,而接合菌门菌群在病株土壤中的相对丰度则显著低于健康植株的。
本研究发现猕猴桃植株感染根腐病后,其根际土壤真菌子囊菌门(Ascomycota)的相对丰度比未感病植株根际土壤多115.71%,而担子菌门(Basidiomycota)和接合菌门(Zygomcota)的相对丰度分别少94.66%和83.93%。本研究结果与上述学者[7,8]的研究结果相一致,表明猕猴桃健康植株根系分泌物能够抑制子囊菌门的繁殖,促进接合菌门和担子菌门的繁殖,而根腐病感病植株根系与根际土壤微生物之间的平衡互作关系遭到破坏,促进了根际土壤子囊菌门的繁殖。
本研究中猕猴桃感染根腐病植株的被孢霉属(Mortierella)的相对丰度明显低于未感病植株。土壤中被孢霉属是一类益生真菌菌群,可以产生多种生物活性物质。此外,未感病猕猴桃植株根际土壤真菌枝鼻菌属(Cladorrhinum)、粗糙孔菌属(Trechispora)、线虫菌属(Ophiocordyceps)等益生真菌属菌群的相对丰度显著高于感病植株的,这些菌属很可能具有生防功能,说明感病后,根际土壤中的该真菌属菌群遭到了破坏。
镰刀菌属广泛分布于自然界,某些菌株能够产生植物刺激素、植保素和类生长素等促进植物生长,也能引起很多作物发生赤霉菌病和枯萎病[9]。本研究中猕猴桃根腐病感病植株根际土壤镰刀菌属的相对丰度比未感病植株的高87.43倍,说明镰刀菌属也是引起猕猴桃根腐病的主要病菌之一。猕猴桃感染根腐病后,植株体内产生的营养物质可能有利于镰刀菌属的生长,从而导致镰刀菌属相对丰度增加。
本研究表明,与未感病植株相比,猕猴桃植株感染根腐病后其根际土壤真菌的群落结构和相对丰度发生了显著变化,打破了植物根际土壤微生态系统中原有的微生物拮抗平衡关系,形成了新的真菌群落关系。与未感病植株根际土壤相比,在门分类水平上,感病植株根际土壤子囊菌门相对丰度增高,而接合菌门和担子菌门的相对丰度降低。在纲分类水平上,感病植株根际土壤粪壳菌纲的相对丰度增高,伞菌纲、盘菌纲的相对丰度降低。在目分类水平上,感病植株根际土壤肉座菌目的相对丰度增多,而Sordaihales,Trechnsporales、小壳菌目的相对丰度降低。在科分类水平上,感病植株根际土壤赤壳科的相对丰度增加,而毛球壳科、囊菌科的相对丰度降低。在属分类水平上,感病植株根际土壤的赤霉菌属、丛赤壳属的相对丰度增高。与未感病植株相比,在各分类水平上感病植株根际土壤各菌群的相对丰度差异基本上都达极显著水平。

