核蛋白H-NS调控多重耐药鸡大肠埃希菌IncFⅡ质粒接合转移的分子机制
贾雅婷,胡慧慧,翟亚军,赵冰,何坤,潘玉善,胡功政,苑丽
河南农业大学动物医学院,郑州 450046
0 引言
【研究意义】 质粒介导的耐药基因水平散播是导致临床中多重耐药菌急剧增多的重要原因之一。IncFⅡ质粒是大肠埃希菌中最常见的携带基因的接合型质粒,可在不同菌属间通过质粒接合作用进行水平传播。H-NS核蛋白为常见的负调控蛋白,可调控外源性基因的转录和表达。但是,H-NS能否调控经接合作用获得的IncFⅡ质粒,以及调控其接合转移的机制尚不明晰。本研究旨在通过研究 H-NS对 IncFⅡ质粒接合的调控作用及机制,以期为控制IncFⅡ质粒介导的多重耐药基因水平快速散播提供理论依据。【前人研究进展】IncFⅡ质粒介导的耐药基因水平传播是耐药基因在菌属间快速散播的重要途径之一,是肠杆菌科细菌获得耐药的最重要途径,也是大肠埃希菌中最常见的流行性接合质粒。研究发现,IncFⅡ质粒不仅在基因的传播中发挥了重要作用,同时也参与了许多其他耐药基因(如、、、和等)在菌属间的水平传播,从而对人和动物的健康造成严重威胁。H-NS是一种广泛存在于革兰阴性菌中的核酸样 DNA结合蛋白,能够负调控细菌获得的大量外源性基因的转录和表达。研究证实,H-NS自身能够形成同源或异源二聚体,与富含AT的DNA序列结合形成DNA-HNS复合物,从而抑制相应基因的转录,且H-NS的抑制作用主要发生在转录启动水平。tra基因是IncFⅡ质粒常见的质粒转移基因,tra基因的操纵子是一个长为33.3 kb的多顺反子,P为启动子,其编码了质粒水平转移所必需的绝大多数蛋白质,只有tra基因正常表达,IncFⅡ等接合型质粒才能完成接合转移。tra基因的表达受TraJ和 TraM调节蛋白的调控,2004年,WILL等人证明了H-NS可在细菌进入生长稳定期后抑制 F质粒中和的表达。2006年,WILL等进一步发现H-NS可阻遏F质粒操纵子的P启动子的转录。但是,H-NS核蛋白对 IncFⅡ质粒的接合作用是否也具有调控作用尚不清楚。【本研究切入点】目前,国内外关于IncFⅡ质粒的报道较多,但主要集中在其质粒结构及携带的耐药基因散播方面,有关H-NS对IncFⅡ质粒接合转移的调控分子机制尚未见有报道。【拟解决的关键问题】本研究通过揭示H-NS调控IncFⅡ质粒接合作用的靶基因、确切调控方式和调控位点,从而明晰H-NS调控IncFⅡ质粒接合作用的分子机制,以期为临床深入研究控制IncFⅡ质粒介导的多重耐药基因水平快速散播提供理论依据。
1 材料与方法
1.1 试验材料
大肠埃希菌ATCC25922为质控菌株,大肠埃希菌 J53(耐叠氮钠)为质粒接合试验的受体菌。pEC011是河南农业大学动物医学院药理实验室从鸡大肠埃希菌ST117分离株中发现的含有多种耐药基因(、和)的IncFⅡ(F33: A-: B-)质粒。pKP302为无启动子的报告质粒。下列菌株均由河南农业大学动物医学院药理实验室构建保存:(1)缺失株 Δ和回补株 Δ/p;(2)菌株 F25922、FΔ和 FΔ/p为携带 pEC011(IncFⅡ)质粒的重组菌(含头孢噻肟抗性),是将 pEC011质粒经电转分别导入大肠埃希菌ATCC25922、Δ和 Δ/p菌中。(3)重组菌pBAD25922是将pBAD质粒经电转导入大肠埃希菌ATCC25922。LB肉汤、LB琼脂、麦康凯琼脂培养基等均购于北京路桥技术有限公司。无水乙醇(≥99.7%)、异丙醇(≥99.7%)、氯仿(≥99.0%)、RNase-free水购于北京奥莱博科技有限公司;RNAiso Plus、Prime ScriptTM RT reagent Kit with gDNA Eraser cDNA第一链合成试剂盒、荧光染料 TB Green™Premix Ex Taq™ Ⅱ(Tli RNaseH Plus)均购自 TaKaRa公司;β-半乳糖苷酶活性检测试剂盒购于Promega公司,96孔化学发光板购于美国Corning公司;EMSA试剂盒购于赛默飞,使用时均在有效期内。本研究于2019年1月至2021年3月在河南农业大学动物医学院药理实验室完成。
1.2 试验方法
1.2.1 生长曲线测定 分别挑取大肠埃希菌ATCC25922、pBAD25922、F25922、FΔ和 FΔ/p单菌落至LB肉汤中,其中pBAD25922和回补菌株FΔ/p用0.2% L-阿拉伯糖诱导(下同),培养至OD约为0.5,按1∶1 000转接至新的LB肉汤,在 0、0.5、1.0、1.5、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10、11和12 h分别检测受试菌的OD值,试验重复3次,绘制生长曲线。
1.2.2 接合试验 以重组菌 F25922、FΔ和FΔ/p为供体菌,大肠埃希菌J53为受体菌,分别培养至OD值为0.5后,按1∶1混合培养4 h,吸取1 mL菌液依次进行10倍稀释,并将不同稀释倍数的菌液均匀涂布于含适量叠氮钠和头孢噻肟的双抗麦康凯平板和仅含适量头孢噻肟的单抗麦康凯平板,37 ℃培养箱过夜培养。选取菌落数在30—300之间稀释倍数的平板进行菌落计数。按下式计算各重组菌中IncFⅡ质粒的接合频率:接合频率=接合子菌落数×10/供体菌菌落数×10(x,y为稀释倍数)。
1.2.3 实时荧光定量PCR 选取3个质粒接合转移相关基因、和进行实时荧光定量PCR,通过Primer Premier 5.0设计引物并由北京擎科新业生物科技有限公司合成,引物序列见表1。分别挑取F25922、FΔ和FΔ/p的单菌落接种至LB液体培养基中,其中回补菌株FΔ/p用0.2% L-阿拉伯糖诱导,培养至 OD值为 0.5时,用 Trizol法提取细菌总RNA。去除gDNA后,按照反转录试剂盒说明书将RNA逆转录为cDNA,反应体系为20 μL,包括10 μL gDNA去除反应后产物、1 μL Prime Script RT Enzyme Mix1、1 μL RT Primer Mix、4 μL 5×Prime Script Buffer2和4 μL RNase-free HO。反应条件为37 ℃,15 min;85 ℃,5 s。最后以反转录合成的 cDNA为模板,以16S rRNA为内参,使用各个待测基因的RT-qPCR引物进行扩增。每个样品设置3个平行,反应体系为12.5 μL TB GreenⅡ(Tli RNaseH Plus)(2×)、上下游引物各 1、2 μL(<100 ng)cDNA模板和8.5 μL ddHO。

表1 本研究所用到的引物序列Table 1 Sequences of primers used in this study
1.2.4 β-半乳糖苷酶活性测定 以pEC011(IncFⅡ)质粒为模板,用带有R I和H I双酶切位点的引物P-F/R、P-F/R和P-F/R扩增、和的完整启动子区序列(各引物序列见表1)并克隆到pKP302质粒上,将重组质粒分别电转化入F25922、FΔ和 FΔ/p中,得到融合报告菌株F25922/P(P/P)、FΔP(P/P)和 FΔ/pP(P/P)。
将报告菌株分别接种至LB肉汤中,其中回补菌株FΔ/p的融合报告菌株用0.2% L-阿拉伯糖诱导,培养至OD值均约为0.5时,离心收集菌体,用PBS冲洗两遍;用10倍体积的buffer(含50 mmol·L葡萄糖、10 mmol·LEDTA、25 mmol·LpH8.0的Tris和4 mg·mL溶菌酶)将沉淀悬浮,室温孵育5 min,冰上孵育30 min;4 ℃离心后取上清液,按照β-半乳糖苷酶检测试剂盒说明书操作检测活性大小。活性大小用Miller Units衡量,表示单位个数细胞在单位时间内A的变化。Miller Units=10×[(OD-1.75 ×OD)]/(T×V×OD)(其中T为反应时间,min;V:用于检测样品上清体积,μL)。
1.2.5 电泳迁移率变动分析试验(EMSA) 构建H-NS蛋白原核表达载体,采用镍离子亲和层析法纯化H-NS蛋白。用于与蛋白结合的启动子序列由PCR扩增或退火得到(引物序列见表1);按照EMSA试剂盒说明书操作。具体方法如下:10 μL反应体系包括:10×结合反应液4 μL,启动子DNA序列200 ng,H-NS蛋白200—1 000 ng,双蒸水补足至10 μL,30℃反应30 min 后加入 2 μL 6×EMSA gel-loading solution,充分混匀。反应产物在200 V电压,4℃条件下进行(6%)非变性聚丙烯酰胺凝胶电泳。电泳结束后取下胶片置于塑料容器内,加入50 mL SYBR Green 染色液,50 r/min摇床染色20 min,用去离子水清洗胶片后照胶保存。
1.2.6 统计学分析 用GraphPad Prism 8.0软件进行统计学分析。用 t检验进行数据分析,其中<0.05为差异有统计学意义,<0.001为差异极显著。
2 结果
2.1 生长曲线
F25922、pBAD25922与大肠埃希菌ATCC25922菌株生长曲线相似,均在1.5 h后进入对数生长期,且达到稳定期的 OD值相近,说明质粒 pEC011(IncFⅡ)和pBAD的导入并没有明显影响菌株的生长速度。菌株FΔ和FΔ/p适应性比较差,生长速度明显较F25922缓慢,且在3 h后才进入对数生长期,达到稳定期的OD值明显低于F25922(图1),说明H-NS缺失后重组株不仅适应性较差,而且生长速度较慢。

图1 hns缺失菌株的生长曲线Fig. 1 Growth curves of hns deleted strains
2.2 接合试验
各受试菌中的 IncFⅡ质粒的接合频率结果如图2所示。缺失重组菌FΔ中IncFⅡ质粒的接合频率极显著高于F25922,且比后者高1 279.33倍(<0.001),说明的缺失会导致IncFⅡ质粒接合转移频率升高。而回补菌株FΔ/p中IncFⅡ质粒的接合转移频率尽管仍未完全恢复到对照菌的原有水平,但已极显著低于 FΔ(<0.001)。上述试验结果证明H-NS能明显负调控pEC011(IncFⅡ)质粒的接合转移。

图2 pEC011(IncFⅡ)质粒的接合频率Fig. 2 Conjugation transfer frequencies for IncFⅡ plasmid pEC011
2.3 实时荧光定量PCR
不同菌株中的、和的mRNA相对表达量见图3。
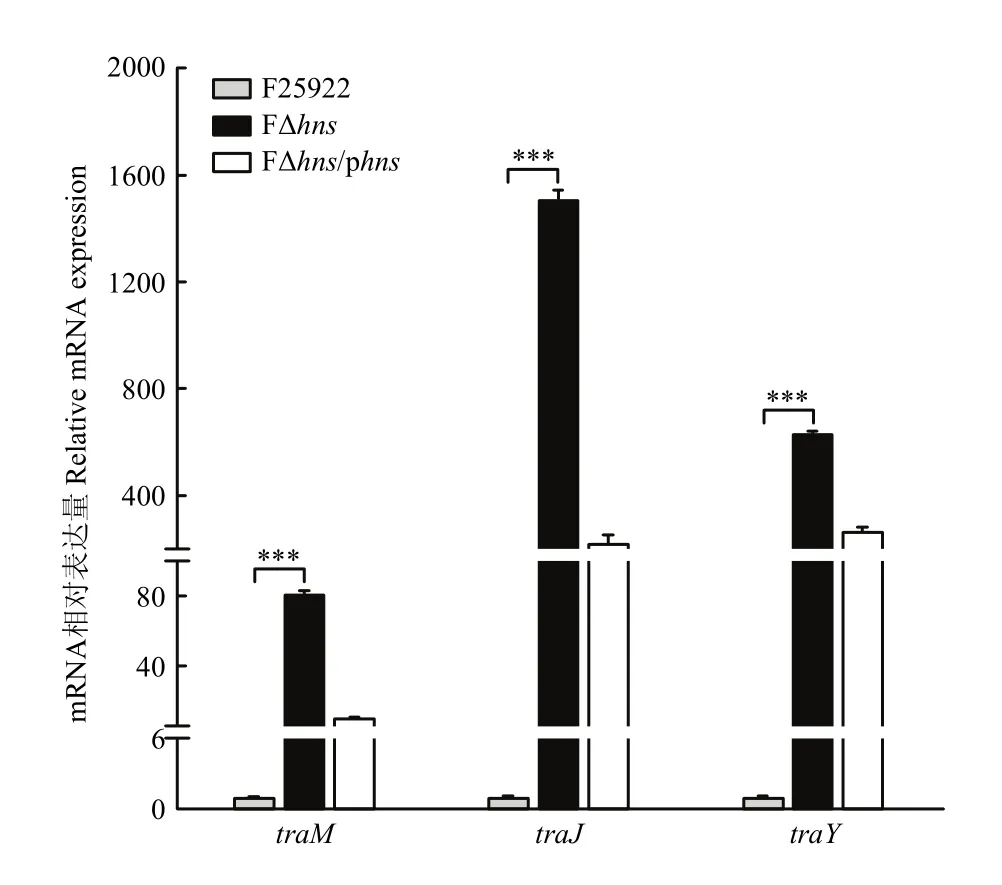
图3 3种接合转移基因mRNA的表达量Fig. 3 The expression levels of 3 selected transfer genes involved in conjugation
由图3可知,缺失重组菌FΔ中3基因的mRNA相对表达量均极显著高于对照菌(<0.001),其中的mRNA表达量最高,为F25922的1 510.14倍;其次是,是 F25922的 448.14倍;而的mRNA相对表达水平是F25922的81.54倍。同时,与缺失重组菌FΔ相比,回补菌株FΔ/p3个基因的 mRNA的相对表达量均有不同程度的降低,尽管仍明显高于对照菌F25922。上述结果证明H-NS通过显著下调pEC011(IncFⅡ)质粒的、和的mRNA表达量而抑制该质粒的接合转移。
2.4 β-半乳糖苷酶活性测定
9株报告菌株经活化培养后,用试剂盒检测其β-半乳糖苷酶活性,结果见图4。由图可知,缺失重组菌 FΔ不同启动子(P、P和 P)的 β-半乳糖苷酶活性均极显著高于对照菌的相应启动子(<0.001),且分别是后者的21.91、10.45和5.66倍。而缺失回补株FΔ/p不同启动子(P、P和P)的 β-半乳糖苷酶活性均恢复到对照菌 F25922的相应水平,说明H-NS可减弱3个tra基因的启动子P、P和P的活性。同时,H-NS对3个启动子P、P、P的调控有明显差异(<0.001),其中对启动子P调控作用最强,其次为P。

图4 受试菌不同启动子的β-半乳糖苷酶活性Fig. 4 β-galactosidase activity of difference promoters of reporter strains
2.5 EMSA试验
首先分别用较长的启动子序列P(488 bp)、P(403 bp)和P(377 bp)与H-NS蛋白进行EMSA试验。结果显示,H-NS蛋白可明显阻滞P、P和P的迁移(图5)。随后参考相关文献,预测了H-NS与、和的结合位点,并用EMSA对预测的结合位点进行验证,确定了当启动子长度为20—25 bp时,启动子中AT含量≥60%的区域均可与H-NS蛋白结合(图6)。结合区域的启动子序列分别为:P25:5′-TTGTTTCAGAATATAAAAGGTACTG-3′;P25:5′-ATTGAAACTGAAAATCGCCGATGCA-3′;P20:5′-GTTAAGTAAATGTTAAATAA-3′。

图5 H-NS与tra基因启动子的结合Fig. 5 H-NS protein binding to the promoters of tra gene

图6 H-NS与tra基因启动子的结合位点Fig. 6 The binding sites of H-NS protein and the promoters of tra genes
3 讨论
3.1 hns缺失株和回补株的生长情况
生长曲线结果显示,缺失重组菌 FΔ的生长速度明显低于大肠埃希菌ATCC25922和F25922,说明 hns基因的缺失会导致细菌生长适应性变差,细菌的生长速率变慢。2017年,DE LA CRUZ等在研究产肠毒素性大肠埃希菌IV型菌毛(Longus)的表达受 LngR、LngS以及 H-NS、CpxR和 CRP等的调控中发现,在产肠毒素大肠埃希菌(ETEC)E9034A中缺失了后其生长也明显受到影响,生长速率明显比原菌株低,即与本试验结果相似,H-NS的缺失会导致菌株的适应性变差和生长速度变慢,但不影响菌株的存活。2020年,HUANG等在研究H-NS在鲍曼不动杆菌中的作用时,发现会通过影响VIM-2或SPM-1的表达而减慢鲍曼不动杆菌的生长速度。而本试验中 hns基因影响大肠埃希菌生长速度的机制尚需要进一步研究。而回补重组菌FΔ/p的生长速度与缺失株FΔ类似,进一步证明了pBAD质粒的导入并未明显影响宿主菌的生长繁殖。但是,回补后,FΔ/p的生长速度仍明显较对照菌差,推测可能与回补株的构建方法有关。本试验构建的回补菌株是将全序列克隆连接至表达载体pBAD后,再经电转将其导入缺入株Δ中,从而生成Δ/ p,即回补重组菌FΔ/p中的位于pBAD质粒上,与原菌的位于染色体基因组中,两者的表达量可能有一定差异。
3.2 H-NS负调控IncFⅡ型质粒pEC011的接合转移
接合试验结果显示的缺失能明显增高pEC011(IncFⅡ)质粒的接合频率,初步证明对pEC011(IncFⅡ)质粒接合转移呈负调控作用。2014年,WILL等研究发现,H-NS对启动子的保守序列有沉默作用,虽然这种沉默作用可在PhoP与SlyA的协同作用下被消除。2018年,LU等也证明H-NS对P启动子的沉默可以被TraJ和ArcA消除,从而激活F型质粒的接合,这些研究均表明能影响 F型质粒的接合转移频率,与本研究结果相类似。但是,前人在研究H-NS调控机制时仅涉及到和P启动子,并未研究其对其他(如和)和其他启动子(P和P)有无调控作用。为弄清其调控的确切方式和位点,我们进一步完成了实时荧光定量PCR、Z融合报告菌株的β-半乳糖苷酶活性测定和EMSA试验。结果发现H-NS均可显著下调pEC011(IncFⅡ)质粒接合转移相关基因、和的mRNA表达量,证明了H-NS核蛋白不仅能抑制的表达,而且还能同时抑制和的表达,解释了在细菌对数生长期间,缺失株FΔ的IncFⅡ质粒接合转移大幅上升的原因。9株融合报告菌株(F25922/P(P/P)、FΔ/P(P/P)和 FΔ/p/P(P/P))的 β-半乳糖苷酶活性测定结果进一步发现,缺失重组菌FΔ的3个启动子活性(P、P和P)较对照菌的启动子均极显著增强。同时,EMSA结果表明H-NS均可与traM、traJ和traY基因的启动子区(P、P和P)结合,当将 P、P和 P的序列分别截短至 20—25 bp(AT≥60%)时,H-NS蛋白仍能与之结合,即H-NS蛋白可选择性的与调控基因启动子区的 AT富集区发生结合。上述结果不仅证明了 H-NS能直接与的启动子区结合,而且还创新发现H-NS能直接与和的启动子区结合,从而直接下调3种tra基因的表达,并显著抑制IncFⅡ质粒的接合转移。
4 结论
本研究表明H-NS蛋白的确切调控方式是通过直接与pEC011(IncFⅡ)质粒接合转移相关基因、和启动子区的AT富集区结合,通过抑制启动子的活性,从而导致启动子下游相关转移基因、和的表达量下降而直接产生负调控作用,为临床深入研究控制多重耐药鸡大肠埃希菌IncFⅡ质粒介导的多重耐药基因水平快速散播提供理论依据。

