宽带微量太赫兹辐射促进神经元生长发育*
马少卿 龚士香 张微 路承彪 李小俚 李英伟‡
1) (燕山大学信息科学与工程学院,秦皇岛 066004)
2) (河北省信息传输与信号处理重点实验室,秦皇岛 066004)
3) (新乡医学院河南省无创神经调控国际重点实验室,新乡 453000)
4) (北京师范大学认知神经科学与学习国家重点实验室,北京 100875)
太赫兹波位于氢键和范德瓦耳斯力作用能级范围内,可以直接与蛋白质耦合激发蛋白质的非线性共振效应,从而影响蛋白质的构象、神经元的结构和功能.基于此机制,体外培养SD 大鼠原代皮层神经元,利用宽带微量太赫兹(0.3—3.0 THz,最大辐射功率100 µW)短时间累计辐射(3 min/d,共3 d)皮层神经元;记录皮层神经元的动态发育参数(胞体面积和突起总长度);并分析辐射结束后神经元受体相关蛋白(GluA1 和GluN1)、突触素(SY-38)和突触后致密蛋白-95(PSD-95)的表达变化.太赫兹辐射1 d 后,神经元胞体面积增长值提高了144.9% (P< 0.05);太赫兹辐射的2 d 和3 d 后,神经元突起总长度增长值分别提高了65.1% (P <0.05)和109.4% (P < 0.05);太赫兹辐射3 d 后,GluA1 和SY-38 蛋白表达分别提高了38.1% (P < 0.05)和19.2% (P < 0.05).结果表明,宽带微量太赫兹短时累计辐射可以促进皮层神经元胞体和突起的生长,并且对神经元突起的促进作用存在累计效应;太赫兹辐射对神经元生长发育的促进作用可能与GluA1 和SY-38 蛋白表达相关.这些结果预示着特定频率和能量的太赫兹波可以发展为一种治疗或干预神经发育障碍等疾病的新型神经调控技术.
1 引言
神经系统是一个复杂的网络结构,这一网络调控着人的呼吸、感觉、情感和学习等行为活动[1].神经元是神经网络的重要组成部分,神经元的生长发育在神经元的功能和交流方面起着重要的作用[2].具体来说神经元的发育状态影响着其接收和传递信息的方式,神经元树突的功能是接收整合临近神经元的传入信息,其形态的多样性(长度和分支数)促进了局部和远程信号的传递,并且神经元发育的完整性在神经信息传递和正常神经功能的维持中起重要的作用[3].神经元发育异常及由此导致的神经网络结构异常可导致多种精神和神经疾病的发生,例如阿尔兹海默症[4]、自闭症[5]和帕金森症[6]等.因此发展有效的神经发育调控技术,不仅有助于干预和治疗神经发育障碍相关疾病,也可以帮助理解疾病的发病机制,找到干预靶点.
目前调控神经元生长发育的手段大致可以归纳为两类,第一类是药物调控,有研究表明,白藜芦醇和阿托伐他汀能够促进正常培养神经元突起的生长,同时能够改善脑缺血后大鼠神经功能,增强突触素表达[7,8].但是,药物在达到预期效果的过程中有许多障碍,这些包括生物利用度差、吸收低(食物效应)、首过代谢、靶向性低和剂量依赖性副作用[9].第二类为物理调控(声、光、电、磁),经颅磁刺激(transcranial magnetic stimulation,TMS)利用电磁感应原理在神经网络中产生感应电流,这些电流使神经元去极化,从而调节神经元的兴奋性.有研究表明TMS 对大脑的影响不仅限于神经元的兴奋性,可能包括其他类型的细胞被间接激活,甚至在分子层面发挥作用[10].重复对海马神经元施加TMS,使神经元去极化,诱导BDNF (brain-derived neurotrophic factor)从其树突中释放[11],并且有研究指出TMS 通过增加BDNF 和神经生长因子(nerve growth factor,NGF)促进神经元的分化、生长、发育和存活[12].这些研究表明,TMS对神经元生长发育的影响都是起源于TMS 对神经元活动的影响.经颅超声刺激(transcranial ultrasound stimulation,TUS)通过激活神经元上的机械敏感离子通道使神经元去极化,影响神经网络的兴奋性,也有研究指出TUS 可以影响神经元的力学特性,TUS 可以通过触发神经突起短暂收缩和诱导细胞体收缩来调节神经元生长发育[13].这些表明TMS 和TUS 都是通过一种间接的方式来调控神经元生长发育,它们的调控靶点多为神经元层面,并且超声波在空气中的衰减较大,通常需要在超声探头和样本之间添加水或者超声耦合剂等介质来减少超声波的衰减.因此,目前缺乏一种非接触式的,调控靶点为分子层面的神经调控技术来调节神经元的生长发育.
太赫兹波是位于微波与远红外之间的一种电磁波,频率范围为0.1—10 THz,太赫兹波处于氢键、电荷转移反应和范德瓦耳斯力作用的能级范围内,因此太赫兹辐射有望影响蛋白质的构象,甚至影响细胞的结构和功能[14].近年来,研究者们开始重视太赫兹波的神经生物学效应,各项研究之间的差异主要在于样本、太赫兹波频率、功率和辐射时间.目前的研究主要是利用太赫兹辐射神经元一段时间后,分析神经元结构的变化,其中主要包括神经元膜结构、突起、胞体[15-17].还没有学者关注太赫兹辐射对神经元动态生长发育和长期效应的研究,同时还缺少从蛋白层面分析太赫兹辐射促进神经元生长发育机制的研究.当使用功率较大(瓦量级)的太赫兹辐射神经元时会导致样本升温、生长紊乱、脱水效应(细胞体积减小)和形态的损伤[18].为了减小太赫兹辐射的热效应和负面影响,可以通过降低辐射功率、减少辐射时间、采用太赫兹脉冲波来实现.
本研究的重点是分析宽带微量太赫兹(频带为0.3—3 THz,最大辐射功率100 µW)短时间累计辐射(3 min/day,共3 d)的安全性.提供一些太赫兹辐射影响神经元生长发育的证据,并且分析这样的辐射协议对神经元动态生长发育的影响规律及长期效应.另外也提供了一些太赫兹辐射影响神经元蛋白层面变化的证据,以解释太赫兹辐射对神经元生长发育影响机制.
2 实验仪器与方法
2.1 光纤耦合太赫兹辐射平台
实验中使用的光纤耦合太赫兹辐射系统是德国Menlo Systems 公司生产的TERA K15,在其基础上对太赫兹波的传输光路进行了改进,如图1(a)所示.太赫兹频率分辨率小于1.2 G Hz,激光激发波长为1560 n m,激光系统的重复频率为100 M Hz,太赫兹系统输出有效频率范围为0.3—3 T Hz,最大输出功率为100 µ W.

图1 实验平台、实验协议和太赫兹波衰减测试 (a)太赫兹辐射神经元实验平台;(b)太赫兹辐射神经元实验协议;(c)太赫兹波穿透培养液后的时域图;(d)太赫兹波穿透培养液后的频域图Fig.1.Experimental platform,protocol and terahertz wave attenuation test: (a) Terahertz radiation neuron experimental platform;(b) experimental protocol for terahertz radiation neurons;(c) time domain diagram of terahertz wave after penetrating culture medium;(d) frequency domain map of terahertz wave after penetrating culture medium.
该系统配备飞秒光纤耦合激光器(Menlo systems T-light),激光器输出分为两路,一路通过一个2.5 m 的光纤连接器传输到光纤耦合太赫兹发射器(TERA 15-TX-FC Fe: InGaAs),发射器在偏置电压的作用下产生太赫兹波;另外一束输入到光延迟器,并通过光纤连接器传输到光纤耦合太赫兹探测器(TERA 15-RX-FC LT: InGaAs),通过调节激光在光延迟器中的传输距离使其与入射的太赫兹波同步.发射器产生太赫兹波后可以通过4 个透镜(L1,L2,L3,L4)将太赫兹光束聚焦为直径很小的光斑.由于发射器产生的太赫兹波具有发散性,所以首先通过平凸透镜L1 来准直太赫兹波束,L1 的焦距越长,光束的直径越宽;随后利用凸平透镜L2 将太赫兹波聚焦,为了增大太赫兹辐射到样本的能量,将样本放在太赫兹波焦点位置;平凸透镜L3 用来收集通过样本的太赫兹波,并将太赫兹波束准直,凸平透镜L4 将太赫兹波聚焦到探测器上,用于探测透过样本的太赫兹波.探测器采样的太赫兹信号首先通过锁相放大器(FEMTO,LCA-S10)对信号进行放大,随后对太赫兹信号进行数字处理,最后通过电脑显示.
2.2 实验协议
太赫兹辐射实验协议如图1(b)所示,首先提取胎鼠大脑皮层神经元,并进行为期2 d 的培养,使皮层神经元适应环境且贴壁生长;为了减少培养液对太赫兹波(频带为0.3—3 T Hz,最大辐射功率100 µ W)的吸收,从培养皿底部辐射皮层神经元.由于体外培养的神经元大致可以分成5 个阶段,并且每个阶段的持续时间都以天为单位,所以选择在神经元快速增长的3 d,利用太赫兹累计辐射神经元,同时为了尽可能的降低太赫兹辐射的热效应,采用3 m in/d 的辐射量.为了保证神经元的活性,以便于有效提取神经元的蛋白质,在太赫兹辐射结束后的2 d 内提取神经元蛋白,利用免疫印迹技术提取神经元相关蛋白含量.
2.3 实验材料
无特定病原体(specific pathogen free,SPF)SD (sprague-dawley)雌鼠,孕期12—15 d,购自北京维通利华实验动物技术有限公司.皮层原代神经元培养所用药品: 达尔伯克(氏)改良伊格尔(氏)培养基(Gibco,11965092)、神经基础培养 基 (Gibco,21103049)、B-27 (Gibco,17504044)、胎牛血清(Gibco,10099141C)、胰蛋白酶0.25% (Gibco,15050057)、青霉素-链霉素(Gibco,15140163)、谷丙氨酸二肽(Gibco,35050061)、多聚-L-赖氨酸溶液(Sigma,P4832)、HBSS (Beynotime,C0218)、HEPES(Beynotime,ST090).免疫印迹实验所用药品: Anti-AMPAR1(GluA1,Abcam,Cat #ab174785)、Anti-NMDAR1 (GluN1,Abcam,Cat #ab134308)、Anti-SY38 (SY38,Abcam,Cat #ab8049)、Anti-PSD95(PSD95,Abcam,Cat #ab13552)、Anti-GAPDH(Proteintech,Cat #60004-1-lg)、Anti-Beta Tubulin(Proteintech,Cat #66240-1-lg)、HRP-conjugated Affinipure Goat Anti-Mouse IgG(H+L) (Proteintech,Cat #SA00001-1).
2.4 皮层原代神经元培养
皮层原代神经元培养参考Legutko等[19]的方法,并稍作改进.选用SPF-SD 孕鼠,孕期12—15 d,体重300—350 g,在无菌工作台中取所孕胚胎,提取胎鼠的大脑皮层,剪碎、加入0.25%的胰蛋白酶,培养箱消化15 min,每3 min 取出摇匀.用尖端经火焰钝化处理后的巴氏滴管缓慢、轻柔吹打,分散细胞.用含有10%胎牛血清、90%达尔伯克(氏)改良伊格尔(氏)培养基种植,根据实验目的,调整细胞悬液浓度.观察神经元生长发育时调整细胞浓度为每毫升1×104个.接种于预先用100 µg/L的多聚-L-赖氨酸溶液包被处理过的35 mm 培养皿;37 ℃,5% CO2培养箱孵育,4 h后用含97%神经基础培养基、2% B27、1% 谷丙氨酸二肽的维持培养基替代种植培养基(换半液).
2.5 免疫印迹实验
原代培养神经元蛋白提取参考Wang等[20]的方法.太赫兹辐射神经元实验结束后裂解细胞,收集上清液作为总蛋白,BCA 法测定蛋白浓度、定量,添加上样缓冲液,95 ℃水浴变性10 min,分装蛋白样品.免疫印迹实验中,每个上样孔添加30 µg样品,10% SDS-PAGE 凝胶电泳(80 V×30 min;100 V×60 min)分离蛋白,湿法(100 V×120 min)转至0.45 µm NC 膜.含5%脱脂奶粉TBST 封闭,37 ℃缓慢摇动状态下封闭1 h.分别加入GluA1抗体(1∶1000)、GluN1 抗体(1∶1000)、SY38 抗体(1∶500)、PSD95抗体 (1∶1000)、GAPDH抗体(l∶2000)、β-Tubulin 抗体(1∶20000),4 ℃孵育过夜.洗膜,HRP-conjugated(1∶2000)室温孵育1 h,洗膜,加入ECL 发光液,曝光.采用VILBER 公司Fusion FX7 软件及ImageJ 软件对蛋白电泳条带进行分析,以条带蛋白吸光度值作为蛋白表达含量.
2.6 神经元结构参数提取及分析方法
首先为了保证每次记录到的神经元都是被太赫兹辐射过的,同时能够快速有效地找到同一个神经元.在培养皿上做了两条标记线,两条线的交点为培养皿的中心.拍摄以培养皿中心为直角坐标系的4 个象限的神经元生长发育状态.其次筛选出背景清晰,神经元密度低(可清晰观察到单个神经元的胞体和突起,并且与其他神经元没有连接)的图片.然后利用ImageView 软打开光学显微镜拍摄图片,并使用软件“测量”菜单中的任意连接曲线测量神经元突起长度,采用任意多边形测量神经元胞体面积,神经元的所有突起的总和为突起总长度.在太赫兹辐射前记录神经元发育状态,将此时的神经元胞体面积和突起总长度作为初始值.记录第一次太赫兹辐射的24 h 后神经元胞体面积和突起总长度,将其与初始值相减作为太赫兹辐射后第1 天神经元胞体面积和突起的增长值,以此类推,分别计算出太赫兹辐射后第2 天和第3 天后神经元胞体面积和突起总长度的增长值.最后将测量的同一个培养皿中的神经元参数求一个平均值,代表整个培养皿的细胞情况,并作为一个样本值.
2.7 统计学分析方法
统计分析的实验样本n=9,数据均采用平均值±均值标准误差(SEM)表示,特定情况单独说明,实验组与对照组结果的显著性分析采用独立样本t检验,统计分析通过Matlab 完成,P值小于0.05 时认为结果具有显著性差异.
3 实验结果
3.1 太赫兹辐射促进神经元胞体和突起的生长
在研究初期由于细胞培养液对太赫兹波的吸收较大,为了估计太赫兹辐射到神经元的能量以及频段范围,测量了太赫兹波穿透空培养皿和培养液后的时域和频域信号,实验结果如图1(c),(d)所示.其中图1(c)为太赫兹波穿透培养皿和培养液后的时域图,从图1(c)可以发现,太赫兹波可以透过培养皿和培养液,并且透射的太赫兹信号均有不同程度时间延迟.图1(d)为太赫兹波穿透培养皿和培养液后的频域图,图中红色曲线为太赫兹在空气中的传播特性,可以发现太赫兹系统的有效频谱范围在3 THz 以下,其中峰值功率大约集中在0.4 T Hz 左右.在太赫兹波穿过培养皿后,透射太赫兹波的频率范围为0.3—3 T Hz,并且主要能量集中在0.3—1 T Hz.其频谱曲线如图1(d)中紫色所示,所以大致可以估计出辐射到神经元上的太赫兹波频段有效范围大致为0.3—3 T Hz.因此,实验中认为主要研究0.3—3 T Hz 这个频段的太赫兹波对神经元生长发育的影响.在太赫兹波透过空培养皿后,其频谱曲线(紫色)相较于红色、绿色和蓝色波动较大.在培养皿中加入培养液,发现太赫兹波仍可以穿过,但是培养液对太赫兹波衰减较大,并且与加入培养液容量呈现出正相关.
为了研究太赫兹辐射对神经元生长发育的影响,选择神经元胞体面积和突起总长度作为统计分析量,主要统计分析了4 d 的神经元生长发育状态,其中第1 天是太赫兹辐射前1 天的神经元,剩余3 d为太赫兹辐射3 d 内神经元发育状态,实验结果及统计分析如图2 所示.为了监控实验过程中神经元发育状态,拍照记录了神经元发育过程,结果如图2 所示.可以发现对照组和太赫兹组在太赫兹辐射1 d 后神经元突起开始生长,并在第2 天后神经元的一个突起出现快速增长,显示出神经元的特性,在太赫兹辐射结束后神经元依旧发育良好,为免疫印迹实验提供了很好的样本.
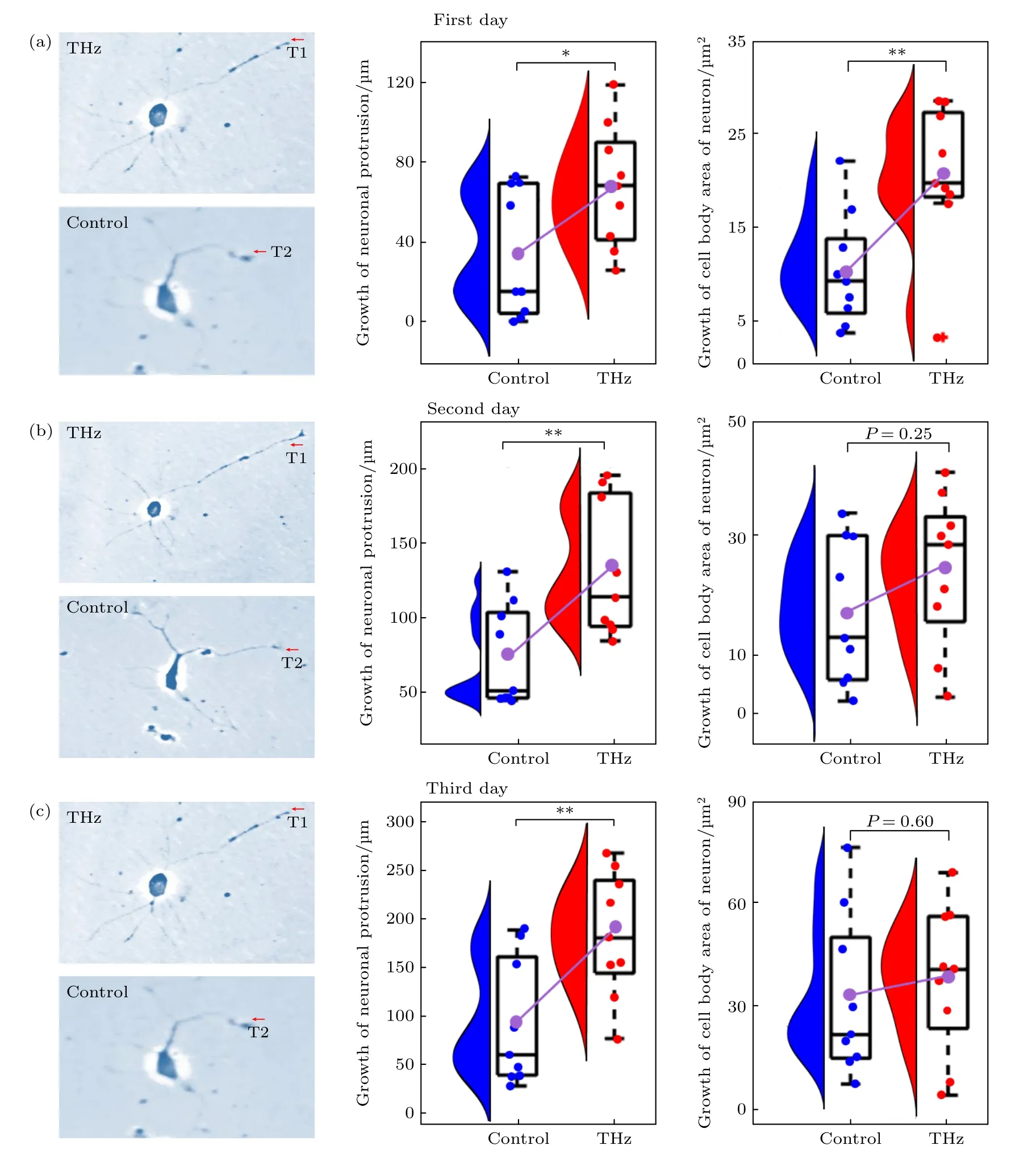
图2 太赫兹辐射前后神经元的胞体面积和突起总长度变化 (a)太赫兹辐射1 d 后对照组和太赫兹组神经元生长发育状态;(b)太赫兹辐射2 d 后对照组和太赫兹组神经元生长发育状态;(c)太赫兹辐射3 d 后对照组和太赫兹组神经元生长发育状态(t 检验显著性差异: p<0.05,*;p<0.01,**)Fig.2.Changes in cell body area and total neurite length of neurons before and after terahertz radiation: (a) The growth and development status of neurons in the control group and the terahertz group after 1 d of terahertz radiation;(b) the growth and development status of neurons in the control group and the terahertz group after 2 d of terahertz radiation;(c) the growth and development status of neurons in the control group and the terahertz group after 3 d of terahertz radiation(significance of t-test: p<0.05,*;p<0.01,**).
神经元的胞体是神经元代谢和营养中心,与神经元的存活和发育息息相关,因此统计分析了太赫兹辐射前后神经元胞体面积的增长量,统计分析方法参照2.6 节和2.7 节,统计结果如图2 所示.
在对照组中随着时间的延长,神经元胞体面积的增长值也在不断增大,也就是说神经元胞体面积的增长值随着时间的延长在不断提高,在太赫兹组中也发现了同样的现象.并且发现在第1 天中太赫兹组神经元胞体面积的增长值((20.5 ± 2.6) μ m2)显著高于对照组的增长值((10.3 ± 2.0) μ m2).在第2 天和第3 天太赫兹组都高于对照组,但是统计结果并不显著.为了分析太赫兹辐射时间对神经元胞体面积增长值的影响,分析第1 天到第3 天太赫兹组和对照组胞体面积增长值的差值,结果如图3(a)所示.太赫兹组和对照之间的差值随着时间的延长在不断减小.

图3 太赫兹辐射时间与神经元胞体面积和突起总长度的相关性 (a)对照组和太赫兹组神经元胞体面积增长均值误差曲线;(b)对照组和太赫兹组神经元突起总长度增长均值误差曲线Fig.3.Correlation between terahertz radiation time and neuronal cell body area and total neurite length: (a) The mean error curve of neuronal cell body area growth in the control group and the terahertz group;(b) the mean error curve of the total length of neurites in the control group and the terahertz group.
神经元的突起是神经元之间信息通信的基础,是神经网络形成的关键.因此统计分析了太赫兹辐射前后神经元突起总长度的增长量,统计分析方法参照2.6 节和2.7 节,统计结果如图2 所示.在对照组中,神经元突起总长度的增长值与天数呈现出正相关,在太赫兹组中也存在相同的现象.在太赫兹辐射的第1 天太赫兹组神经元突起总长度增长值((68.9±10.2) µm)显著高于对照组((35.4±10.7) µm,在太赫兹辐射的第2 天和3 天太赫兹组((132.3±15.3) µm,(184.3.3±21.5) µm)都显著高于对照组((74.8±11.4) µm,(91.6±21.9) µm).为了研究太赫兹辐射时间对神经元突起总长度增长值的影响,分析了第1 天到第3 天太赫兹组和对照组突起总长度增长值的差值,结果如图3(b)所示.太赫兹组神经元突起长度的增长值与太赫兹辐射时间近似于线性增长,但是对照组突起总长度的增长幅度却在随着天数减小.随着时间的延长,太赫兹组和对照组神经元突起长度增长值的差值在不断变大.
3.2 太赫兹辐射提高GluA1 和SY38 蛋白的表达
为了进一步研究太赫兹辐射促进神经元生长发育的原因,提取了辐射结束后神经元中的蛋白,其中包括AMPA (α-amino-3-hydroxy-5-methylisoxazole-4-propionic acid)受体亚型GluA1、NMDA (N-methyl-D-aspartic acid) 受体亚型GluN1、突触前特异性蛋白突触素-38 (synaptophysin-38,SY-38)、突触后致密物质-95 (postsynapticdensity-95,PSD-95),利用免疫印迹技术分析太赫兹辐射对其相对含量的影响.
实验结果如图4 所示.从图4(a),(b)中可以发现,太赫兹辐射后GluA1 和GluN1 蛋白含量都有增加,辐射后GluA1 蛋白含量相较于对照组显著提高了38%;由图4(c),(d)所示,太赫兹辐射显著提高了SY-38 蛋白含量,较对照组提高了19%,但是对PSD-95 蛋白的影响并不显著.

图4 太赫兹辐射前后神经元相关蛋白表达变化 (a) GluA1 蛋白表达变化;(b) GluN1 蛋白表达变化;(c) SY38 蛋白表达变化;(d) PSD-95 蛋白表达变化 (t 检验显著性差异: p<0.05,*;p<0.01,**)Fig.4.Changes of neuron-related protein expression before and after terahertz radiation: (a) Changes of GluA1 protein expression;(b) changes of GluN1 protein expression;(c) expression changes of SY38 protein;(d) changes of PSD-95 protein expression (significance of t-test: p<0.05,*;p<0.01,**).
4 讨论
蛋白质是生命体中重要的组成部分,功能和活性在很大程度上依赖于其特定构型和构象[21].蛋白质分子是由氨基酸首尾相连缩合而成的共价多肽链,为了能够发挥其生物学功能,蛋白质会折叠成一种或多种特定的空间构象,这些构象是由许多非共价键来维持结构稳定的.例如蛋白质的二级结构主要通过氢键来维持其稳定,三级结构主要以非共价键相互作用为主,其中包括范德瓦耳斯力、氢键等[21].有研究表明,生物组织中氢键和范德瓦耳斯力能级正好位于太赫兹波段[22].这些预示着太赫兹波可以直接与蛋白质耦合诱导相干激发以产生非热效应,即激发蛋白质的非线性共振效应[14].蛋白质在发挥其作用时往往伴随着动态的构象变化[23],所以特定频率和能量的太赫兹波可以影响蛋白质的构象,进而影响蛋白质的功能[24].
在研究中发现太赫兹辐射对神经元的结构产生了影响.当用宽带微量太赫兹(频带为0.3—3 T Hz,最大辐射功率100 µ W)累计辐射神经元细胞3 d,皮层神经元中AMPA 受体亚型GluA1蛋白含量增加,并且发现突触前特异性蛋白SY-38蛋白表达也增加.但是对NMDA 受体亚型GluN1和PSD-95 蛋白表达没有显著影响,这可能与蛋白质的类型有关,不同的蛋白质的氨基酸类型、折叠和旋转的方式不同,这样就导致了蛋白质对太赫兹波的吸收和响应的差异[25].有研究发现太赫兹辐射对皮层神经元中突触相关蛋白表达无显著影响,但是却下调了PSD-95 蛋白表达[15].这种影响的差异也体现在了神经元的类型中,研究中分析了太赫兹波分别对4 个大鼠的脑区(海马、大脑皮层、小脑和脑干)中突触相关蛋白(SYN)和PSD-95 蛋白表达的影响,太赫兹辐射仅下调了海马神经元的SYN 和皮层神经元PSD-95 蛋白表达[15].太赫兹辐射功率为辐射到样本的所有光子的能量总和,所以影响着蛋白质对太赫兹波能量的吸收,不同的功率也会对蛋白质的表达产生影响[26].有研究发现,当分别用50 m W 和10 m W 的太赫兹辐射海马神经元3 d,50 m W 辐射的神经元中SYN 蛋白表达显著低于10 m W 辐射[15].同时在皮层神经元也发现太赫兹辐射功率与神经元中PSD-95 蛋白表达呈现反比[15].此外,太赫兹的辐射时间也会影响蛋白质的表达,有研究表明,用太赫兹分别对皮层神经元辐射6 min 和60 min,发现辐射60 min 神经元中的PSD-95 蛋白表达显著低于6 min 的,在提高太赫兹的辐射功率后,仍然发现了相同的现象[15].但是在更大的时间尺度下却出现了不同现象,太赫兹分别辐射皮层神经元4 d 和6 d,辐射6 d 后神经元中的SYN 蛋白显著高于辐射4 d 的神经元[27].由此可知,太赫兹波对蛋白质构象的影响因素不仅与蛋白质的类型有关,同时还与太赫兹波的辐射功率、辐射时间相关,目前的研究中并没有发现明显的规律,太赫兹辐射对蛋白质的影响规律表现出多因素复合作用.
在分析太赫兹辐射对神经元相关蛋白表达的影响机制时,多数研究将太赫兹辐射与蛋白质的构象变化建立联系,但是影响神经元中蛋白质表达的因素有很多,例如太赫兹辐射后神经元中蛋白表达与谷氨酸表达变化相关[15],也有研究发现太赫兹辐射皮层神经元后SYN 基因表达与蛋白表达变化一致[27].
在研究中发现太赫兹辐射可以促进神经元胞体和突起的增长,为了研究影响神经元结构变化在蛋白质层面的原因,在太赫兹辐射结束后,也就是第5 天,提取了神经元相关蛋白,并分析了太赫兹辐射对蛋白表达的影响,发现AMPA 受体亚型GluA1 蛋白含量增大.有研究表明,AMPA 受体介导神经元功能,并在神经元发育、突触传递、可塑性和结构重塑中起关键作用[28].此外,AMPA 受体在神经元的Ca2+通透性方面发挥重要作用[29].神经元的生长发育与胞内Ca2+的浓度高度相关,当Ca2+浓度过高或过低时,会阻碍神经元突起的生长,甚至导致神经元死亡,而合适的Ca2+可以促进突起的连续增长[30].神经元生长发育中,AMPA 受体转录物被大量的拼接和编辑,产生多种生理、物理性质不同的亚单位[29].AMPA 受体是由多个亚基组成的多异聚体结构,构成异聚体的亚基比例的不同会导致受体呈现出不同的特性[31],尤其是GluA1 和GluA2 的所占比例的大小,影响着皮层神经元AMPA 型谷氨酸受体通道Ca2+的通透性,并且发现AMPA 受体构成亚型的比例不同,神经元的反转电位也存在显著差异[29].在神经元的发育初期(体外培养3—7 d),胞内Ca2+的浓度主要受到AMPA 受体的影响[20].
目前也有一些研究更加直接地表明了太赫兹辐射对神经元Ca2+动力学的影响[32,33],采用频率为0.1 T Hz,功率密度为2.65 m W/cm2的太赫兹辐射大鼠海马神经元15—25 min,诱发了海马神经元的去极化,同时发现神经元中Ca2+浓度显著增大[34].这表明在神经元发育初期,太赫兹辐射可能通过影响AMPA 受体亚型构成比例,进而影响神经元中Ca2+的浓度,从而实现对神经元胞体和突起生长的影响.另外,突触前特异性蛋白SY-38 也参与了中枢神经元发育过程中几个重大事件,包括神经元突起延伸、神经元极性建立、突触形成以及突触维持[35].越来越多的证据表明突触素在神经元的发育中有广泛的作用,在神经元早期非分化突起延伸及其后分化为轴突与树突的过程中起重要作用[35,36].
在研究太赫兹神经生物效应时,太赫兹辐射协议的安全性是首先要考虑的问题,从物理角度来看,太赫兹辐射神经生物组织导致生物效应本质上来源于太赫兹波的热效应和非热效应.目前主要通过太赫兹辐射过程中的生物材料温度的变化来判断[37].较高的太赫兹辐射功率和较长的辐射时间会导致神经生物组织升温,导致一系列的生物效应.有研究表明,一定条件下太赫兹辐射强度增大,生物样本的温度呈线性增长[37].芝加哥伊利诺伊大学的研究人员发现当神经元在太赫兹(0.094 T Hz,3.1 W/cm2)下辐射30 min 后,细胞温度上升超过7 ℃,导致神经元的肌动蛋白结构解体,对肌动蛋白结构造成了损伤[16].也有研究表明太赫兹辐射会导致神经元生长紊乱、脱水效应(细胞体积减小)和神经元形态的损伤,细胞损伤的程度与太赫兹辐射的功率和频率有关[38].
为了尽可能降低太赫兹辐射对神经元的热效应,可以通过降低辐射功率、缩短辐射时间、采用太赫兹脉冲波来实现.Sulatsky等[39]研究了宽带太赫兹波 (0.05—1.2 T Hz) 辐射 3 min 和 5 min对鸡胚脊神经节的影响.他们在不改变其他条件的前提下,通过降低太赫兹辐射功率,来探究功率对神经节的影响规律.研究发现太赫兹辐射功率密度为928 m W/cm2时,神经元突起的生长受到抑制;但是当功率密度降低到78 m W/cm2时,太赫兹辐射促进了神经元突起的增长.这些研究表明不同的太赫兹辐射参数(频率、功率、时间)会对神经元产生损伤、抑制生长、促进生长等不同的效应[39].
本研究为了降低太赫兹辐射对神经元的热效应,采用宽带微量的太赫兹波作为辐射源(频带为0.3—3 T Hz,最大辐射功率100 µ W),并且使用短时间累计辐射的方式(3 m in/d,共3 d).实验中利用温度计(TASi,TA612A,测量精度为0.1 ℃)测量了太赫兹辐射30 min 后培养液的温度变化,发现太赫兹累计辐射30 min 后培养液的温度平均升高了0.4 ℃,并且在太赫兹辐射的前5 min 培养液温度变化大约在0.1 ℃.研究发现,在太赫兹辐射神经元的3 d 内,神经元胞体发育良好,神经突起出现快速增长,与对照组表现出了相同的发育特性,符合体外培养神经元的生长发育周期[39].因此,采用本研究的太赫兹辐射协议不会对神经元造成明显的负面作用,并且不会影响神经元的生长规律.在研究中发现太赫兹辐射第1 天后,神经元胞体面积的增长值显著高于对照组,这表明太赫兹辐射可以促进皮层神经元胞体的增长.但是有研究指出,用太赫兹(0.09—0.16 T Hz)辐射蜗牛神经元20 min 会导致脱水效应(胞体面积减小),并且该效果一直持续到了太赫兹辐射结束[38].显然本研究中并不是因为脱水效应导致的神经元胞体面积的变化.在太赫兹辐射的第2 天和第3 天神经元胞体面积的增长值都大于对照组,但是统计的结果并不显著,如图2(b),(c)所示.为此分析了第1 天到第3 天太赫兹组和对照组胞体面积增长值的差值,结果如图3(a)所示.在太赫兹辐射的第1 天,太赫兹组与对照组胞体面积的增长值的差值最大,随着辐射天数的增加,差值不断减小.这可能与体外培养神经元的发育周期相关.有研究表明,体外培养的神经元在接种后存在“潜伏期”,在这个时期细胞进行贴壁和环境适应,细胞的增长缓慢,潜伏期一般持续6—24 h[40].潜伏期结束后,细胞进入快速生长期,在这个时期细胞出现快速的增长,快速生长期一般出现在细胞接种的第2—5 天.随着培养天数的延长细胞的增长速度减缓,细胞进入成熟期[40].太赫兹辐射的第1 天刚好处于神经元接种的第3 天,细胞处于快速增长期,这时太赫兹辐射后神经元胞体增长速度显著高于对照组.
神经元的突起是神经元之间信息通信的基础,是神经网络形成的关键[41].在研究中发现太赫兹辐射的第1 天,神经元突起总长度增长值较对照组显著提高了95.5%,第2 天提高了77.0%,第3 天达到了101.2%.在分析第1 天到第3 天太赫兹组和对照组突起总长度增长的差值时发现,对照组神经元突起总长度的增长随着辐射天数的增加不断升高,但是并非线性增长,曲线斜率在不断的降低,如图3(b)中蓝色曲线所示.对照组神经元突起生长的规律与神经元突起生长规律相符,体外培养的神经元在2—4 d 内突起快速增长,并出现轴突[40],5—7 d 内突起快速发育成树突,同时轴突保持快速增长.也就是体外培养的神经元快速生长的时间在2—7 d 内,在3—6 d 内增长速度较快.在太赫兹辐射后,神经元突起总长度增长曲线如图3(b)中红色曲线所示,神经元突起总长度增长值随着辐射时间的延长呈近乎线性增长.对照组与太赫兹组神经元突起总长度增长的差值随着时间的延长,在不断的增大.以上表明,宽带微量太赫兹辐射并不会改变神经元的生长规律,太赫兹辐射促进神经元突起的增长只会出现在神经元突起的固有增长时期,并且太赫兹辐射对神经元突生长的促进作用存在累计效应.
5 结论
本研究中利用宽带微量太赫兹(频带为0.3—3 T Hz,最大辐射功率100 µ W)短时间,累计辐射(3 m in/d,共3 d)皮层神经元细胞,分析了辐射后神经元胞体面积、突起长度和蛋白表达的变化规律.结果表明: 1)本研究使用宽带微量太赫兹短时间累计辐射不会造成皮层神经元死亡,并且不会影响其生长规律;2)宽带微量太赫兹辐射可以促进皮层神经元胞体和突起的生长,但是对皮层神经元胞体和突起的影响规律不同,这可能与体外培养皮层神经元的发育周期相关,并且宽带微量太赫兹辐射对神经元突起的促进作用存在累计效应;3)宽带微量太赫兹辐射对神经元生长发育的促进作用可能与AMPA 受体亚型构成比例以及突触前特异性蛋白SY-38 表达相关.这些结果预示着特定频率和能量的太赫兹波可以发展为一种治疗或干预神经发育障碍等疾病的新型神经调控技术.

