高效液相色谱法测定饲用玉米中玉米赤霉烯酮的不确定度评定
王 露,李晓伟,冯培培,赵素勤,王继美
(河南中标检测服务有限公司,河南郑州 450000)
玉米赤霉烯酮(Zearalenone,ZEA),又称F-2毒素,是由镰刀菌属菌株产生的代谢产物,广泛存在于霉变玉米等谷物作物中,会导致畜禽出现生殖、免疫疾病,造成畜牧企业的经济损失。同时还可以通过被污染的谷类作物和动物性食品进入人体,诱发肿瘤和产生免疫疾病,给人类健康造成极大的危害[1-2]。目前世界上70%~75%玉米的用途是制作饲料,确定玉米赤霉烯酮的含量是评估饲用玉米优劣的重要依据。我国GB 13078—2017[3]规定,饲用玉米玉米赤霉烯酮含量不得超过0.5 mg·kg-1。目前玉米赤霉烯酮的测定方法主要有酶联免疫吸附法、液相色谱串联质谱法和高效液相色谱法等[4]。本文严格按照《饲料中玉米赤霉烯酮的测定 免疫亲和柱净化-高效液相色谱法》(GB/T 28716—2012)[5]操作,依据《化学分析中不确定度的评估指南》(CNAS—GL 006:2019)[6]的规定,对其检验结果的不确定度进行评估,为实验室出具的玉米赤霉烯酮检测结果的准确性提供科学依据。
1 材料与方法
1.1 材料与试剂
样品为某公司送检的饲用玉米粒,实验室制备样品完全通过1 mm试验筛;玉米赤霉烯酮标准物质溶液(浓度为 100.0 μg·mL-1)。
甲醇、乙腈(HPLC级);氢氧化钠、氯化钠、磷酸氢二钠、磷酸二氢钾、氯化钾(分析纯);一级水;玉米赤霉烯酮免疫亲和柱;玻璃纤维滤纸(直径11 cm,无荧光特性)。
1.2 仪器与设备
U3000高效液相色谱仪配有荧光检测器;多管涡旋振荡器;水浴式氮吹仪;粉碎机;高速冷冻离心机;pH计;电子天平;玻璃器皿;移液器。
1.3 实验方法
1.3.1 标准溶液配制
(1)玉米赤霉烯酮标准中间液(10 μg·mL-1)。用移液器准确移取1 mL玉米赤霉烯酮标准物质(100 μg·mL-1)置于 10 mL 容量瓶中,用乙腈溶解并定容至刻度。
(2)玉米赤霉烯酮系列标准工作液。用移液器将玉米赤霉烯酮标准中间液准确移取到容量瓶(10 mL)中,用80%乙腈水溶液稀释定容至刻度,得到20 ng·mL-1、50 ng·mL-1、100 ng·mL-1、200 ng·mL-1以及500 ng·mL-1的系列标准工作液。
1.3.2 样品处理
(1)提取。在250 mL具塞锥形瓶中,用百分之一天平称取40 g样品,加入4.0 g NaCl,80%乙腈水溶液100 mL,振荡0.5 h,过滤后用移液器移取滤液10.0 mL,再加入PBS溶液40.0 mL,用玻璃纤维滤纸过滤至滤液澄清,备用。
(2)净化(按厂家说明执行)。在免疫亲和柱上端连接10 mL注射器;移取10 mL滤液,以1~2滴/s的速度通过免疫亲和柱;加5 mL水淋洗柱子一次,弃掉流出的液体;用注射器吹干柱中水;加入2 mL甲醇以2~3滴/s的速度洗脱;将收集洗脱液55 ℃氮气吹干,用2 mL提取液(乙腈+甲醇+水,46+46+8)复溶,混匀,过0.45 μm滤膜,备用。
1.3.3 液相色谱条件
色谱柱:Syncronis C18色谱柱(250 mm×4.6 mm,5 μm);流动相:45%乙腈+46%甲醇+8%水;流速:0.8 mL·min-1;检测波长:激发波长274 nm;发射波长440 nm;进样量:20 μL;柱温:30 ℃。
1.4 数学模型
根据测定原理及方法,试样中玉米赤霉烯酮含量按式(1)计算。

式中:Pi为试样溶液峰面积值;V为样品的总稀释体积,mL;cst为标准溶液浓度,ng·mL-1;Vst为标准溶液进样体积,μL;Pst为标准溶液峰面积平均值;m为试样质量,g;Vi为试样溶液进样体积,μL。
2 结果与分析
2.1 不确定度来源分析
根据测定过程和数学模型分析,影响玉米中玉米赤霉烯酮含量的测量不确定度的因素有:①标准溶液的配制;②标准曲线的拟合;③回收率测定;④重复性测定;⑤样品称量;⑥样品的前处理操作;⑦高效液相色谱仪。
2.2 不确定度的量化与评定
2.2.1 标准溶液配制引入的相对不确定度urel-s
(1)标准物质纯度引入的相对不确定度urel-s1。玉米赤霉烯酮标准物质溶液的浓度为c=100 μg·mL-1(证书),U=1.2 μg·mL-1(k=2),则标准物质溶液引入的相对标准不确定度为
(2)标准系列工作液配制引入的相对不确定度urel-s2。该过程使用了10 mL容量瓶、20~200 μL可调移液枪和100~1 000 μL可调移液枪,按照JJG 196—2006[7]和JJG 646—2006[8]的要求,用最大允差计算不确定度,按照矩形分布考虑(表 1)。标准系列工作液配制引入的相对不确定度为
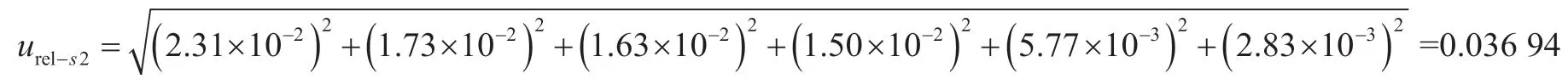
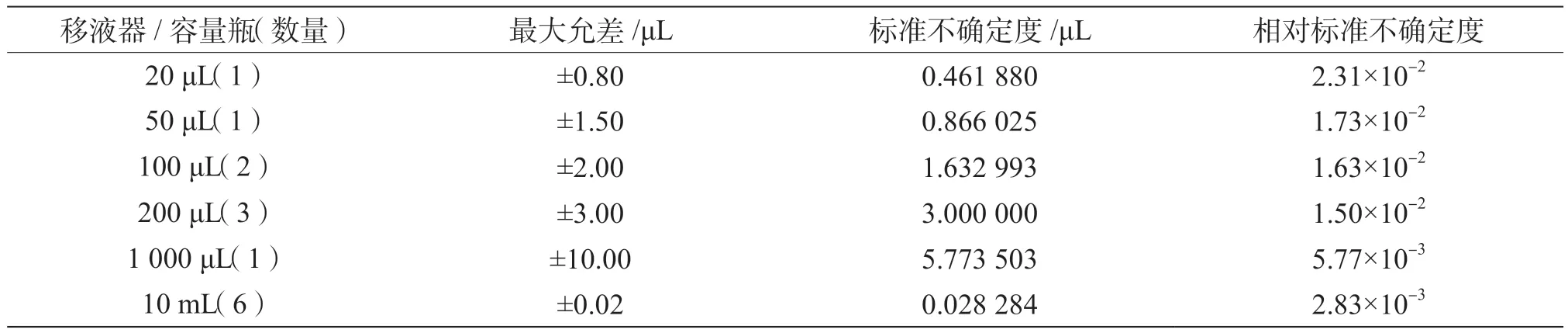
表1 配制标准溶液时移液器引入的不确定度
2.2.2 标准曲线拟合引入的相对不确定度urel-st
将配制玉米赤霉烯酮系列标准工作液的5个浓度点分别注入高效液相色谱仪,各进行2次平行测定(n=10),标准工作液浓度平均值为测定结果见表2。
采用最小二乘法拟合,绘制标准曲线。以标准工作液浓度为横坐标(X),峰面积平均值为纵坐标(Y),回归方程为Y=229.44X+997.63(a=229.44,b=997.63),线性相关系数R2=1.000 0。根据表2可以计算出标准曲线的标准偏差SR=207.994与偏差平方和SX=303 040。

表2 标准曲线各浓度的峰面积测定值(n=10)
样品重复测定6次(q=6),将测定的峰面积代入线性回归方程计算样品溶液的浓度X样,结果分别为 74.98 ng·mL-1、75.92 ng·mL-1、75.75 ng·mL-1、78.08 ng·mL-1、75.43ng·mL-1和 77.23 ng·mL-1,样液浓度平均值
综上所述,标准曲线拟合引入的标准不确定度为
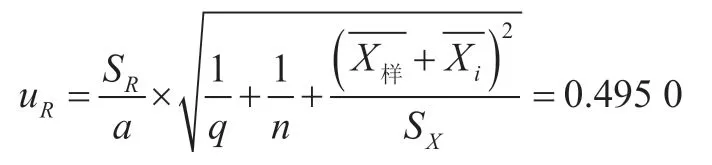
因此,由标准曲线拟合引入的相对不确定度为
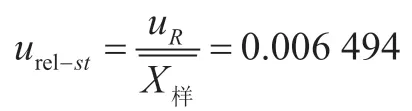
2.2.3 回收率引入的相对不确定度urel-rec
向样品中加标,添加量为50 μg·kg-1,通过前处理,并对样品进行了6次平行测定(n=6)。根据测定的峰面积,计算得到加标回收率分别为93.3%、94.1%、93.6%、94.8%、96.3%和95.2%,平均值为按照贝塞尔公式计算样品加标回收率的标准偏差为S=1.114 9。
2.2.4 重复性测定引入的相对不确定度urel-p
根据上述样品溶液浓度的测定结果,计算出样品中玉米赤霉烯酮含量C(in=6),结果为187.45 μg·kg-1、189.80 μg·kg-1、189.38 μg·kg-1、195.20 μg·kg-1、188.58 μg·kg-1和 193.08 μg·kg-1,样液浓度平均值:计算出样品重复性测定的标准偏差(贝塞尔公式)
2.2.5 样品称量引入的相对不确定度urel-m
根据国标要求,使用百分之一天平称取40.0 g样品,证书显示该天平的扩展不确定度U=0.01 g(k=2)。因此样品称量引入的不确定度um=0.005 g,其相对不确定度为urel-m=0.005÷40.0=0.000 125。
2.2.6 样品前处理引入的相对不确定度urel-d
在样品的前处理中,使用了100 mL的量筒1次,其最大允差为±1.0 mL;使用了50 mL的量筒1次,其最大允差为±0.5 mL;使用了2~10 mL的移液器2次,其最大允差为±0.12%;使用1 000 μL移液器4次,其最大允差为±1.0%。按照矩形分布考虑(),样品提取引入的相对不确定度为
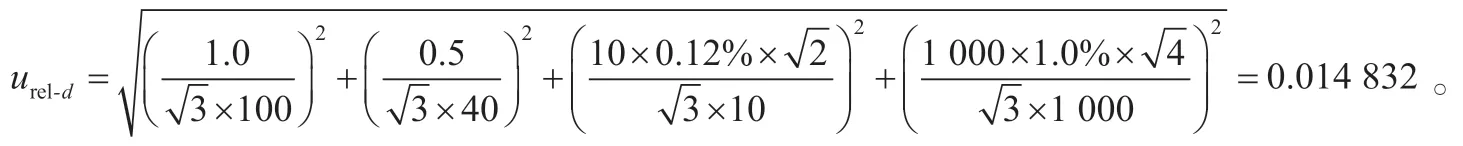
2.2.7 高效液相色谱仪操作引入的相对不确定度urel-h
使用的高效液相色谱仪,经证书查得其测量结果的扩展不确定度为6%(k=2),则高效液相色谱仪操作引入的相对不确定度为
2.3 合成不确定度ur
将各个不确定度分量及其评定结果汇总于表3,并对其进行合成,得到相对合成不确定度为

表3 相对不确定度汇总表
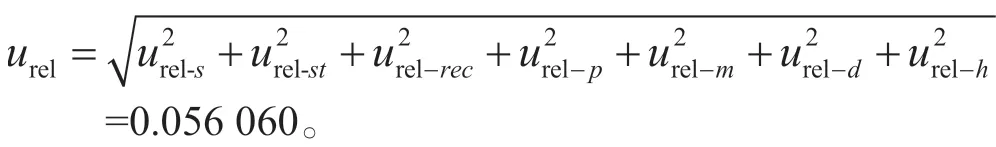
综上所述,饲用玉米中玉米赤霉烯酮(高效液相色谱法测定)的合成不确定度ur=0.056 060×76.23=4.273 45 μg·kg-1。。
2.4 扩展不确定度U
采用正态分布分析,P=95%,k=2,可得到高效液相色谱法测定饲用玉米中玉米赤霉烯酮的扩展不确定度为U=k×ur=8.55 μg·Kg-1。
高效液相色谱法测定饲用玉米中玉米赤霉烯酮的结果可表示为C=(76.23±8.55)μg·kg-1,置信水平P=95%。
3 结论
依据GB/T 28716—2012测定饲用玉米中玉米赤霉烯酮的含量,通过对各个不确定度分量的分析,其中标准溶液的配制和高效液相色谱仪的操作是影响不确定度的因素中占比最大的,分别为30.489 6%和24.437 3%,而样品称量引入的相对不确定度几乎可以忽略不计。因此,在实验室采用该方法对饲用玉米进行检测时,要在配制标准溶液时选择精密度高的计量器具,保证标准溶液配制的准确度,同时需要定期开展检定校准,保证计量器具和高效液相色谱仪精密性和稳定性,减小不确定度分量,保证检测数据的准确性和合理性[9]。

