加速溶剂萃取GC-MS 快速分析烟叶中的西柏三烯二醇
蔡长春,任晓红,冯 吉,邓建强,李章海,饶雄飞,王洪炜,杨 俊*
(1. 湖北省烟草科学研究院,武汉 430030;2. 湖北省烟草公司恩施州公司,恩施 445000;3. 中国科学技术大学先进技术研究院,合肥 230088)
许多陆生植物表面生长覆盖有单细胞或多细胞结构的腺毛组织,在植株表面形成空间障碍,作为抵御各种生物性或非生物性侵害的第一道防线[1]。烟叶表面的腺毛组织体积大,分布广,具有较强的分泌能力[2]。西柏三烯二醇(CBD)是烟叶表面腺毛分泌物的主要成分,占其腺毛分泌物的60%以上[3],该类化合物不仅是卷烟关键香味成分的重要前体物质,还具有抑制肿瘤细胞生长、抑制前列腺素形成、抑制尼古丁感受以及神经保护剂等多种生物活性[4]。烟叶CBD 类物质包含两种异构体结构的分子,分别为(1S, 2E, 4R, 6R, 7E, 11E) 西柏-2, 7, 11-三烯-4, 6-二醇 (α-CBD) 和 (1S, 2E, 4S, 6R, 7E, 11E) 西柏-2,7, 11-三烯-4, 6-二醇 (β-CBD)。在烟草生产过程中,生态条件、栽培技术、调制措施等对CBD 类物质含量的影响很大[5]。因此,建立快速、准确测定烟叶α-CBD 和β-CBD 的定量检测方法,探索CBD 类物质与烟草品质的内在联系,是烟草科技工作者关注的热点。
关于CBD 类物质的定量检测方法报道较少。2001 年,Wang 等以二氯甲烷溶剂从新鲜烟叶中提取CBD,提取得到的CBD 经三甲基硅烷衍生化处理,用气相色谱质谱联用技术(GC-MS)对目标物质进行半定量分析[6]。GC-MS 也是目前我国烟草行业检测CBD 的推荐标准方法[7]。2016 年,Zhou 等改进了CBD的衍生化条件,实现了α-CBD和β-CBD的定量检测[8]。近年来,付秋娟[9]和郑庆霞[10]等采用超高压液相色谱法、气相色谱串联质谱法发展了α-CBD 和β-CBD 的检测方法,但方法中所用仪器尚不普及,样品前处理技术仍需要改进。另外,样品定量分析过程中的取样和样品前处理环节所需时间约占总分析时间的60%以上,对复杂基质样品分析结果的准确性有很大影响[11]。加速溶剂萃取(ASE)可使萃取溶剂处于高温高压状态下对目标成分进行萃取[12]。对比传统的液固萃取(LSE)[13]、索氏提取(SE)[14]、超声辅助萃取(UAE)[5,15]等方法,ASE 具有省时、省力、简便、节约溶剂、提高萃取效率、改善重现性和便于批量自动化操作等诸多优点[16],已广泛应用于土壤、水果、蔬菜等复杂基质中目标成分的萃取[12,17]。同时,ASE 也已被应用于烟草中糖酯[18]和甾醇[19]的提取。本研究通过优化ASE 萃取烤后烟叶CBD 的工作条件,减少萃取时间。采用气相色谱-质谱-选择离子检测模式(GC-MS-SIM)进行定性定量检测,消除了复杂样品基质的干扰。研究建立ASE-GC-MS 测定烟叶α-CBD 和β-CBD 方法,为烟叶中CBD 快速、准确检测提供技术支持。
1 材料与方法
1.1 材料、试剂和仪器
材料:烤烟烟叶样品由湖北省烟草科学研究院提供,取自2019—2020 年度湖北、云南和贵州3地的不同产区,品种为云烟87。烟叶经50 ℃烘干,研磨过 60 目筛,混合均匀后4 ℃冷藏,备用。
试剂:标准品α-CBD(10 mg)、β-CBD(10 mg)(美国LKT Laboratories 公司,纯度均为98%)。内标物 (IS) 正十九烷(美国A Johnson Matthey 公司,纯度为99%)。衍生化试剂双(三甲基硅烷基)三氟乙酰胺(BSTFA)(内含1% 三甲基硅烷咪唑,TMCS)(日本东京化成工业株式会社公司)。二氯甲烷为色谱纯(天津市津东天正精细化学试剂厂)。吡啶,丙酮,乙酸乙酯均为分析纯(上海凌峰化学试剂有限公司)。
仪器:Thermo ISQ GC/MS 气相色谱-质谱联用仪 ( 意大利ThermoFisher 公司),DB-5MS 毛细管柱( 30 m×0.25 mm×0.25 μm ) (美国Agilent 公司) ,ASE 300 加速溶剂萃取仪(美国Dionex 公司),MilliQ 超纯水仪(美国Millipore 公司),HY-2A 数显多用振荡器(金坛荣华机械制造有限公司),S7500 超声仪(上海Brandson Ultrasonics 公司),AL204-2C 电子分析天平(Mettler Toledo 公司),旋转蒸发仪(上海亚荣生化仪器厂)。
1.2 方法
1.2.1标准溶液的配制 CBD 标准溶液的配制:用二氯甲烷分别溶解10 mgα-CBD 和10 mgβ-CBD,然后转移到10 mL 容量瓶中,用二氯甲烷稀释至刻度,此溶液即为α-CBD 和β-CBD 的标准溶液(浓度均为1.0 mg·g-1)。
内标溶液的配制:准确称取250 mg 的内标正十九烷置于50 mL 容量瓶中,用二氯甲烷稀释至刻度,即为内标溶液(浓度为5.0 mg·g-1)。
衍生化溶液配制:准确移取10 mL 双(三甲基硅烷基)三氟乙酰胺(BSTFA)(内含1% TMCS)至25 mL 容量瓶中,用吡啶溶剂定容至刻度。
1.2.2标准曲线的绘制 分别移取1、50、100、150和200 μL 的α-CBD 标准溶液至2 mL 的色谱瓶中,再分别加入200 μL 的内标液。分别移取1、40、80,120 和160 μL 的β-CBD 标准溶液至2 mL 的色谱瓶中,再分别加入200 μL 的内标液。蒸干溶剂后,往色谱瓶中加入1 000 μL 的衍生化溶液。
对以上两组标准溶液进行衍生化反应,然后用GC-MS 方法进行测定,并以浓度为横坐标,目标分析物峰面积与内标物峰面积比(A/AIS)为纵坐标分别绘制α- CBD 和β- CBD 的标准曲线。
1.2.3 烟叶CBD 的萃取 以ASE 方法萃取[18],采用34 mL 的ASE 萃取池,在萃取池底部加入5 g 无水硫酸钠,再加入0.5 g 烟叶样品,最后在上层加5 g 无水硫酸钠。ASE 条件选择萃取剂为二氯甲烷,萃取温度50 ℃,压强1 500 psi,静态萃取时间5 min,预热时间5 min,循环次数2 次。萃取液转移至100 mL 容量瓶内,定容。
作为ASE 方法的对照,试验中采用了其他3 种不同萃取方法对烟叶CBD 化合物进行了提取。第一,液固萃取法(LSE)[6]。称取0.5 g 烟样于50 mL的锥形瓶中,加入25 mL 的二氯甲烷,以机械振荡器进行振荡萃取2 h;将提取液过滤并转移至100 mL 容量瓶内(滤纸上放无水硫酸钠10 g),其中,锥形瓶、滤纸等均用二氯甲烷冲洗3 次以上,定容。第二,索氏提取法[19]。称取0.5 g 烟样,以60 mL的二氯甲烷浸润并进行索氏提取,提取温度为50 ℃,提取时间为2 h,定容至100 mL。第三,超声辅助萃取法(UAE)[5]。称取0.5 g 烟样于50 mL的锥形瓶中,加入25 mL 的二氯甲烷,超声10 min。将提取液过滤并转移至100 mL 容量瓶内(滤纸上放无水硫酸钠10 g),其中,锥形瓶、滤纸等均用二氯甲烷冲洗3 次以上,定容。
1.2.4 衍生化过程 移取10 mL 烟叶提取液,加入200 μL 内标液,在70 ℃的条件下水浴蒸发去除溶剂。加入1 000 μL 衍生化溶液,洗涤样品瓶器壁,将所得溶液转入色谱瓶。在20 ℃环境中进行衍生化反应100 min,得到GC-MS 的分析溶液[8]。
1.2.5 GC-MS 条件 GC 条件设置进样口温度为250 ℃,进样量为1 μL;载气为He,流速为1.2 mL·min-1;进样方式为不分流进样。柱温箱的升温程序确定为起始温度160 ℃保持2 min,后以10 ℃· min-1升到210 ℃保持35 min,再以10 ℃· min-1升到250 ℃保持15 min。MS 条件设置传输线温度为250 ℃,离子源温度为280 ℃,电离源为EI,电离能为70 eV,溶剂延迟为7 min。本试验中质谱的扫描模式有2 种:目标成分的定性检测采用全扫模式,扫描范围为m/z 40~600 amu;目标成分的定量检测采用SIM 模式,每种目标物选择1 个定量离子,3 个定性离子。其中,衍生化后的α- CBD、β-CBD 以及内标物的特征扫描离子列于表1。

表1 目标物质的保留时间、定性离子及定量离子Table 1 Retention time of analytes and ions for qualification and quantification
2 结果与分析
2.1 ASE 萃取条件优化
2.1.1 萃取方法对比 传统的液固萃取法(LSE)一直是烟草样品中西柏三烯醇类物质最常用的萃取方法[6,8]。超声辅助萃取(UAE)[5,9]和索氏提取法( SE )[19]也已用于植物中双萜烯衍生物的提取。加速溶剂萃取法(ASE)具有较高的萃取效率和良好的重现性[18]。本文比较了4 种不同萃取方法(LSE、UAE、SE 和ASE)的萃取效果,并将结果示于图1。由图1 可知,对α-CBD 而言,LSE、SE、UAE和ASE 4 种不同的样品前处理方法得到的萃取率,以最高GC-MS 相对丰度来表示,分别为5.31×109、4.86×109、5.68×109和5.89×109个单位,ASE 的萃取率最高;对β-CBD 而言,LSE、SE、UAE 和ASE 4 种方法的萃取率分别为2.03×109、1.96×109、2.08×109和2.16×109个单位,4 种方法的萃取率相差不大,ASE 的萃取率仍是最高。ASE 原理是基于高温和加压条件下[20],通过促进溶剂渗透、增大溶质扩散效率和物质溶解度来提高萃取的效率,故而与传统的萃取方法相比,ASE 具有萃取速度快、溶剂用量少、萃取效率高、使用方便、操作安全且易于自动化萃取等优点。因此,本研究选择ASE 作为烟叶样品中西柏三烯醇类的萃取方法。
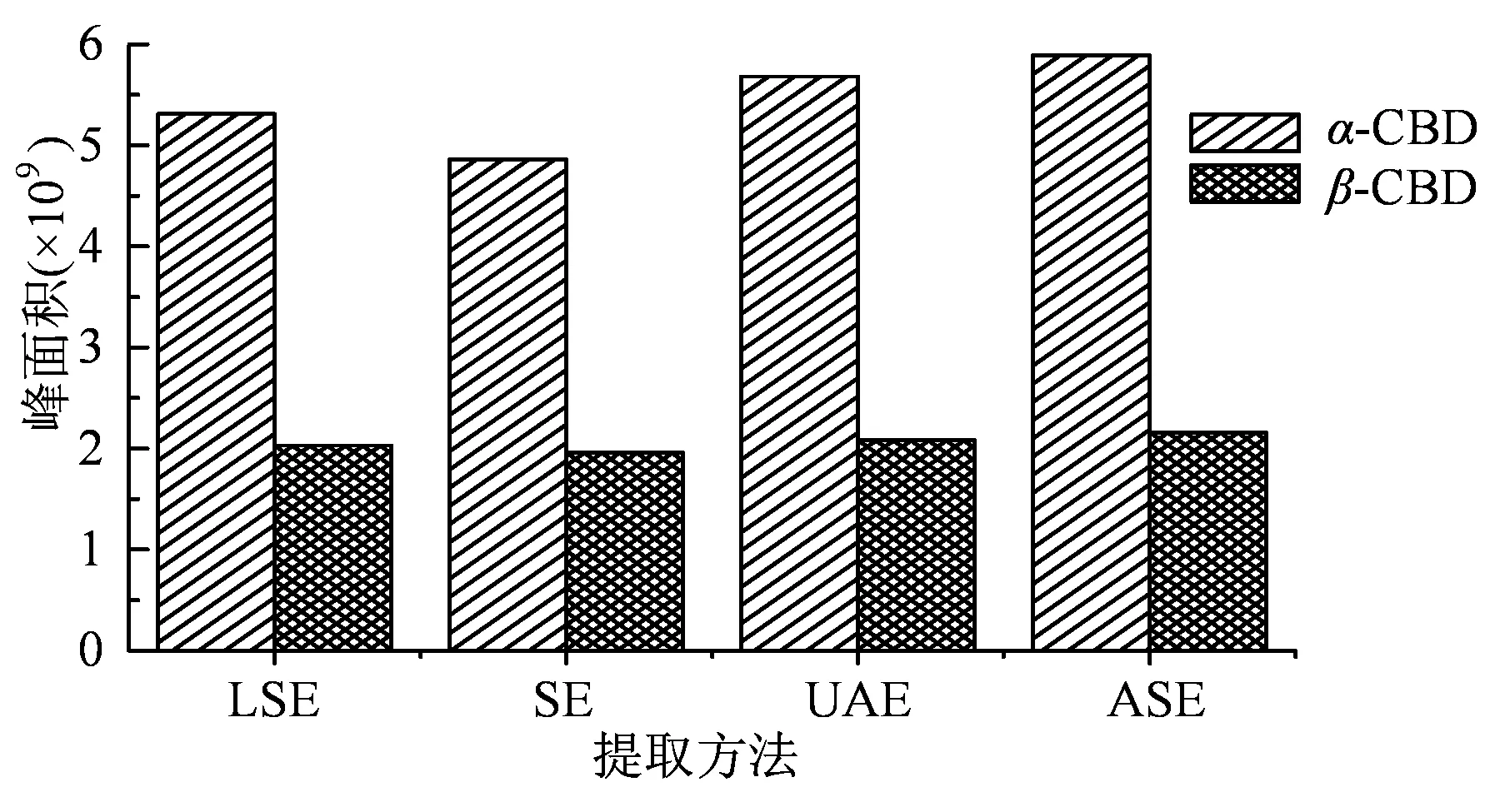
图1 不同萃取方法对烤烟中西柏三烯二醇萃取效果的影响Figure 1 Effects of extraction methods on CBDs from tobacco leaves
2.1.2 ASE 工作参数优化 影响ASE 萃取效率的因素主要包括萃取溶剂、萃取温度、静态萃取时间和循环次数等。萃取剂是影响ASE 萃取效率最重要的因素[18]。根据常用溶剂的性质,我们考察了二氯甲烷、丙酮和乙酸乙酯作为萃取剂对α-CBD 和β-CBD 的提取率。结果(图2(a))显示,作为提取烟叶表面腺毛分泌物最常用的溶剂,二氯甲烷、丙酮、乙酸乙酯对α-CBD 的提取率分别为5.79×109、5.05×109和5.24×109个单位,对β-CBD 的提取率分别为2.20×109、1.97×109和1.88×109个单位,二氯甲烷对α-CBD 和β-CBD 的提取率皆最高。主要是由于二氯甲烷的极性适中,与西柏三烯二醇中的十四元大环和羟基皆具有较好的亲和力。因此,本研究选择二氯甲烷作为萃取剂。
由于萃取温度对萃取动力学和溶剂黏度均有影响[21],本文对温度进行了优化,考察的ASE 温度区间为40~110 ℃。由图2(b)可知,当萃取温度由40 ℃升高到50 ℃时,萃取效率有明显的增加;但当温度由50 ℃升高到110 ℃时,萃取效率反而有所下降。这主要是由于温度的适度升高可以促进溶质的溶解和溶剂的渗透,且溶质的传质扩散速率得到了提高[21]。然而,随着温度的继续升高,目标成分可能更容易发生降解反应,同时杂质可能更易溶解到萃取剂中,从而共同导致了萃取效率的下降。所以,本试验选择的萃取温度为50 ℃。
本试验也考察了静态萃取时间分别为3、5 和10 min 对萃取效率的影响。结果(图2(c))显示,静态萃取时间由3 min 升高至5 min 时,萃取效率有明显提高,这是由于较长的萃取时间可以使溶质的扩散过程更为完全[21]。而继续增加静态萃取时间,不仅增加了前处理的时间,而且也可能会导致更多杂质的溶解。所以,本文最终选择静态萃取时间为5 min。实验最后考察了循环次数(1 次、2 次和3 次)对萃取效率的影响,结果(图2(d))显示在循环次数由1 次增加到2 次时,萃取效率明显增加。为了节约萃取时间和萃取剂用量,所以选择循环2 次。

图2 ASE 参数对烤烟中CBD 萃取率的影响Figure 2 Effects of ASE factors on extraction efficiency of cembranoids from flue-cured tobacco leaves
因此,本研究最终选择的ASE 工作参数是:萃取剂为二氯甲烷,萃取温度为50 ℃,压强为1 500 psi,预热时间为5 min,静态萃取时间为5 min,循环次数为2 次。
2.2 方法验证
2.2.1 方法的线性范围、检出限(LOD)和定量限(LOQ) 定量分析时所用的质谱扫描模式为SIM模式,图3(a)为标准样品的色谱图,其中15.93、31.32和35.20 min 所对应色谱峰的物质分别为内标正十九烷,衍生化后的两种目标物α-CBD 和β-CBD。对谱图上的目标峰进行积分,以目标分析物峰面积与内标物峰面积比(A/AIS)与被测目标物浓度(C)作标准曲线,以S/N分别等于3 和10 时计算检出限(LOD)和定量限(LOQ)。结果(表2)表明,目标成分α-CBD 和β-CBD 的线性关系良好,线性范围分别为1 ~ 200 μg·g-1和1 ~160 μg·g-1,相关系数(R)分别为0.999 2 和0.999 6。两种目标物的LOD和LOQ 分别为0.3 μg·g-1、0.2 μg·g-1和0.85 μg·g-1、0.66 μg·g-1。

表2 α-CBD 和β-CBD 的标准曲线、线性范围、检测限和定量限Table 2 Standard curves, linear ranges, detection limits and quantitation limits of α-CBD and β-CBD
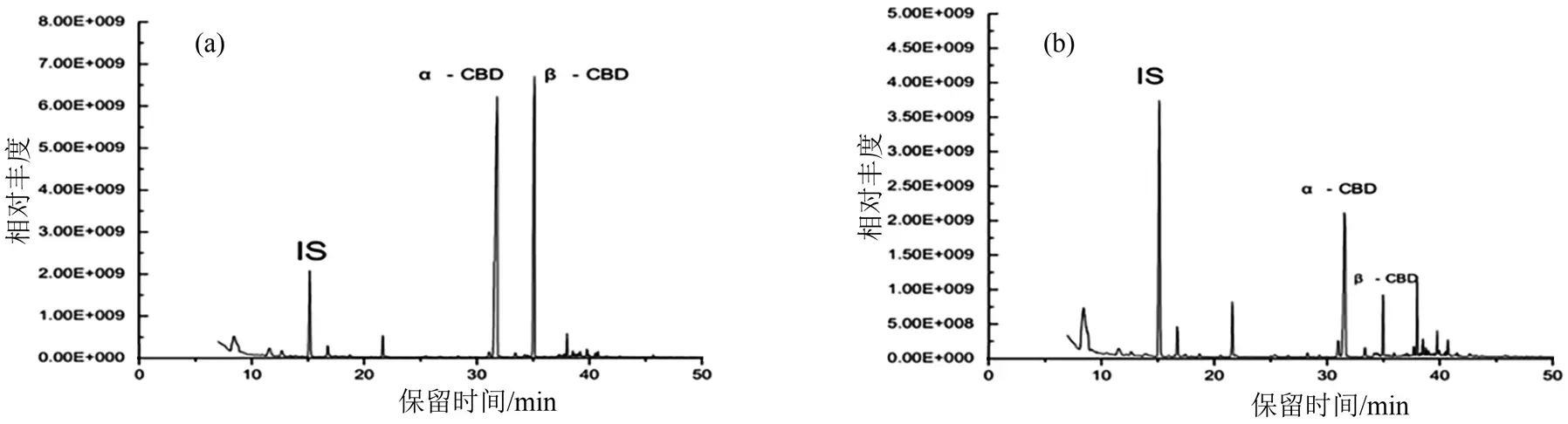
图3 样品的色谱图Figure 3 Chromatogram of CBDs
2.2.2 方法的回收率和精密度 为了验证本方法的准确性和精密度,分别对湖北恩施上部烟、中部烟和下部烟3 个不同部位的烤烟样品做了3 个浓度的加标回收实验,且重复测定3 次。精密度实验每组重复测定5 次,以相对标准偏差(RSD)表示。结果(表3)显示,α-CBD 和β-CBD 的回收率分别在93.2% ~ 103.3%和91.6% ~ 99.1%之间。RSD 值(n=5)分别在2.59% ~ 3.13% 和2.11% ~ 2.84%范围内。结果表明,方法的准确性好,精密度高,适用于烟叶样品中CBD 含量的测定。
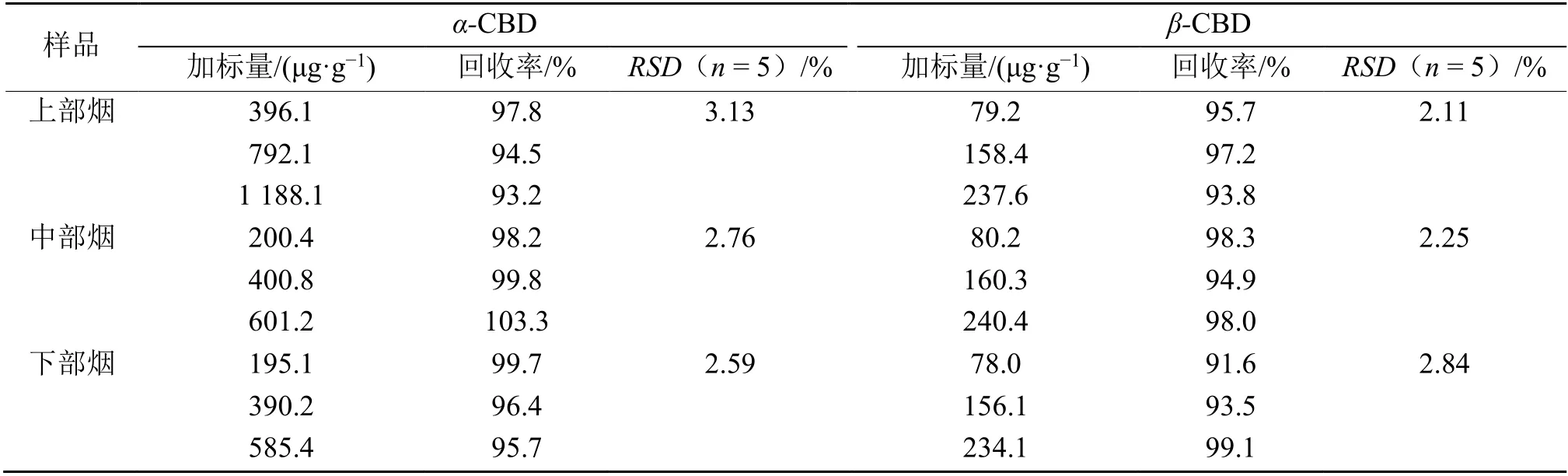
表3 方法的回收率和精密度Table 3 Recoveries and repeatability of the method
2.3 实际样品分析
采用本方法对云南、湖北、贵州3 个不同产区的烤后烟叶样品进行了分析,样品定量分析色谱图见图3(b)。不同烟叶样品α-CBD 和β-CBD 的检测结果(表4)表明,α-CBD 和β-CBD 因烟叶部位、产地的不同而存在明显差异。同一地区的烟叶样品,上部叶α-CBD和β-CBD含量显著高于中部烟和下部烟,中部烟α-CBD 和β-CBD 含量略高于下部烟。不同地区的烟叶样品对比,贵州遵义烟叶样品α-CBD和β-CBD 含量均高于云南和湖北的样品烟叶,云南的烟叶样品略高于湖北。对于同一烟叶样品,α-CBD含量高于β-CBD 约2 ~ 4 倍。需要指出的是,本结果不包含因生态变化和降水量变化[22]等对烟叶西柏三烯醇类含量的影响。

表4 样品中α-CBD 和β-CBD 的检测结果Table 4 Measurement results of α-CBD and β-CBD of thetobacco samples
3 结论
将ASE 方法与GC-MS-SIM 检测相结合,发展了烤烟烟叶中西柏三烯二醇的准确定量方法。ASE萃取效率高、重现性好。烟叶样品中α-CBD 和β-CBD 经 ASE 提取和衍生化处理后,用GC-MS-SIM 进行定性定量检测,可消除复杂基质干扰,有效提高分析方法的选择性和灵敏度。该方法适用于烟草样品中西柏三烯醇类化合物的快速、准确检测。烟草西柏三烯醇类成分的组成和含量差异是不同类型烟叶香吃味品质的重要化学物质基础。本研究可为优质烟叶的生产以及烟草西柏三烯醇类成分的高附加值开发利用提供研究支撑。

