海马小胶质细胞活化介导慢性应激诱导缺血性脑卒中大鼠抑郁样行为的研究
陶 希,杨 晨,唐文静,4,伍思源,邓景贵,3*
1 湖南师范大学附属第一医院(湖南省人民医院),湖南长沙 410016;2 湖南师范大学神经修复学湖南省重点实验室,湖南长沙 410016;3 湖南省脑血管病康复临床医学研究中心,湖南长沙 410016;4 湖南省康复医院,湖南长沙410003
卒中后抑郁(post-stroke depression,PSD)是脑卒中后继发性情感障碍的一种,表现为快感减少、兴趣缺乏、情绪低落、无价值感及睡眠障碍等[1],患病率28.00%~50.24%[2]。PSD不仅影响患者的生活质量,而且增加卒中复发风险,甚至增加致残率和病死率[3]。
现实中,脑卒中患者常常暴露于不同应激状态中。如急性期,疾病本身的躯体应激、监护室内声光刺激、管道刺激及约束带约束等;恢复期,虽然与生命支持相关的管道刺激减少,周围环境有所改善,但是患者对自身的躯体状况、言语功能、吞咽功能、生活压力及社会地位等相关感知更为清晰,这会带来躯体和心理的双重打击。尽管各项功能恢复可能会进入平台期,对疾病转归的认知会有所改变或接受,但是仍有一部分患者难以回归家庭和社会。持续的孤立感及长期的心理应激等因素,致使部分患者终身处于抑郁状态。所以,卒中后各种不利环境和功能障碍可能是一种持续的慢性应激,不仅促进PSD 的发生,还可能严重影响其他功能障碍的预后。
然而,PSD的病理、生理学机制尚不明确。除固有的内源性生物学因素外,外源性的环境和躯体应激也是不可忽略的重要因素。研究发现,小胶质细胞活化在介导2 种因素条件下的中枢免疫-炎症机制中扮演重要角色[4]。当血管神经单元受到缺血、缺氧或炎症因子刺激时,静息的小胶质细胞通过突触感知微环境变化而被激活,然后形成吞噬性阿米巴样细胞[4-5]。根据应激的不同程度和持续时间,极化状态的小胶质细胞可分泌促炎性细胞因子(如IL-6、TNF-α 和IL-1β)和/或抗炎性细胞因子(如IL-10、IL-4 和TNF-β),从而介导抑郁症状的发生和发展[4]。课题前期研究发现,慢性应激不仅可以激活额叶和纹状体小胶质细胞表达增加[5],还可以降低海马抗炎因子TGF-β1 表达[6]。但是,缺少对海马小胶质细胞及炎症反应的动态观察。本研究弥补既往研究中的不足,以期为PSD 患病机制及潜在干预措施提供支持信息。
1 实验材料
1.1 实验动物
健康雄性SD 大鼠75 只,体质量250~280 g,由湖南斯莱克景达有限公司提供[许可证号:SYXK(湘):2020-0017]。大鼠运送至动物中心后,在恒定温度、湿度及光线条件下适应性饲养1周,期间自由进食和饮水。本研究获得湖南省人民医院动物伦理委员会批准(审批号:202102)。
1.2 主要仪器和试剂
SDS-PAGE 电泳系统、显影仪及Image lab 软件(Bio-Rad,美国);荧光显微镜(Olympus,日本);高速低温离心机(湖南湘仪集团);栓线(北京西浓);4%多聚甲醛(武汉赛维尔);2%TTC 溶液(北京索莱宝);RIPA(江苏凯基);Iba-1 一抗(小鼠抗大鼠,美国Thermo Fisher);IL-1β 一抗(兔抗大鼠,美国Affinity);IL-18(兔抗大鼠,美国Affinity);GAPDH一抗(兔抗大鼠,美国Affinity);IgG 二抗(羊抗小鼠,中国Biosharp);IgG 二抗(羊抗兔,中国Biosharp);DAPI染色液(中国Wellbio)。
2 实验方法
2.1 动物分组
适应性饲养1 周后,构建大鼠右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。造模术后1 周,根据SPSS 随机数字生成器将大鼠分布至卒中组(n=45)和“卒中+应激”组(n=30)。然后,再根据时间点要求将卒中组大鼠分成卒中1 周组(n=15)、卒中2 周组(n=15)及卒中4 周组(n=15),将“卒中+应激”组大鼠分成“卒中2 周+应激1 周”组(简称“应激1 周组”,n=15)和“卒中4周+应激3周”组(简称“应激3周组”,n=15)。
2.2 动物造模
2.2.1 MCAO造模 参考课题组前期研究并改良[5],以线栓法构建右侧MCAO模型,缺血时间70 min。
2.2.2 慢性不可预见的温和应激造模 在MCAO造模的基础上,以慢性不可预见的温和应激(chronic unpredictable mild stress,CUMS)结合孤养的方法构建PSD 模型。包括:①昼夜颠倒36 h;②禁水18 h;③禁食20 h;④潮湿环境12 h;⑤45°倾斜笼子17 h;⑥水平振荡5 min;⑦噪音刺激10 min;⑧夹尾巴1 min;⑨4 ℃冷水强迫游泳5 min;⑩空间限制2 h。将前5 个“长时程”之一联合后5 个“短时程”之一,每天以2种方法随机刺激卒中大鼠,共3周。MCAO术中/术后、CUMS 过程中大鼠死亡以及无行为学评分变化的大鼠,均视为造模失败,以同一批次的大鼠补充造模。
2.3 神经功能缺损评分
MCAO 术后12 h 采用Longa 法行神经功能缺损评分[6]。0 分:无缺损;1 分:不能伸展左侧前爪;2分:向左侧转圈;3分:向左侧倾倒;4分:不能行走,或意识丧失。其中,0分和4分者被剔除。
2.4 观察指标
2.4.1 体质量测量及行为学评定
2.4.1.1 体质量测量 MCAO 术后1 周、2 周及4 周分别测量体质量。
2.4.1.2 旷场试验 旷场试验(open filed test,OFT)是在弱光线且安静的环境下,将大鼠放入箱内中央,观察10 min内的活动情况:①水平运动,以横穿箱子底面的格子数(4爪均入格)计数;②垂直运动,以前爪抬起直立次数计数[1]。
2.4.1.3 新奇抑制摄食测试 新奇抑制摄食测试(novelty-suppressed feeding test,NSFT)[1]是将大鼠禁食16 h,置于一笼内进行测试,3 块新鲜饼干以白纸垫托并置于笼中间,记录大鼠进食第一口食物所需时间(潜伏期),记录10 min 内食物消耗量;若5 min内未进食则视潜伏期为5 min。
2.4.1.4 蔗糖偏爱测试 蔗糖偏爱测试(sucrose preference test,SPT)在第1 天予2 瓶1%蔗糖水,第2 天予蔗糖水和纯水各1 瓶;评定前禁食禁水12 h,评定时蔗糖水和纯水各1瓶,记录12 h各自消耗量。通过公式计算出蔗糖偏爱指数(sugar preference index,SPI)。
蔗糖偏爱指数=[(糖水消耗量/(糖水消耗量+纯水消耗量)]×100%在卒中后1 周、2 周及4 周,按OFT、NSFT、SPT顺序评分。遇争议问题需2人协商解决[1]。
2.4.2 TTC 染色检测残存脑体积 于各时间点,每组取大鼠(n=5)以10%水合氯醛(350 mg/kg)腹腔注射麻醉。取新鲜脑于-20 ℃冷冻5 min,从额极等距离分割5 等份,再以2%TTC 染色液室温封闭20 min。等距手机拍照,采用Image J 软件分析图片,以健侧大脑为对照,计算大鼠患侧脑萎缩面积,再结合脑片厚度及层数计算脑萎缩或梗死体积。
患侧残存脑体积比=(健侧大脑半球体积-患侧脑萎缩体积)/健侧大脑半球体积×100%
2.4.3 Western blot检测Iba-1、IL-1β及IL-18 分别于MCAO术后1周、2周及4周时,各组取大鼠(n=5)以10%水合氯醛腹腔麻醉处死。取-80 ℃保存的海马组织以RIPA 裂解液充分裂解,冰上超声处理,于4 ℃以12 000 r/min 离心15 min,收集上清液。以A280 紫外光吸收法测蛋白浓度。SDS-PAGE 分离蛋白,再转膜及封闭。将膜与Iba-1单抗(1∶3 000)、IL-1β 多抗(1∶1 000)或者IL-18 多抗(1∶1 000)结合,4 ℃孵育过夜;再与二抗(1∶3 000)室温孵育1 h。GAPDH(1∶10 000)作为内参。以Image lab 软件分析条带灰度值。
2.4.4 制作石蜡切片及免疫荧光染色检测Iba-1 分别于MCAO术后1周、2周及4周时,各组取大鼠(n=5)以10%水合氯醛腹腔麻醉,再以4 %多聚甲醛心脏灌注。取鼠脑于4%多聚甲醛在4 ℃冰箱固定过夜。石蜡包埋,5 μm 厚度连续切片。二甲苯及梯度乙醇脱蜡后行热修复抗原,于10%山羊血清封闭。于4 ℃与Iba-1一抗(1∶50)孵育过夜,再以绿色荧光标记的二抗(1∶100)于37 ℃孵育。DAPI 工作液染核。甘油封片。计算CA1区视野荧光强度值。
2.5 统计学方法
采用SPSS 24.0 软件进行统计分析。所有计量资料采用()表示,2 组间的数据比较采用独立样本t检验;不同时间点(指代3组间)数据的比较采用单因素方差分析(事后比较采用Tukey)。以P<0.05认为差异有统计学意义。
3 结果
3.1 5组大鼠体质量与行为学评分比较
3.1.1 5 组大鼠体质量比较 MCAO 术后2 周时,与卒中2 周组比较,应激1 周组大鼠体质量下降(P<0.05)。MCAO 术后4 周时,与卒中4 周组比较,应激3周组大鼠体质量下降更为明显(P<0.05)。见表1。
3.1.2 5 组大鼠OFT 比较 MCAO 术后2 周时,与卒中2 周组比较,应激1 周组大鼠直立运动次数和穿格子数减少(P<0.05)。MCAO 术后4 周时,与卒中4周组比较,应激3周组大鼠直立运动次数和穿格子数减少更为明显(P<0.05)。见表1。
3.1.3 5 组大鼠NSFT 比较 MCAO 术后2 周时,与卒中2 周组比较,应激1 周组大鼠NSFT 潜伏期和摄食量变化不明显(P>0.05)。MCAO 术后4 周时,与卒中4 周组比较,应激3 周组大鼠NSFT 潜伏期明显延长(P<0.05),摄食量明显减少(P<0.05)。见表1。
3.1.4 5 组大鼠SPI 比较 MCAO 术后2 周时,与卒中2周组比较,应激1周组大鼠SPI下降不明显(P>0.05)。MCAO 术后4 周时,与卒中4 周组比较,应激3周组大鼠SPI明显下降(P<0.05)。见表1。
表1 5组大鼠体质量与行为学评分比较(,n=15)Table 1 Comparison of body weight and behavioral scores of rats in five groups(,n=15)
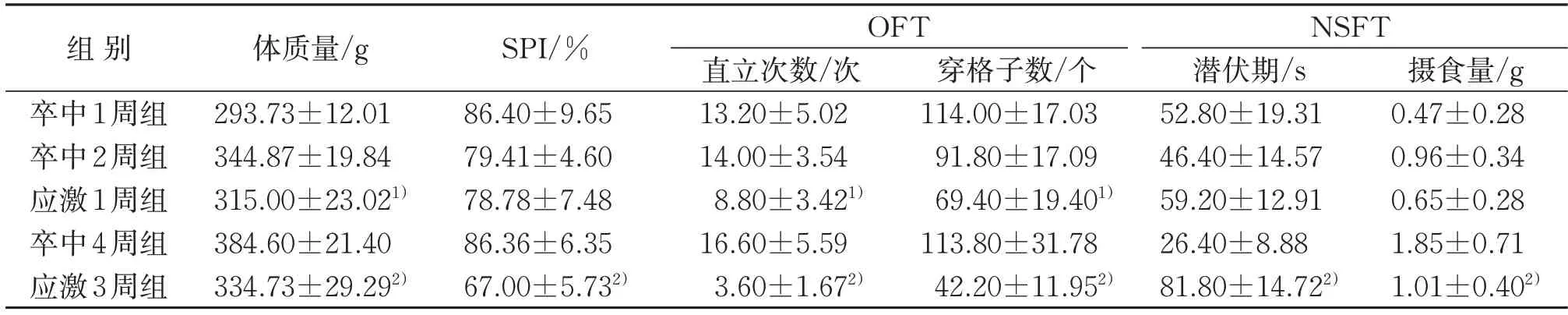
表1 5组大鼠体质量与行为学评分比较(,n=15)Table 1 Comparison of body weight and behavioral scores of rats in five groups(,n=15)
注:与卒中2周组比较,1)P<0.05;与卒中4周组比较,2)P<0.05。Note:Compared with the 2-week stroke group,1)P<0.05;compared with the 4-week stroke group,2)P<0.05.
3.2 5组大鼠残存脑体积比较
肉眼可见图中5组患侧胼胝体及纹状体不同程度萎缩,以应激组为甚。MCAO 术后2 周时,与卒中2 周组比较,应激1 周组残存脑体积比变化不明显(P>0.05)。MCAO 术后4 周时,与卒中4 周组比较,虽然应激3 周组残存脑体积比有所减少,但是差异无统计学意义(P>0.05)。见图1。
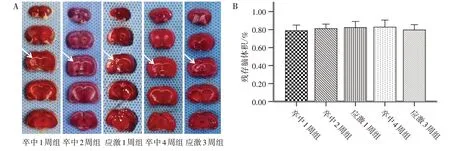
图1 5组脑切片TTC染色(A)及残存脑体积比(B)比较Figure 1 Comparison of TTC staining(A)and ratio of residual brain volume(B)in brain sections of five groups
3.3 5组大鼠患侧海马Iba-1、IL-1β 及IL-18表达比较
MCAO术后2周时,与卒中2周组比较,应激1周组大鼠患侧海马Iba-1、IL-1β 及IL-18 表达增加不明显(P均>0.05)。MCAO 术后4 周时,与卒中4 周组比较,应激3 周组大鼠患侧海马Iba-1、IL-1β 及IL-18表达均显著增加(P均<0.05)。见图2。
纵向比较:与应激1 周组比较,应激3 周组大鼠患侧海马Iba-1、IL-1β 及IL-18 表达均显著增加(P均<0.05)。卒中组3 个不同时间点的患侧海马Iba-1、IL-1β 及IL-18 表达差异有统计学意义(P<0.05);两两比较:较卒中1 周组,卒中2 周组IL-1β表达增加,卒中4 周组Iba-1、IL-1β 和IL-18 表达增加(P均<0.05);余指标之间比较,差异均无统计学意义(P均>0.05)。见图2。
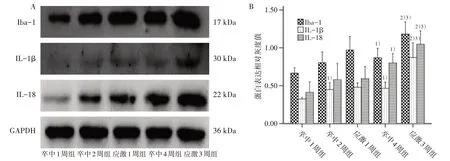
图2 5组患侧海马Iba-1、IL-1β及IL-18相对表达的Western blot结果Figure 2 Results of the relative expression of Iba-1,IL-1β and IL-18 in the affected hippocampus of five groups(Western blot)
3.4 5组大鼠患侧海马CA1区Iba-1荧光强度比较
Iba-1 呈现为绿色荧光,细胞核染(DAPI)呈现为蓝色荧光。MCAO 术后2 周时,与卒中2 周组比较,应激1周组大鼠患侧海马CA1区Iba-1荧光强度变化不明显(P>0.05)。MCAO 术后4 周时,与卒中4 周组比较,应激3 周组患侧海马CA1 区Iba-1 荧光强度显著增加(P<0.05)。见图3。
纵向比较:与应激1 周组比较,应激3 周组大鼠患侧海马Iba-1荧光强度显著增强(P<0.05)。卒中组3 个不同时间点患侧海马CA1 区Iba-1 荧光强度差异均有统计学意义(P均<0.05);两两比较:与卒中1 周或2 周组比较,卒中4 周组患侧海马CA1 区Iba-1荧光强度增强(P均<0.05);其余比较,变化不明显。见图3。
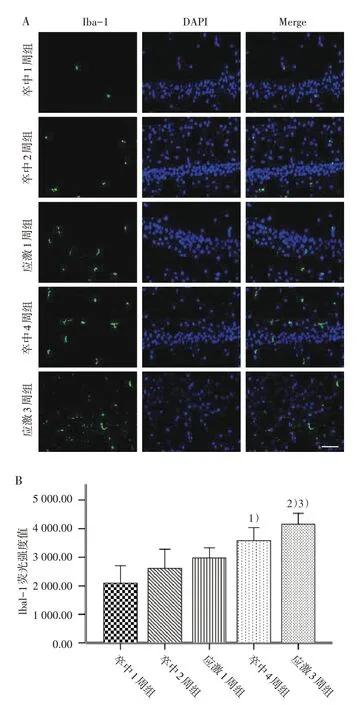
图3 5组患侧海马CA1区Iba-1荧光强度比较(×400)Figure 3 Comparison of Iba-1 fluorescence intensity in CA1 region of affected hippocampus in five groups(×400)
4 讨论
本研究有以下新的发现:①慢性应激诱导卒中大鼠抑郁样行为,可能与海马小胶质细胞及炎症反应的持续激活有关;②海马小胶质细胞活化及炎症反应持续至卒中后4 周;③适度慢性应激不影响缺血性卒中大鼠残存脑体积比。
CUMS 是基础研究中用来诱导卒中大鼠抑郁样行为的常用方法。本研究中,发现应激3 周可使卒中大鼠表现出SPI 下降,NSFT 潜伏期延长,摄食量下降乃至OFT 运动意愿减少等抑郁样行为,与既往研究一致[5-7]。在分子层面,重点观察了海马小胶质细胞表达的时间线特征,结果发现应激组Iba-1 表达不仅较同时间点的卒中组增加,而且应激组内部也呈现出时间相关性增加。这在既往研究中很少被报道。在病理学层面,我们发现CA1 区小胶质细胞活化非常显著,除卒中4周组外,余绿色荧光强度趋势与Iba-1 蛋白表达基本一致。本研究再次验证了海马小胶质细胞活化在慢性应激诱导卒中大鼠抑郁样行为中所扮演的重要角色,与前期研究基本一致[8]。
同时,本研究对海马促炎性细胞因子IL-1β 和IL-18 进行了检测,发现二者表达趋势与Iba-1 蛋白表达非常相似,提示促炎性反应与小胶质细胞活化同步。作为具有吞噬功能的中枢常驻免疫细胞,活化的小胶质细胞可通过突触分枝感受微环境变化。在应激早期,处于M1 极化状态的小胶质细胞可分泌大量促炎性细胞因子(如IL-6、TNF-α和IL-1β),从而介导抑郁样行为发展[4]。遗憾的是,本研究中没有对海马Iba-1 和炎症因子进行免疫双标,尚不能证实海马区的促炎反应为小胶质细胞源性。
在本研究中,我们还发现随卒中时程延长,海马Iba-1 和促炎性细胞因子表达持续增加,提示卒中后海马小胶质细胞活化和炎症反应可能是一个持续过程。不过,不同研究的观点并不一致。THAKKAR 等[9]在全脑缺血的小鼠模型研究中发现,海马NLRP3 炎症小体及其下游产物(裂解的Caspase1 和IL-1β)在缺血后1 周达峰值;而在另一组全脑缺血的大鼠模型研究发现[10],海马IL-1β 等炎症标志物在缺血后2周仍然升高。相较于海马炎症因子的检测,对局灶性缺血周边非海马区域的检测也发现IL-1β 等炎症因子的升高,甚至持续到缺血后7周[11]。这些研究提示卒中后脑组织炎症反应依据缺血模型不同可能呈现出不同的演变轨迹,甚至转为慢性炎症。本研究首次发现海马小胶质细胞活化及促炎性细胞因子表达在卒中后4周时仍然存在。不过,卒中组大鼠行为学评分并没有随炎症因子水平升高而恶化,间接提示卒中后功能恢复与慢性应激躯体化机制的复杂性。
另外,本研究对脑组织肉眼形态学进行了测量,发现卒中组和应激组患侧胼胝体和纹状体均有萎缩,但是残存脑体积比差异无统计学意义,这有别于本课题组前期报道[5,12]。原因可能与MCAO 及CUMS 方案调整有关。首先,为降低术后死亡率,脑缺血时间由90 min 减少至70 min;其次,空间限制时间由4 h减至2 h,噪音刺激由20 min减至10 min,夹尾由2 min 减至1 min。其中,脑缺血时间是影响脑梗死体积的主要因素;而空间限制则是增加心理压力的首选方法。据报道[13-14],“新冠肺炎”期间居家隔离明显增加心理负荷,心理咨询或抑郁倾向人群较平时明显增加。不过,应激方式的差异是否会影响脑梗死体积变化,有待进一步研究。
当然,本研究也存在以下不足:①慢性应激时间局限于1周与3周,尚缺少其他时间点数据;②缺少小胶质细胞源性炎症分子通路的深入研究;③未进行物理因子干预。下一步可以利用受体阻断和免疫双标的方法,动态观察海马小胶质细胞活化与炎症反应通路介导慢性应激在卒中后抑郁样行为的生物学机制。
综上所述,本研究揭示了海马小胶质细胞活化及炎症反应介导慢性应激诱导卒中大鼠抑郁样行为可能具有时间相关性特征,卒中后海马小胶质细胞活化及炎症反应可能是一个持续过程,而适度慢性应激可能不影响脑梗死体积。

