响应面试验优化酶解法制备鲣鱼活性肽及其对小鼠抗疲劳的影响
李守江,孔祥佳,刘智禹,赵 峰,苏永昌,陈晓婷
1 福建中医药大学,福建福州 350122;2 福建省海洋生物增养殖与高值化利用重点实验室,福建厦门 361013;3 福建省水产研究所,福建厦门361013
人体在长时间大强度运动中会表现出运动耐力下降、效率低下,主观上伴有倦怠感,疲劳就是机体主动呈现的一种生理性保护反应。如果不能消除疲劳,就有可能发展成过劳,劳力耗中气、劳神伤气血,最终导致机体不可逆损伤,从而制约多个行业的安全与发展。引起疲劳的原因很多,其中能量耗竭是主要原因之一[1]。力竭性运动导致线粒体膜结构和功能的破坏,能量生成减少,因而产生运动性疲劳[2]。如何有效克服运动性疲劳一直是医学以及运动医学研究的难点和热点。目前,缓解运动性疲劳的方法有物理手段和营养补充等。其中,物理手段可采用按摩、针灸、负压等方法恢复体力,缓解疲劳[3-5];营养补充包括服用营养素、药物等消除运动性疲劳[6-8]。这2 种缓解运动性疲劳的方法相比,物理方法需配备专用设备或专业理疗人员,在应用及推广中受到一定限制;而营养补充在使用过程中更为便捷、高效。因此,开发安全、无激素残留、无副作用,起到抗疲劳作用的营养素具有重要的研究意义。
研究表明,多糖类、酵素、多酚类、生物碱类、皂苷类、活性肽等物质对运动性疲劳具有影响,既可缓解疲劳,又能减少毒副作用[6,9-13]。其中,活性肽多来源于海洋生物[14],具有较高的生物活性和较强的靶向专一性。鲣鱼Katsuwonus pelamis属于低脂高蛋白海产品,产量高、营养价值丰富[15-16],可作为制备天然活性肽的优质试材。目前有关鲣鱼活性肽的制备工艺及其对运动性疲劳的影响未见报道。因此,本实验以鲣鱼为试材,通过单因素实验和响应面试验,研究酶解法制备活性肽的工艺,并探讨鲣鱼活性肽对小鼠抗疲劳的影响,旨在为开发利用鲣鱼资源、开展多肽生物活性的综合利用提供参考依据和理论指导。
1 材料与仪器
1.1 材料与试剂
鲣鱼,由福建省水产研究所提供。
木瓜蛋白酶(X1=800 000 U/g)、中性蛋白酶(X2=50 000 U/g)、风味蛋白酶(X3=20 000 U/g)、碱性蛋白酶(X4=50 000 U/g)、酸性蛋白酶(X5=50 000 U/g)(南宁庞博生物工程有限公司);浓盐酸、浓硫酸、氢氧化钠、三氯乙酸、硼酸、溴甲酚绿、甲基红、乙酸钠、乙酸、甲醇、乙酰丙酮、硫酸铵、羧甲基纤维素钠(CMC-Na)、中性红生物染色剂(国药集团化学试剂有限公司);FOSS催化剂片(硫酸铜+硫酸钾)(福斯分析仪器公司);0.9%生理盐水(辰欣药业股份有限公司);实验动物配合饲料(北京华阜康生物科技股份有限公司);20×PBS 稀释液(北京索莱宝科技有限公司);三磷酸腺苷二钠(上海澄绍生物科技有限公司);血清乳酸试剂盒(LD)测定试剂盒、血清乳酸脱氢酶(LDH)测定试剂盒、血清尿素氮(BUN)测定试剂盒、丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒(武汉默沙克生物科技有限公司)。
1.2 实验动物
SPF 级雄性KM 鼠,体质量(20±2)g,购于吴氏实验动物有限公司,实验动物生产许可证号码:SCXK(京)2014-0004。
1.3 仪器与设备
Kjeltec8400 全自动定氮仪(福斯分析仪器公司);HYP-1008 型八孔消化炉(上海纤检仪器有限公司);HH-6 数显恒温水浴锅(上海博远电器有限公司);BSA224S 电子分析天平(德国赛多利斯科学仪器有限公司);KQ-500DE 型数控超声波清洗器(昆山市超声仪器有限公司);UV-3200 型紫外可见分光光度计(上海美谱达仪器有限公司);FE28-Standard 型pH 计(Mettler Toledo);IKA C-MAG HS7数显磁力搅拌器(艾卡仪器设备有限公司);5810R Centrifuge 离心机(艾本德中国有限公司);SCC21B型真空冷冻干燥机(新芝生物科技有限公司);Direct-Q3UV 型纯水系统(Millipore);Biomedical 超低温冰箱(海尔);Infinite 200 PRO型酶标仪(Tecan)。
2 实验方法
2.1 鲣鱼活性肽制备流程
鲣鱼洗净→去内脏、鱼头、鱼尾→取肉→高速组织匀浆机绞碎、拌匀→加水→酶解→灭酶→离心→取上清液→冷冻干燥→鲣鱼酶解产物(鲣鱼活性肽)。
2.2 蛋白酶的筛选
选用木瓜蛋白酶、中性蛋白酶、风味蛋白酶、碱性蛋白酶、酸性蛋白酶等5 种蛋白酶酶解鲣鱼。每克鱼糜分别加入2 000 U的不同蛋白酶,以鲣鱼活性肽得率为评价指标,探讨最适用于酶解鲣鱼活性肽的酶类。各酶的酶解条件及添加量见表1。
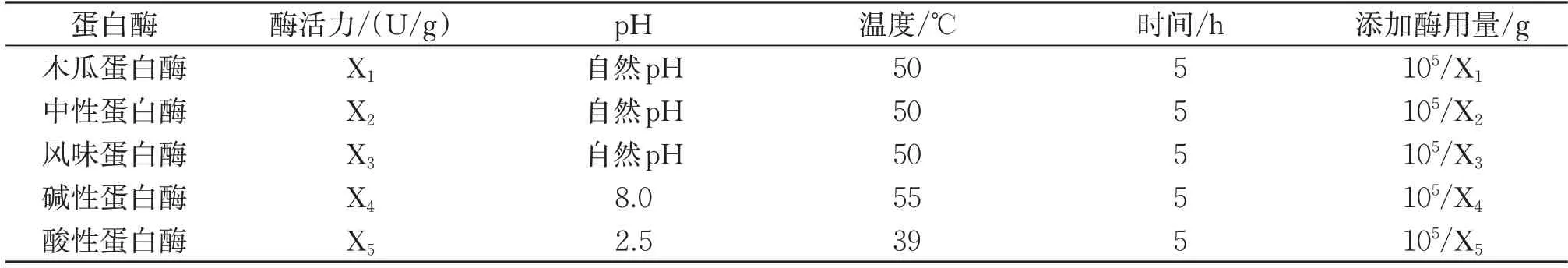
表1 5种蛋白酶酶解参数Table 1 Hydrolysis parameters of five protease
酶解结束后于95~100 ℃加热10 min 钝化灭酶,10 000 r/min低温(4 ℃)离心20 min,取上清液测定并计算鲣鱼活性肽得率。
2.3 单因素实验
在鲣鱼鱼糜与超纯水混合搅拌试验中,发现料液比1∶1 是鲣鱼鱼糜与超纯水有效混合的最大比值。因此,在筛选出的风味蛋白酶基础上,考察料液比(鲣鱼鱼糜分别按照料液比为1∶1、1∶1.5、1∶2、1∶2.5、1∶3 g/mL 的比例加入超纯水)、加酶量(每克鱼糜中分别加入1 000、2 000、3 000、4 000、5 000 U的蛋白酶,分别对应酶添加量为2.5、5、7.5、10、12.5 g)、酶解时间(3、4、5、6、7 h)、酶解温度(30、40、50、60、70 ℃)对鲣鱼活性肽得率的影响,并确定各酶解条件的最适范围。
2.4 响应面试验设计
根据单因素实验及分析结果,在固定料液比为1∶1 的基础上,以加酶量、酶解时间和酶解温度为关键工艺参数,通过Box-Behnken 试验设计原理,采用Design Expert 8.0.6 分析软件进行三因素三水平试验,试验因素及水平设计见表2。

表2 响应面试验设计因素及水平Table 2 Design factors and levels of response surface test
2.5 鲣鱼活性肽得率计算
参考祝婧[17]的方法计算。其中,酸溶蛋白质水解物含量采用GB/T 22729—2008[18]的方法测定,氨基酸态氮含量采用GB5009.235—2016[19]的方法测定,鲣鱼蛋白含量采用GB5009.5—2016[20]的方法测定。
活性肽得率=(酸溶蛋白质水解物含量-氨基酸态氮含量)/鲣鱼蛋白含量×100%
2.6 动物实验
2.6.1 分组及模型制备 将90只KM小鼠适应性喂养7 d 后,按体质量随机分成6 组,每组15 只,分别为安静空白组、运动模型组、阳性对照组、鲣鱼活性肽低剂量组(200 mg/kg,简称低剂量组)、鲣鱼活性肽中剂量组(400 mg/kg,简称中剂量组)、鲣鱼活性肽高剂量组(800 mg/kg,简称高剂量组),连续4 周按表3所示对各组小鼠进行给药处理。
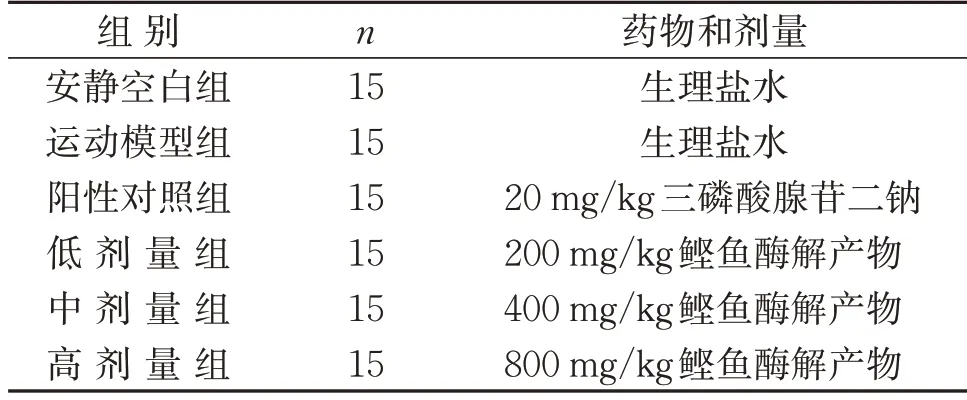
表3 动物分组和处理Table 3 Animal grouping and administration
除安静空白组外,其余各组构建递增负荷式游泳训练诱导的小鼠疲劳模型,以训练时间为变量进行训练。即第1 周采用10 min 递增至50 min 训练(按每2 d递增20 min进行游泳运动,下同)6 d,休息1 d;第2 周采用50 min 递增至90 min 训练6 d,休息1 d;第3周采用90 min递增至130 min训练6 d,休息1 d;第4 周训练2 次,首先采用负重6%训练直至小鼠力竭,休息1 d,然后再采用负重6%训练直至小鼠再次力竭达到疲劳;以小鼠游泳过程中头部下沉5 s内未浮出水面作为判断小鼠力竭标准,并记录该时间作为小鼠游泳力竭时间。负重力竭游泳结束后,采用摘眼球取血的方式获得血液样本,将血液静置0.5 h,3 000 r/min 低温(4 ℃)离心10 min,取上清液即为血清待测液;同时,在冰台上取肝脏,经液氮速冻,转移至-80 ℃保存备用。
2.6.2 血清BUN 和LD 含量测定 按照试剂盒规定方法测定BUN和LD含量。
2.6.3 血清LDH 活性测定 按照试剂盒规定方法测定LDH活性。
2.6.4 肝脏MDA 含量和SOD 活性测定 称取0.2 g肝脏,加入1.8 mL 4 ℃预冷PBS(pH 7.4),研磨制成10%肝脏匀浆,于4 ℃3 000 r/min 条件下离心20 min,取上清液,即为肝脏匀浆待测液。按照试剂盒规定方法测定MDA含量和SOD活性。
2.7 统计学方法
采用SPSS 19.0软件进行数据处理和统计分析。定量资料服从正态分布以()表示,采用单因素方差分析进行各组样本平均数的比较。以P<0.05 为差异有统计学意义。
3 结果与分析
3.1 蛋白酶的筛选
选取木瓜蛋白酶、中性蛋白酶、风味蛋白酶、碱性蛋白酶、酸性蛋白酶5种蛋白酶,在各种酶的最适宜条件下对鲣鱼鱼糜进行酶解。风味蛋白酶酶解鲣鱼鱼糜的效果最佳,活性肽得率最高,为17.000%;中性蛋白酶酶解鲣鱼鱼糜的效果次之,活性肽得率为15.155%;而木瓜蛋白酶、碱性蛋白酶、酸性蛋白酶酶解鲣鱼鱼糜的效果略差。统计分析表明,风味蛋白酶酶解鲣鱼活性肽得率显著高于中性蛋白酶(P<0.05),极显著高于木瓜蛋白酶、碱性蛋白酶、酸性蛋白酶(P<0.01)。因此,选用风味蛋白酶作为最佳蛋白酶,用以制备鲣鱼活性肽。见图1。
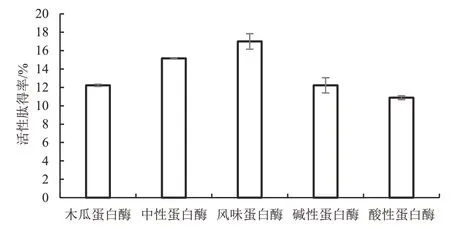
图1 5种蛋白酶对鲣鱼活性肽得率的影响Figure 1 Effects of five proteinases on the yield of bioactive peptide in Katsuwonus pelamis
3.2 单因素实验结果
3.2.1 料液比对鲣鱼活性肽得率的影响 随着料液比的减少,鲣鱼活性肽得率降低,即料液比为1∶1时,活性肽得率达到最大。这说明料液比达到一定水平时,底物和酶已达到完全饱和的状态,随着料液比的继续降低,鲣鱼活性肽的得率反而下降,影响酶解效果。统计分析表明,料液比为1∶1 时的鲣鱼活性肽得率显著高于料液比为1∶1.5~1∶3 时的活性肽得率(P<0.05)。因此,为了显著提高鲣鱼活性肽得率,优化试验时固定料液比为1∶1。见图2。
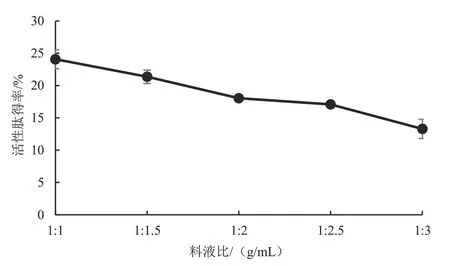
图2 料液比对鲣鱼活性肽得率的影响Figure 2 Effect of solid-to-liquid ratio on the yield of bioactive peptide in Katsuwonus pelamis
3.2.2 加酶量对鲣鱼活性肽得率的影响 酶反应底物的水解程度取决于酶的加入量。随着酶用量的增加,鲣鱼活性肽得率呈逐渐上升后逐渐下降的变化趋势。当加酶量为1 000~2 000 U/g 时,活性肽得率随着酶用量的增大而快速上升;当加酶量为2 000~4 000 U/g时,活性肽得率随着酶用量的增大而呈缓慢上升趋势,当加酶量达到4 000 U/g时,水解充分,活性肽得率达到最高值;当加酶量为4 000~5 000 U/g 时,活性肽得率随着酶用量的增大而呈缓慢下降趋势。这表明底物浓度相对于酶添加量达到饱和后,活性肽得率将不会随着加酶量的增加而增大,反而会抑制酶活性,使得活性肽得率下降。统计分析表明,加酶量为4 000 U/g 时的鲣鱼活性肽得率显著高于1 000~3 000 U/g(P<0.05),但与5 000 U/g差异无统计学意义(P>0.05)。因此,为了显著提高鲣鱼活性肽得率,选取加酶量的变量范围为(4 000±400)U/g,即对应风味蛋白酶添加量的变化范围为(10±1)g作进一步的优化试验。见图3。
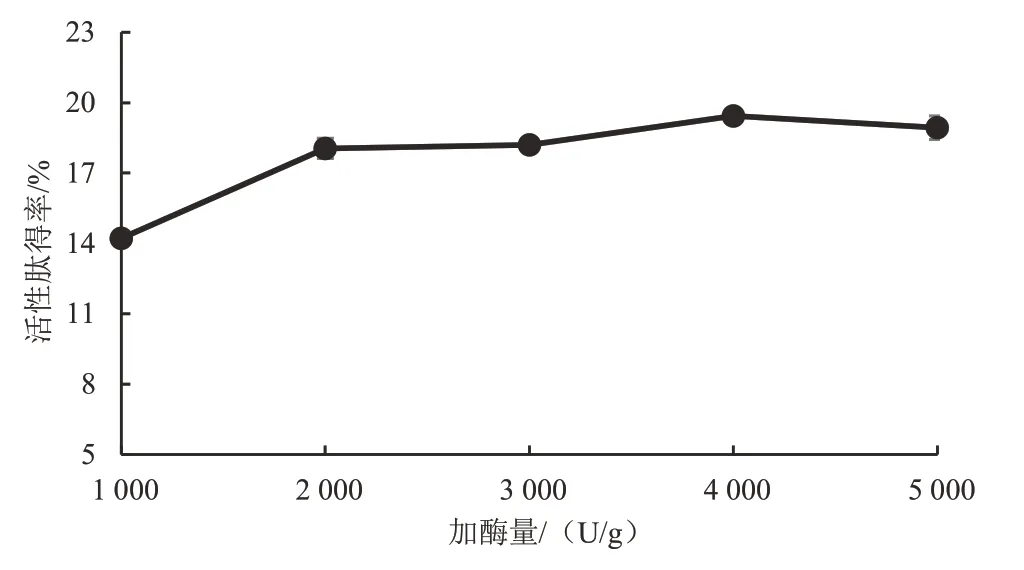
图3 加酶量对鲣鱼活性肽得率的影响Figure3 Effect of enzyme addition on the yield of bioactive peptide in Katsuwonus pelamis
3.2.3 酶解时间对鲣鱼活性肽得率的影响 在一定酶解时间内,随着酶解时间的延长,活性肽得率趋于平缓,但随着酶解时间继续增加,活性肽得率呈先快速上升后快速下降的变化趋势。其中,酶解3~5 h 时,活性肽得率趋于平缓;酶解5~6 h 时,活性肽得率快速上升,当酶解时间达到6 h 时,此时活性肽得率的值最高;酶解6~7 h 时,活性肽得率又快速下降。这表明适宜的酶解时间能够促进风味蛋白酶与底物的结合,底物中能够被酶解的物质是有限的,当底物中的可被酶解物质充分酶解后,继续延长酶解时间,反而会导致酶活性降低,可能还会产生副产物,从而影响鲣鱼活性肽得率和品质。因此,选取酶解时间的变量范围为(6±0.5)h作进一步的优化试验。见图4。
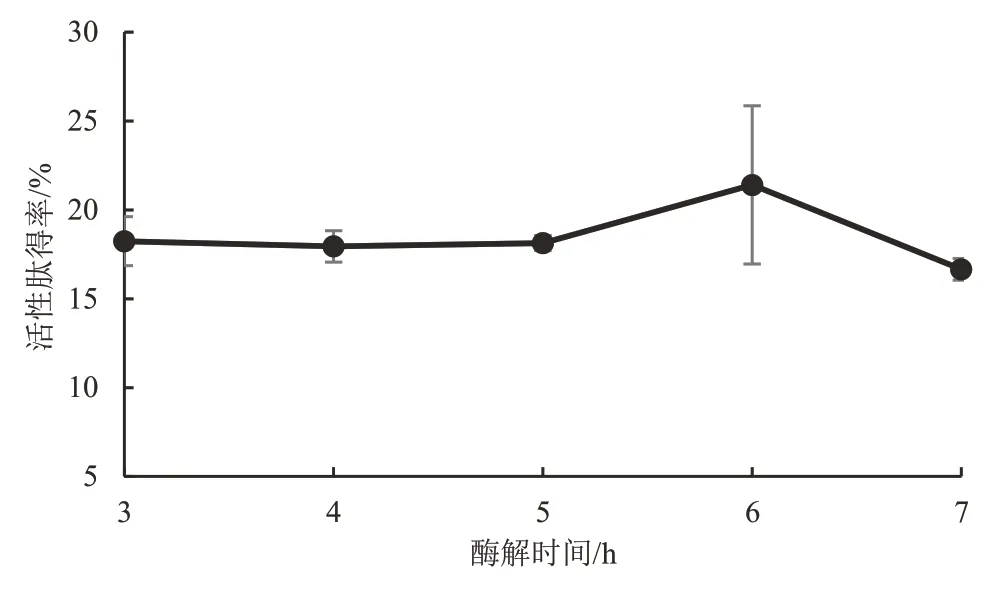
图4 酶解时间对鲣鱼活性肽得率的影响Figure 4 Effect of enzymatic time on the yield of bioactive peptide in Katsuwonus pelamis
3.2.4 酶解温度对鲣鱼活性肽得率的影响 鲣鱼活性肽得率受酶解温度的影响,随着酶解温度的升高,活性肽得率呈先上升后下降的变化趋势。当酶解温度为30~40 ℃时,活性肽得率随着酶解温度的升高而逐渐增加,当温度达到40 ℃时,活性肽得率达到最大值;当酶解温度为40~50 ℃时,活性肽得率随着酶解温度的升高而快速降低;当酶解温度为50~70 ℃时,活性肽得率变化平缓。这表明酶解温度过高或过低都会对酶的活性中心产生影响,抑制酶活性、降低酶解效果,从而影响鲣鱼活性肽得率。统计分析表明,酶解温度为40 ℃时的鲣鱼活性肽得率显著高于50~70 ℃(P<0.05),但与30 ℃差异无统计学意义(P>0.05)。因此,为了显著提高鲣鱼活性肽得率,选取酶解温度的变量范围为(40±5)℃作进一步的优化试验。见图5。
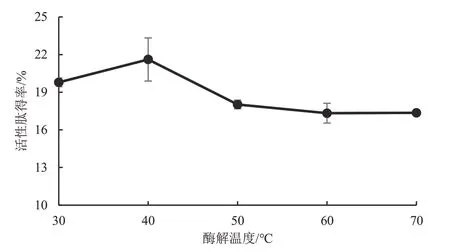
图5 酶解温度对鲣鱼活性肽得率的影响Figure 5 Effect of enzymatic temperature on the yield of bioactive peptide in Katsuwonus pelamis
3.3 响应面试验结果
3.3.1 Box-Behnken 试验设计及结果 根据单因素实验及分析结果,在固定料液比为1∶1的基础上,以加酶量、酶解时间和酶解温度为关键工艺参数,通过Box-Behnken 试验设计原理,采用Design Expert 8.0.6 分析软件进行三因素三水平试验,试验设计方案及数据处理结果如表4所示。
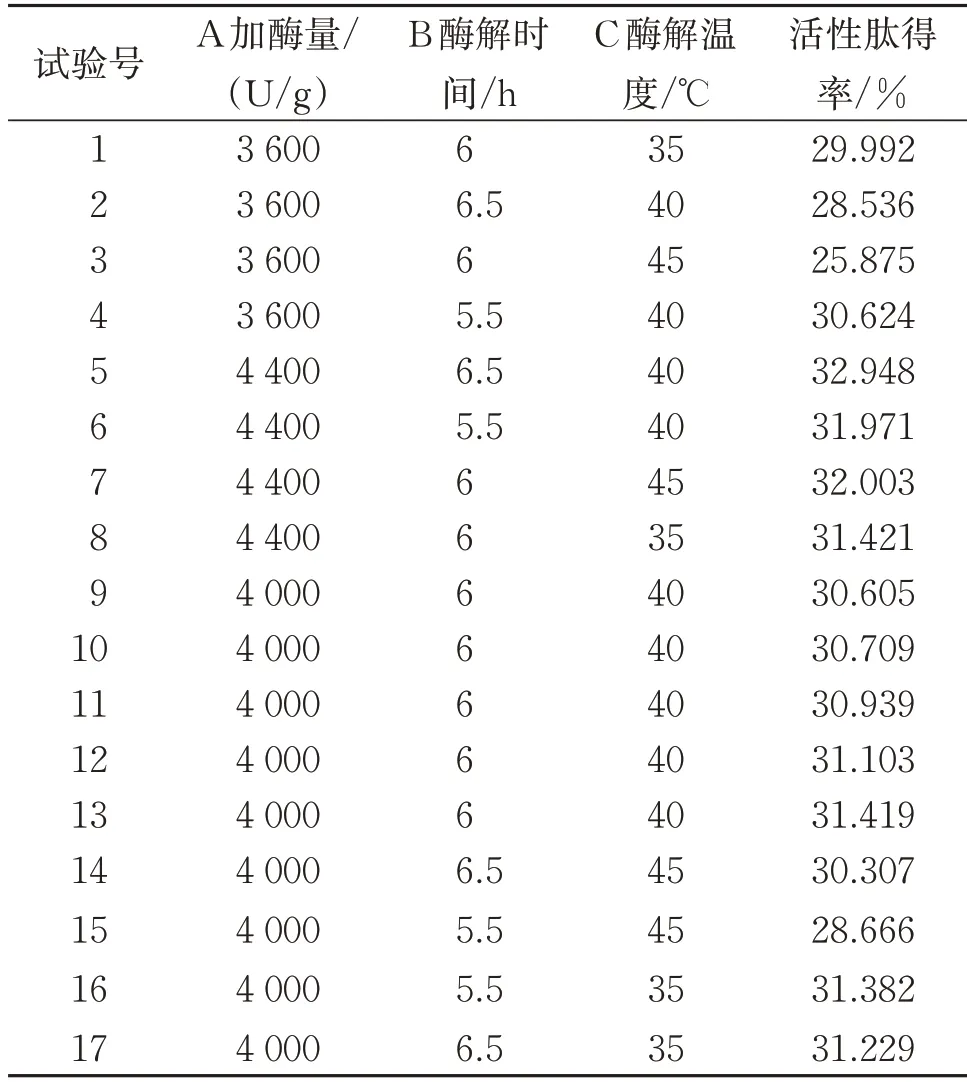
表4 响应面试验设计方案及结果Table 4 Experimental design with response variable for response surface analysis
3.3.2 模型建立及显著性分析 根据Box-Behnken试验设计要求,对上述17组试验数据进行二次多元回归拟合,获得项目指标(R1活性肽得率)对影响因子(A加酶量、B酶解时间和C酶解温度)的关系为:

为检验该二次多元回归方程的有效性,进一步对响应面法优化鲣鱼活性肽得率的显著性和多元回归模型的方差进行分析可知,其分析结果见表5。
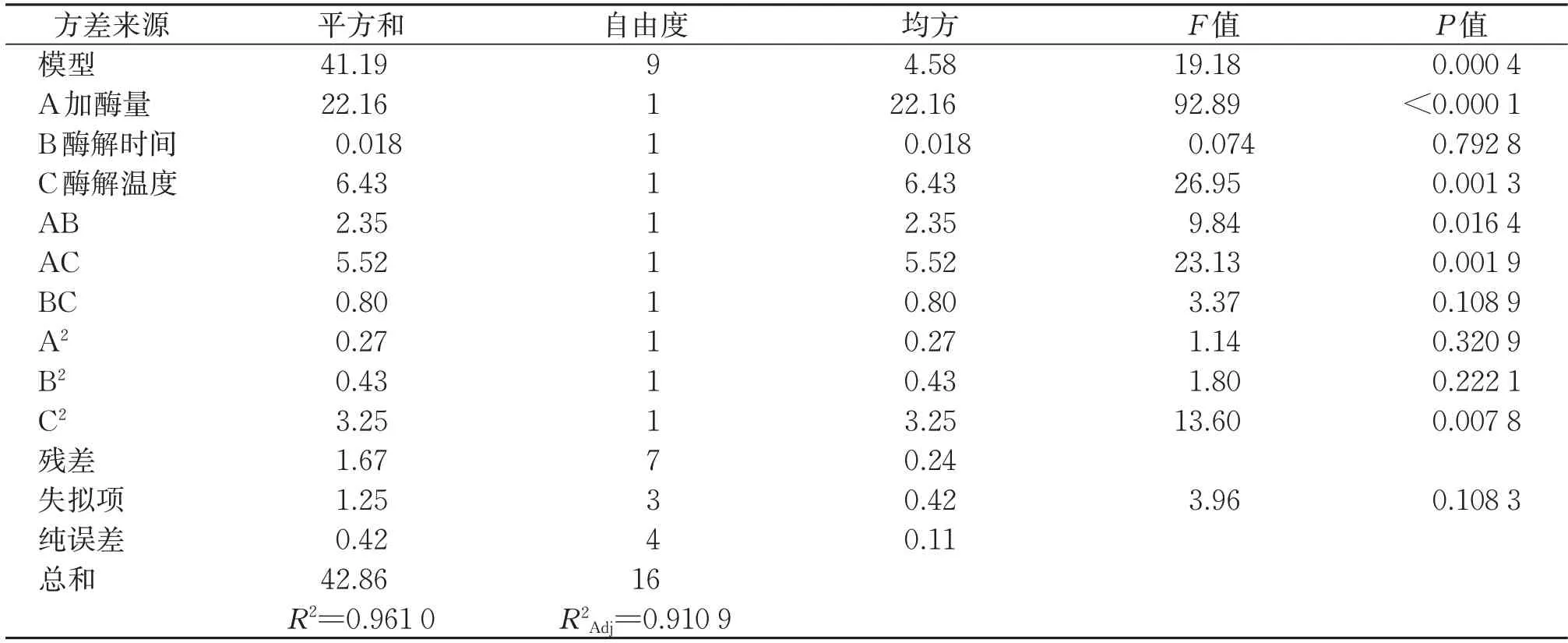
表5 响应面法优化鲣鱼活性肽得率的方差分析Table 5 Variance analysis of polypeptides yield in Katsuwonus pelamis by response surface methodology
由表5 可知,回归方程一次项A、C 对活性肽得率的影响极显著(P<0.01),B 对活性肽得率的影响不显著(P>0.05)。从交叉项对活性肽得率的影响来看,AB 对活性肽得率的影响显著(P<0.05),AC对活性肽得率的影响极显著(P<0.01),而BC 对活性肽得率的影响不显著(P>0.05)。
二次多元回归方程模型P值为0.000 4<0.01,表明该模型高度显著,该实验方法是可靠的;而模型的失拟性P值为0.108 3>0.05 为不显著,进一步说明模型与实际情况拟合情况良好,可以使用该模型对实际试验进行预测和分析。决定系数R2反应了回归方程对数据的拟合程度,其数值在0~1 之间,R2越接近于1 表明拟合程度越好。该实验响应值R1的决定系数R2=0.961 0,说明响应值与回归方程的拟合程度很好,表明鲣鱼活性肽得率试验值与预测值具有较高的一致性;模型的校正决定系数R²Adj=0.910 9,表明该模型能解释91.09%响应值变化,仅有8.91%不能用该模型来解释。因此,该模型能够较好地优化鲣鱼活性肽的酶解工艺。
3.3.3 交互作用分析 响应曲面图可反映各因素及其交互作用对响应值的影响。若响应面图的曲面坡度平缓,表明两影响因子交互作用小;若陡峭,则表示交互作用大。
由图6a~6c 可知,加酶量、酶解时间、酶解温度3个因素之间的交互作用对鲣鱼活性肽得率的影响不同。由图6a 可知,响应曲面图坡度稍陡,说明加酶量和酶解时间的交互作用相对显著;由图6b可知,响应曲面图坡度较陡,说明加酶量和酶解温度的交互关系较为显著;由图6c 可知,响应曲面图坡度较为平缓,说明酶解时间和酶解温度的交互关系不显著。从响应曲面图中直观得出的结果与方差分析的结果一致。

图6 酶解条件对鲣鱼活性肽得率交互影响的曲面图Figure 6 Surface diagram of the interaction of enzymatic hydrolysis conditions on the yield of bioactive peptide in Katsuwonus pelamis
3.3.4 参数优化及模型验证 通过Design Expert 8.0.6分析软件得出酶解法制备鲣鱼活性肽的最佳工艺参数,即加酶量4 400 U/g,酶解时间为6.5 h,酶解温度42.08 ℃;在该条件下鲣鱼活性肽得率为33.647 9%。考虑到实际操作的可行性,调整最佳工艺参数为加酶量4 400 U/g,酶解时间为6.5 h,酶解温度42 ℃;按照该工艺进行验证试验,得到鲣鱼活性肽得率为33.166%,与预测值仅相差0.481 8%,说明通过响应面法优化得到的回归模型方程及最佳条件可靠。
3.4 鲣鱼活性肽对小鼠抗疲劳的影响
3.4.1 鲣鱼活性肽对小鼠力竭游泳时间的影响 与运动模型组相比,给药组均能不同程度地延长小鼠力竭游泳时间,差异有统计学意义(P<0.01);且与阳性对照组相比,鲣鱼活性肽中、高剂量可极显著增加小鼠负重力竭游泳时间(P<0.01)。这说明鲣鱼活性肽对减轻力竭游泳小鼠的疲劳具有一定的作用。见表6。
表6 鲣鱼活性肽对小鼠力竭游泳时间的影响()Table 6 Effect of bioactive peptide in Katsuwonus pelamis on exhausted swimming time of mice()

表6 鲣鱼活性肽对小鼠力竭游泳时间的影响()Table 6 Effect of bioactive peptide in Katsuwonus pelamis on exhausted swimming time of mice()
注:与运动模型组比较,1)P<0.01;与阳性对照组比较,2)P<0.01。Note:Compared with the exercise model group,1)P<0.01;compared with the positive control group,2)P<0.01.
3.4.2 鲣鱼活性肽对小鼠血清BUN含量的影响 运动模型组小鼠的BUN 含量高于安静空白组,差异具有统计学意义(P<0.01)。当小鼠力竭游泳运动后,给药组BUN 含量均极显著低于运动模型组(P<0.01);进一步比较发现,阳性对照组BUN 含量极显著高于鲣鱼活性肽低、高剂量组(P<0.01),显著高于中剂量组(P<0.05)。这说明随着小鼠运动负荷的增加,运动模型组小鼠血清中的BUN 含量快速增加,从而导致小鼠疲劳现象的出现;而给药组可有效降低小鼠血清BUN 含量,从而提高小鼠运动负荷能力,延缓小鼠疲劳产生。见表7。
表7 鲣鱼活性肽对小鼠血清BUN含量的影响()Table 7 Effect of bioactive peptide in Katsuwonus pelamis on serum BUN content of mice()
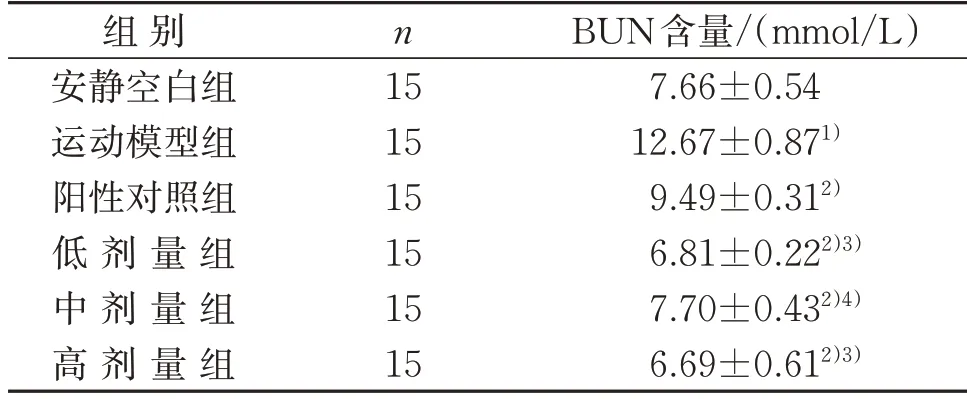
表7 鲣鱼活性肽对小鼠血清BUN含量的影响()Table 7 Effect of bioactive peptide in Katsuwonus pelamis on serum BUN content of mice()
注:与安静空白组比较,1)P<0.01;与运动模型组比较,2)P<0.01;与阳性对照组比较,3)P<0.01,4)P<0.05。Note:Compared with the quiet blank group,1) P<0.01;compared with the exercise model group,2)P<0.01;compared with the positive control group,3)P<0.01,4)P<0.05.
3.4.3 鲣鱼活性肽对小鼠血清LD 含量的影响 力竭游泳运动后的小鼠LD 含量增加,且运动模型组小鼠的LD 含量极显著高于安静空白组(P<0.01)。与运动模型组相比,给药组LD 含量均降低,且阳性对照组以及鲣鱼活性肽中、高剂量组LD 含量极显著降低(P<0.01),但鲣鱼活性肽低剂量组与运动模型组比较差异无统计学意义(P>0.05);进一步比较发现,鲣鱼活性肽给药组均极显著高于阳性对照组(P<0.01)。这说明随着小鼠运动负荷的增加,运动模型组小鼠血清中的LD 含量急剧升高;而给药组可显著降低小鼠运动后血清中的LD 含量,从而有效缓解小鼠运动性疲劳。见表8。
表8 鲣鱼活性肽对小鼠血清LD含量的影响()Table 8 Effect of bioactive peptide in Katsuwonus pelamis on serum LD content of mice()
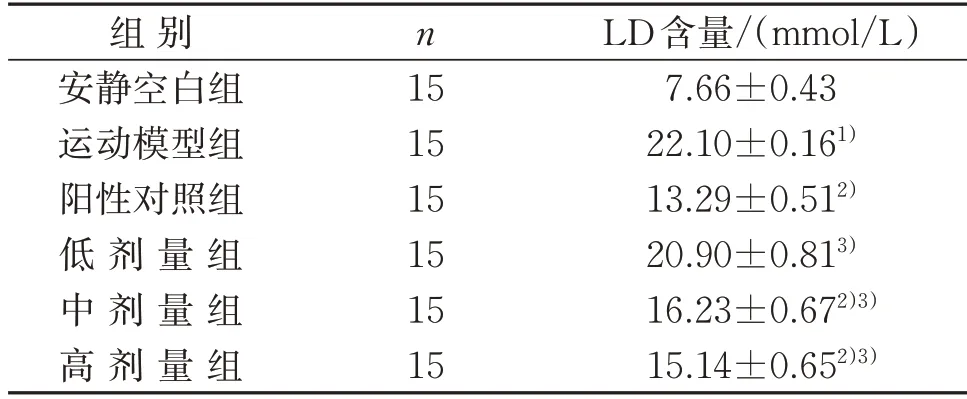
表8 鲣鱼活性肽对小鼠血清LD含量的影响()Table 8 Effect of bioactive peptide in Katsuwonus pelamis on serum LD content of mice()
注:与安静空白组比较,1)P<0.01;与运动模型组比较,2)P<0.01;与阳性对照组比较,3)P<0.01。Note:Compared with the quiet blank group,1) P<0.01;compared with the exercise model group,2) P<0.01;compared with the positive control group,3)P<0.01.
3.4.4 鲣鱼活性肽对小鼠血清LDH活性的影响 力竭游泳运动后的小鼠LDH 活性升高,且运动模型组小鼠的LDH 活性高于安静空白组,差异有统计学意义(P<0.01)。与运动模型组相比,给药组LDH 活性均极显著降低(P<0.01);且阳性对照组LDH 活性显著低于鲣鱼活性肽低、高剂量组(P<0.05),极显著低于中剂量组(P<0.01)。见表9。
表9 鲣鱼活性肽对小鼠血清LDH活性的影响()Table 9 Effect of bioactive peptide in Katsuwonus pelamis on serum LDH activity of mice()

表9 鲣鱼活性肽对小鼠血清LDH活性的影响()Table 9 Effect of bioactive peptide in Katsuwonus pelamis on serum LDH activity of mice()
3.4.5 鲣鱼活性肽对小鼠肝脏MDA含量的影响 力竭运动模型组小鼠的MDA含量高于安静空白组,差异有统计学意义(P<0.01)。当小鼠力竭游泳运动后,给药组MDA 含量均极显著低于运动模型组(P<0.01);且阳性对照组MDA 含量极显著低于鲣鱼活性肽低剂量组(P<0.01),显著低于中剂量组(P<0.05),但与高剂量组比较,差异无统计学意义(P>0.05)。这说明模型组的小鼠在过度运动后,导致其MDA含量快速增加;但给药组显著降低小鼠肝脏MDA含量的积累,有效提高其对小鼠运动负荷的适应能力。见表10。
表10 鲣鱼活性肽对小鼠肝脏MDA含量的影响()Table 10 Effect of bioactive peptide in Katsuwonus pelamis on MDA in liver of mice()
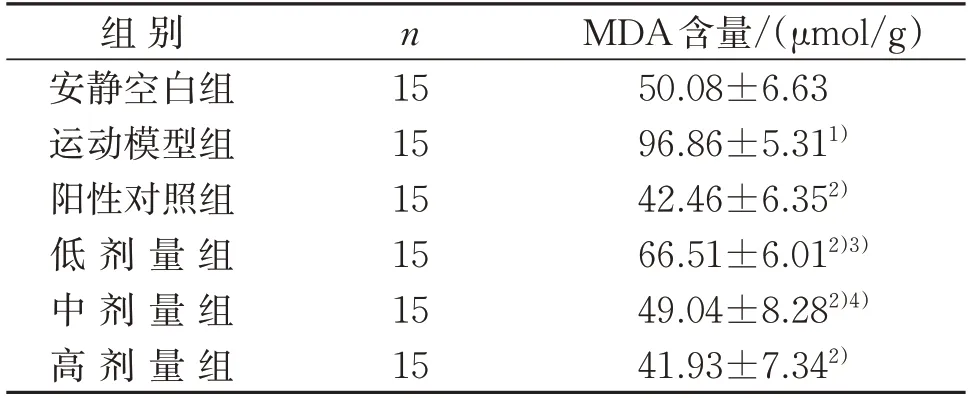
表10 鲣鱼活性肽对小鼠肝脏MDA含量的影响()Table 10 Effect of bioactive peptide in Katsuwonus pelamis on MDA in liver of mice()
注:与安静空白组比较,1)P<0.01;与运动模型组比较,2)P<0.01;与阳性对照组比较,3)P<0.01,4)P<0.05。Note:Compared with the quiet blank group,1) P<0.01;compared with the exercise model group,2)P<0.01;compared with the positive control group,3)P<0.01,4)P<0.05.
3.4.6 鲣鱼活性肽对小鼠肝脏SOD活性的影响 力竭游泳运动后的小鼠SOD 活性升高,且运动模型组小鼠的SOD活性极显著高于安静空白组(P<0.01)。与运动模型组相比,给药组SOD 活性均极显著升高(P<0.01);进一步比较分析发现,鲣鱼活性肽给药组SOD 活性极显著低于阳性对照组(P<0.01)。这说明给药组通过提高小鼠肝脏SOD 活性来增强其抗氧化能力,从而有效缓解小鼠疲劳现象的出现。见表11。
表11 鲣鱼活性肽对小鼠肝脏SOD活性的影响()Table 11 Effect of bioactive peptide in Katsuwonus pelamis on SOD activity in liver of mice()
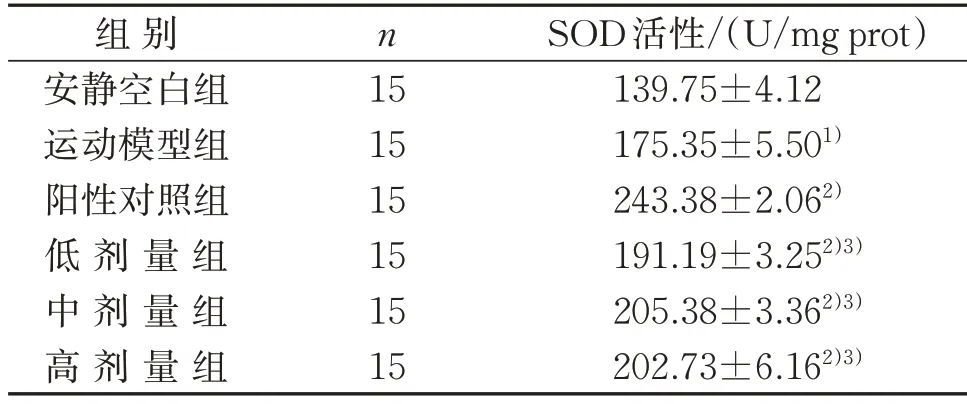
表11 鲣鱼活性肽对小鼠肝脏SOD活性的影响()Table 11 Effect of bioactive peptide in Katsuwonus pelamis on SOD activity in liver of mice()
注:与安静空白组比较,1)P<0.01;与运动模型组比较,2)P<0.01;与阳性对照组比较,3)P<0.01。Note:Compared with the quiet blank group,1) P<0.01;compared with the exercise model group,2) P<0.01;compared with the positive control group,3)P<0.01.
4 讨论
4.1 鲣鱼活性肽提取工艺
活性肽由3~20 个氨基酸残基构成,具有抗疲劳、抗氧化、抗高胆固醇、抗肿瘤、降血压、调节免疫等功效,可采用酶解法、溶剂提取法、发酵法、化学水解法及合成法等方法获得[21-22]。其中,酶解法由于操作简单、反应温度低、提取效率高等优点,已在海洋鱼生物活性肽的提取中广泛应用[12,23-24]。本研究在单因素实验的基础上,利用响应面法建立风味蛋白酶酶解制备鲣鱼活性肽工艺的二次多元回归方程,该回归方程拟合度高,所得实际值与模型预测值相差极小,可有效预测鲣鱼活性肽的得率。其最佳工艺参数为料液比1∶1,加酶量4 400 U/g,酶解时间6.5 h,酶解温度42 ℃;在该工艺条件下,鲣鱼活性肽得率为33.166%。
4.2 鲣鱼活性肽对小鼠抗疲劳的作用
机体力竭运动时会产生疲劳,这与代谢产物堆积、能量损耗、氧化应激、炎症因子水平上升等因素有关;研究表明,运动性疲劳发生时,会导致LD、BUN等代谢产物积累,糖原、三磷酸腺苷(ATP)等能量物质耗竭,机体氧化与抗氧化系统的代谢失衡,白细胞介素-6、肿瘤坏死因子-α等促炎因子过度释放[25-27]。上述因素相互联系,共同作用,促进了运动性疲劳的产生。
目前研究发现,运动性疲劳产生的最直观表现是运动耐力的下降,可采用负重力竭游泳实验作为评价小鼠耐力和疲劳状态等指标的方法。因此,本研究通过构建递增负荷式游泳训练所致的疲劳小鼠为模型,验证鲣鱼活性肽的抗疲劳作用。本实验结果表明,阳性对照组和鲣鱼活性肽给药组均极显著延长了小鼠负重力竭游泳时间(P<0.01),对提高小鼠耐力以及缓解小鼠疲劳有明显作用。
随着疲劳的产生,机体内会累积LD、MDA 等物质[1-2]。其中,LD 产生于机体的新陈代谢和运动中,LD的堆积会使机体内的环境变酸,导致机体代谢紊乱,从而降低肌肉收缩能力,并诱导疲劳的产生,因此,LD 对调节机体肌肉活力和抗疲劳具有重要作用[28]。MDA 是生物膜中不饱和脂肪酸过氧化反应的终产物之一,其含量多寡与运动性疲劳密切相关[29];当机体剧烈运动时,导致氧化磷酸化反应加快,机体内的自由基含量急剧增加,超出自由基清除酶系统的清除能力,从而引发脂质过氧化反应,使肌肉活力降低,并产生运动性疲劳或运动损伤。BUN 是血清中除蛋白质以外的一种含氮化合物[30];当机体剧烈运动时,随着能量需求激增,会引起蛋白质代谢活跃而导致BUN含量升高,而BUN含量积累越多,机体越疲劳[31]。本研究表明,随着小鼠运动负荷的增加,运动模型组BUN、LD 和MDA 含量均极显著高于安静空白组(P<0.01),说明剧烈运动会导致小鼠体内BUN、LD、MDA 大量堆积。阳性对照组及鲣鱼活性肽给药组BUN 和MDA 含量均能够极显著低于运动模型组(P<0.01);阳性对照组及鲣鱼活性肽中、高剂量组LD 含量极显著低于运动模型组(P<0.01),但鲣鱼活性肽低剂量组与运动模型组相比差异无统计学意义(P>0.05);这表明鲣鱼活性肽能够有效减少小鼠血清BUN、LD含量和肝脏MDA含量的累积,减轻小鼠因乳酸堆积和自由基积累而导致的运动性疲劳出现,从而提升小鼠对运动负荷的适应能力。
LDH 作为糖酵解途径中的重要氧化还原酶类,可催化机体内乳酸和丙酮酸之间的可逆反应,尤其在厌氧条件下能催化丙酮酸产生乳酸,其活性高低与机体内乳酸清除的代谢效率密切相关[32-33]。本实验结果表明,小鼠剧烈运动后,运动模型组LDH 活性极显著升高(P<0.01),与张蕴琨等[34]研究结果相似,这可能与力竭游泳运动会使肌组织产生一定的损伤,致使肌细胞的通透性增加有关;而与运动模型组相比,阳性对照组及鲣鱼活性肽给药组LDH 活性均极显著降低(P<0.01)。进一步分析发现,运动模型组的LDH 活性较高且LD 含量也较高,这可能是由于运动模型组小鼠超负荷运动后机体组织内处于缺氧状态,其丙酮酸脱氢酶无法及时将丙酮酸转换为乙酰辅酶A,从而导致丙酮酸大量堆积,而在较高的LDH 活性下将丙酮酸还原为乳酸,造成运动模型组小鼠血液中LD 含量增加;而阳性对照组和鲣鱼活性肽给药组LDH 活性均降低,其LD 含量也降低,这说明鲣鱼活性肽能有效缓解小鼠超负荷运动所导致的疲劳现象。
SOD 是机体中清除自由基重要的抗氧化酶,对维持机体氧化和抗氧化平衡起着重要作用,其活性高低反应了机体清除自由基的能力以及抗疲劳的效果[35-36]。本实验结果表明,随着小鼠超负荷运动,运动模型组SOD 活性极显著高于安静空白组(P<0.01),这可能是由于小鼠为抵抗运动性疲劳而出现的应激反应,但其活性增加不足以清除小鼠体内过多的自由基,导致运动模型组脂质过氧化终产物MDA 含量的急剧增加;而阳性对照组及鲣鱼活性肽给药组SOD活性极显著高于运动模型组(P<0.01),说明给药组可通过提高SOD 活性来延缓小鼠体内自由基的堆积,降低MDA 含量,使小鼠体内自由基的产生与清除处于动态平衡中,提示鲣鱼活性肽减轻力竭游泳小鼠疲劳的作用可能与增强抗氧化应激能力有关。
综上所述,阳性对照组及鲣鱼活性肽给药组可延长小鼠负重力竭游泳时间,通过提高SOD 活性来降低MDA 含量的积累,降低LDH 活性,减少力竭运动后小鼠血清的LD、BUN 含量,从而增强小鼠运动负荷能力,延缓小鼠疲劳产生。因此认为,通过风味蛋白酶酶解制备的鲣鱼活性肽对缓解小鼠运动性疲劳具有促进作用。

