肠道菌群代谢产物与缺血性脑卒中的交互关系
唐 强
1 黑龙江中医药大学附属第二医院,黑龙江哈尔滨 150001;2 黑龙江中医药大学,黑龙江哈尔滨150040
人类肠道内生活着广泛而活跃的微生物群。人类在这些微生物的作用下不断地与之共同进化,建立了共生关系。肠道微生物作为人类的超级共生体,不仅维持着宿主胃肠道的稳态,还能对人体摄入的三大营养物质进行代谢,产生具有生物活性的代谢产物,如短链脂肪酸(short-chain fatty acids,SCFAs)、三甲胺-N-氧化物(trimethylamine N-oxide,TMAO)、色氨酸代谢物及次级胆汁酸(secondary bile acids,2BAs)来发挥生物学作用。肠道菌群的代谢能力超越了人体细胞的代谢能力[1],代谢产物可以直接或间接与宿主进行信息交换,影响生理和病理活动。脑卒中为世界上病死率第2 高的疾病,是重大的健康问题。约70%的脑卒中由脑血管局灶性闭塞或动脉狭窄引起,归类为缺血性脑卒中(ischemic stroke,IS)[2]。多项研究表明,90%的卒中病例与行为因素有关,如不健康的高脂饮食习惯、缺乏体育锻炼、吸烟和饮酒等。与IS 相关的代谢疾病,如肥胖、高血压和糖尿病等也对肠道菌群的组成和代谢有重要影响。IS 导致肠道菌群紊乱、肠道运动障碍,增加肠道屏障的渗透性,且紊乱的菌群引起代谢产物的失调。代谢产物作为信号分子通过不同途径影响IS 的发展,在脑功能中发挥重要作用,影响着疾病的结局。本文就肠道菌群代谢产物与IS二者之间的交互关系予以阐述,见图1。
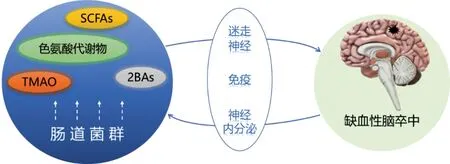
图1 肠道菌群代谢产物与缺血性脑卒中关系简图Figure 1 Schematic of the relationship between microbial metabolites and ischemic stroke
1 文献来源与选择
检索中国知网数据库(CNKI)和万方数据库(Wanfang Data)中文数据库,PubMed和Embase英文数据库。中文检索词为短链脂肪酸、氧化三甲胺、胆汁酸、次级胆汁酸、色氨酸代谢物、肠道菌群代谢产物、免疫、迷走神经、神经内分泌和缺血性脑卒中;英文检索词为ischemic stroke、microbial metabolites、short-chain fatty acids/SCFAs、trimethylamine N-oxide/TMAO、bile acids、secondary bile acids/2BAs、tryptophan、immune、vagus nerve、neuroendocrine。根据不同数据库情况利用检索词进行检索,检索时间为建库至2022 年4 月30 日。纳入描述肠道菌群代谢产物与IS 相关生物学机制的研究以及与IS 患者关系的临床研究,并且搜索了相关综述文章。排除会议摘要,不符合主题的综述文章。对选定的文章进行阅读,总结一致或有争议的观点。根据PRISMA指南进行文献检索[3],文献检索流程见图2。
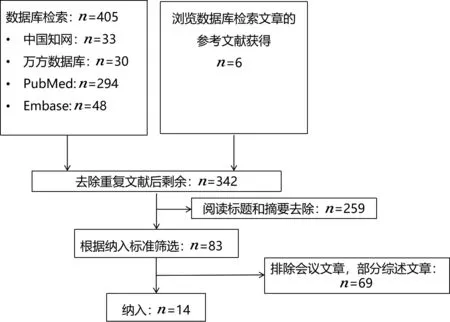
图2 文献检索流程图Figure 2 Flow chart of literature screening
2 肠道菌群代谢产物的形成与功能
肠道菌群能够代谢饮食中的碳水化合物、蛋白质和脂肪,产生大量代谢产物,这些代谢产物是肠道菌群与人体之间相互作用的调节器,可通过调控免疫细胞表达,抑制或激活细胞因子,调节肠道屏障的通透性等方式,作用于IS发病过程[4]。
2.1 SCFAs
SCFAs主要是由未被宿主肠上皮酶消化的膳食纤维,在宿主盲肠和结肠处被肠道菌群厌氧发酵形成的2~5 个碳的单羧酸,可溶于水,氨基酸代谢也可产生SCFAs。SCFAs 主要由丙酸、丁酸和乙酸组成。丙酸和乙酸主要由拟杆菌门的成员产生,丁酸主要由厚壁菌门产生,乙酸也可以通过乙酰辅酶A转移酶转化为丁酸。SCFAs能够维持肠道及血脑屏障的通透性,作为内源性配体与G 蛋白偶联受体结合,介导胰高血糖素样肽1(glucagon-like peptide1,GLP1)的代谢,影响糖耐量,对糖尿病产生调节作用。此外,SCFAs 对脑卒中的其他危险因素如高血压也有影响[5],同时还能改善脂类代谢。
2.2 TMAO
TMAO 是由其前体三甲胺合成的一种具有生物活性的胺类氧化物,大部分的三甲胺通过肠上皮细胞膜被动扩散进入肝门静脉循环,在肝脏中被黄素依赖的单加氧酶氧化生成TMAO[6]。肠道菌群在TMAO 的形成中起着关键作用[7],肠道菌群可代谢食物中的胆碱、肉毒碱或甜菜碱形成三甲胺,一部分三甲胺入血后被富含肝黄素的单加氧酶3氧化生成TMAO,另一部分三甲胺可通过进一步的微生物代谢及粪便排泄从肠道中清除。TMAO 作为一种循环有机化合物,参与整个身体的胆固醇和固醇代谢,通过增加巨噬细胞表面的促动脉粥样硬化清除率相关受体以及CD36 的表达,以微生物依赖的方式促进巨噬细胞中胆固醇的积累,导致动脉硬化。高TMAO水平增加血小板反应性,促使血栓形成,增加IS 的发病风险。此外,TMAO 还可通过影响胰岛素信号转导,加重糖耐量受损来诱发卒中。
2.3 2BAs
肝脏中的胆固醇能够合成胆汁酸(bile acids,BAs),在摄入食物时释放到肠腔中,溶解膳食中的脂质和脂溶性维生素。大脑中发现的胆固醇约占人体总胆固醇的25%,是神经元和神经胶质细胞的组成部分,脑中BAs的起源尚不清楚,但它们可在脑内合成,由BAs转运体从外周循环运输到脑外,或通过血脑屏障弥散。大部分的BAs在整个肠道中主动或被动地回收,然后通过肠肝循环返回肝脏循环,一小部分BAs 以废物形式排出体外。哺乳动物中BAs 主要以初级BAs 和2BAs 存在,初级BAs 在肝细胞通过胆固醇分解代谢合成,而2BAs是初级BAs在肠道中通过微生物代谢生成的衍生物,其合成受肠道菌群的修饰。2BAs 可以通过与膜受体武田G-蛋白耦联受体5(Takeda G protein-coupled receptor 5,TGR5)以及核受体[如法尼酯X 受体(farnesoid X receptor,FXR)]结合从而影响脂类代谢过程。
2.4 色氨酸代谢物
色氨酸在生物体内分别形成内源性代谢产物和细菌源性代谢产物。内源性色氨酸代谢物通过犬嘌呤途径和血清素途径代谢产生。细菌源性代谢产物为肠道菌群直接利用色氨酸将其代谢为吲哚、靛蓝、色胺、粪臭素以及吲哚酸衍生物[8]。
吲哚是主要细菌源性的色氨酸代谢物,大肠杆菌、普通变形杆菌、大肠菌群副大肠杆菌和拟杆菌均能产生吲哚[9]。吲哚作为一种有效的生物活性代谢产物,通过激活孕烷X 受体或芳香烃受体影响小鼠肠道屏障的完整性及免疫细胞[10],并能通过血脑屏障。吲哚可诱导正常细胞的相关基因表达,加强黏膜屏障和黏蛋白的产生,从而增强对病原体入侵的抵抗力;对于炎症细胞,吲哚可抑制NF-κB 的激活和促炎趋化因子的产生,同时增加抗炎细胞因子的产生,改善炎症损伤。
3 肠道菌群代谢产物介导的通信方式
大量研究表明,肠道菌群对中枢神经系统的影响主要通过免疫途径和神经内分泌途径自下而上地调节,通常还涉及迷走神经。这些通信方式主要由肠道菌群代谢产物介导,通过肠内各种细胞以及黏膜免疫系统的相互作用来传递信号[11-12]。
3.1 免疫途径
IS 发生后,血脑屏障的完整性受损,血管周围的小胶质细胞分泌自由基、一氧化氮及谷氨酸等有害分子驱动免疫炎症反应。同时,肠道内的免疫稳态也发生变化,并可通过产生炎症因子以及招募外周免疫细胞进入大脑的方式,加重脑损伤。淋巴细胞入侵缺血部位脑组织是中风后神经炎症的标志,入侵大脑的淋巴细胞所分泌的细胞因子可以调节小胶质细胞的激活[13]。SADLER 等[14]研究发现,与正常小鼠相比,给予淋巴细胞缺失的小鼠补充SCFAs后,其脑内小胶质细胞的形态及数量未受影响,这一实验表明SCFAs 通过淋巴细胞对小胶质细胞发挥生物学作用。有研究发现,乙酸能够通过降低p38 MAPK、JNK 和NF-κB 的磷酸化来减少炎症信号转导并抑制TNF-α、IL-1β 及IL-6 表达,可见SCFAs 在免疫反应中发挥积极的作用。而代谢产物TMAO 却可激活NLRP3 炎症小体介导血管炎症[15]。SUBRAMANIAM 和FLETCHER[16]研究提示,TMAO能增加内皮细胞外基质表达,诱导血管炎症反应。血管炎症的增加可直接影响动脉粥样硬化,促进血管僵硬与老化,影响IS的发生和发展。此外,ZELANTE等[17]在自身免疫性脑炎小鼠模型中,通过补充色氨酸代谢物吲哚-3-丙酸(indole-3-propionic acid,IPA)、吲哚-3-醛,成功减轻了中枢神经系统炎症。以上研究表明,肠道菌群代谢产物可通过作用于免疫细胞,影响细胞因子的分泌等方式调节免疫过程。但是不同的代谢产物发挥着不同的免疫作用,如何调控这些代谢产物也将成为后续研究努力的方向。
3.2 神经内分泌途径
神经内分泌系统是一组与神经系统高度相关的内分泌细胞,它们产生激素或神经肽,此系统高度适应从环境中感知外部信号,并在身体各处传递信息,其中下丘脑-垂体-肾上腺素(hypothalamicpituitary-adrenal,HPA)轴是其重要成员。肠道内分泌细胞(enteroendocrine cells,EECs)能在肠道菌群的影响下分泌一些能被BAs或SCFAs识别的肽类激素受体[18]。FUNG 等[19]研究表明,SCFAs 和2BAs 可刺激EECs 调控肠腔内5-羟色胺的合成和释放。乙酸盐能调节下丘脑中的神经递质谷氨酸、谷氨酰胺以及γ-氨基丁酸的水平[20],可通过调节谷氨酸代谢来参与卒中后兴奋性毒性的病理过程。此外,丁酸盐能够刺激小鼠脑源性神经生长因子(brain-derived neuotrophyic factor,BDNF)表达,促进神经发生和神经细胞增殖[21]。ANDERSSON 等[22]进行了随机、双盲、安慰剂对照研究,给即将考试的41名学生口服含有植物乳杆菌299v 的胶囊,10 d 后唾液中的皮质醇含量显著下降,说明益生菌能够降低应激状态下的皮质醇分泌。应激是IS 的主要发病机制之一,对大量IS 临床研究的系统评价和分析认为与应激相关的HPA 轴的激活是最有前途的预后标志[23]。作为HPA 轴上的关键,激素皮质醇在急性IS患者血浆中显著升高,是90 d 和1 年内死亡功能结局的独立预后标志物,且与血浆BDNF 水平呈负相关。以上研究表明,肠道菌群及其代谢产物可能通过影响皮质醇的分泌参与HPA 轴的调节而影响IS 患者的预后。
3.3 迷走神经途径
尽管肠道菌群及其代谢产物可以通过上述2种方式进行交流,但影响大脑最快、最直接的方式是迷走神经途径。迷走神经是由80%感觉(传入)和20%运动(传出)神经纤维组成的混合脑神经,连接内脏和大脑。迷走神经的传入纤维可以通过细菌化合物或代谢产物跨越胃肠道屏障的扩散,间接感知腔内信号,并传入大脑。电生理学实验已经证明迷走神经对包括细胞因子、营养物质、肠肽和激素在内的各种刺激均有反应。一些菌株能产生神经递质如血清素,当神经递质被吸收时,可以直接作用于迷走神经末梢或通过激活肠内神经元间接发挥作用[24]。
研究人员发现罗伊氏乳杆菌通过激活迷走神经,从而增加下丘脑室旁核中的催产素水平,改变了自闭症谱系障碍小鼠的社会行为,使其社交行为正常化,而该治疗效果未体现在迷走神经切除的小鼠身上[25]。之前的实验也表明,切除迷走神经后,鼠李糖乳杆菌不能增加小鼠大脑中γ-氨基丁酸受体的表达和减轻其焦虑、抑郁样症状[26]。可见,肠道菌群改变宿主的情绪和行为反应的途径与迷走神经有关。BAs可以激活肠道中的FXR向中枢神经系统发出信号,促进GLP-1 的释放进入血液,刺激迷走神经传入纤维向大脑发出信号[27]。对于IS 患者来说,给予迷走神经脉冲式刺激能够显著地改善上肢功能障碍,且获得临床症状改善的患者人数是常规康复治疗人数的2 倍[28]。在1 项长期随访的研究中发现,迷走神经刺激联合触觉治疗能有效地改善患者手臂感觉功能,刺激迷走神经可增加大脑轴突可塑性,改善患者预后[29]。此外,迷走神经还能抑制神经炎症,促进小胶质细胞M2 极化,减轻脑损伤,同时促进血管生成。因此,下一步可系统研究通过益生菌及肠道菌群代谢产物刺激迷走神经这种非侵入性治疗方法来促进脑卒中患者康复的治疗手段,发挥肠道菌群代谢产物的治疗潜力。
4 肠道菌群代谢产物在缺血性脑卒中的作用
4.1 SCFAs与IS
SADLER 等[14]发现大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)小鼠血浆SCFAs 含量越低,预后越差,予口服由乙酸钠、丁酸钠及丙酸钠混合的SCFAs 后,发现其有助于小鼠行为的恢复。这一作用提示SCFAs 可能参与提高突触可塑性。在临床研究中也观察到相似的SCFAs 变化。YAMASHIRO等[30]发现IS患者粪便中乙酸的浓度降低;同时还发现乙酸的浓度越低,IS 患者糖化血红蛋白水平越高。TAN 等[31]研究发现,与健康对照组相比,急性IS 患者的粪便SCFAs 急剧下降且缺乏产生SCFAs 的菌群,进一步的分析显示,紊乱的肠道菌群和低水平的乙酸、丙酸含量,预示着不良的中风结局,但丁酸的结果与之相反。有研究发现,给老年MCAO 小鼠口服能产生SCFAs 的细菌,可以减轻老年小鼠卒中后的神经功能缺陷和炎症,提高老年卒中小鼠血浆、肠道和大脑中的SCFAs 含量;此外,该研究还发现SCFAs 含量随着年龄的增长而减少[32]。目前的研究证实SCFAs 能够减轻IS 后神经系统炎症,增强皮质网络连接,改善IS 的预后,但不同的SCFAs可能发挥不同的功能。
4.2 TMAO与IS
临床研究表明IS 患者或有短暂性脑缺血发作史的受试者血浆TMAO 水平升高,并且与不良的临床预后相关联[33-35]。卒中前高水平的TMAO 含量能够影响卒中的严重程度。给无菌小鼠移植产高TMAO 水平和产低TMAO 水平的微生物群,发现移植产高TMAO水平菌群的受体小鼠卒中后表现出更大的梗死面积[11]。SU 等[36]的研究发现,TMAO 可促进卒中后反应性星形胶质细胞增多和神经胶质瘢痕的形成,以抑制神经功能恢复。此外,TMAO 水平与卒中的复发也存在关联。最近的研究指出,大动脉粥样硬化型IS 患者的血浆TMAO 水平在72 h 之内显著升高,并且能够作为卒中后前3 个月血管事件复发的预测生物标志物[37]。虽然目前的研究明确了血浆TMAO 在卒中后的变化,但无法明确其在卒中之前是否发生变化,并且TMAO 对卒中患者的长期影响值得进一步观察。
4.3 2BAs与IS
脑缺血时,由于氧和葡萄糖的缺乏会引发多种病理事件,如线粒体功能障碍伴能量耗竭、突触内谷氨酸积累和细胞内钙离子稳态失调。RODRIGUES等[38]研究发现,给予MCAO 大鼠静脉注射2BAs(牛黄熊脱氧胆酸)可通过减少缺血性损伤引起的线粒体功能障碍来减少神经元死亡,改善大鼠的神经功能,并且有益作用可持续7 d。研究发现,给予急性IS患者口服牛黄熊脱氧胆酸(100 mg/次,3 次/d,连续口服1 周),发现患者的神经功能较前改善,血清脂质水平也较前降低,这一现象被认为是通过降低Nfr2信号通路来实现的[39]。此外,2BAs也与IS高危因素息息相关,影响IS 的发病。如2BAs 能促进肠道L 细胞分泌GLP1,挽救胰岛素抵抗和糖代谢异常[27],并可阻断2型糖尿病及动脉粥样硬化中NLRP3炎症小体的活化[40]。
虽然早在20 世纪70 年代就提出了BAs 调节人类大脑功能的可能性,而且BAs 和其受体也在大脑中被发现,但BAs 作为肠道和大脑之间的沟通方式却很少被探索。尤其是2BAs 影响中枢神经系统的分子机制和生理作用研究甚少,特别是在IS 领域。因此,微生物来源的2BAs 是IS 中一个有待深入研究的方向。
4.4 色氨酸代谢物与IS
XIE 等[41]的研究指出卒中后小鼠血清IPA 水平显著降低。MCAO 小鼠的肠道菌群结构在灌胃IPA后被重塑,益生菌丰度增加,有害菌丰度减少,并且增强了肠屏障功能和上皮完整性。该研究还表明IPA 通过减少星形胶质细胞活化以及神经元凋亡发挥神经保护作用,从而改善MCAO 小鼠的预后。另有研究指出IPA 能够激活芳香烃受体,从而抑制中枢神经系统炎症[42],有助于肠道菌群的抗炎作用[43]。但是有研究却认为脑缺血时,小胶质细胞芳香烃受体的激活可诱导氧化应激和炎症反应,引起血管源性水肿,进而加重脑损伤[44]。这一矛盾的研究结果可能是由于不同细菌源性的色氨酸代谢物生物功能不同,或者所激活的芳香烃受体表型不同。目前,关于细菌源性色氨酸代谢物与IS 之间关系的研究较少,对于二者之间的作用机制尚不清晰,有待于我们在后续的研究中挖掘。
5 总结与展望
肠道菌群与其宿主哺乳动物之间的双向交流是二者相互作用的结果。很明显的是,肠道菌群产生的代谢产物是这种交流的一个重要环节,可通过影响免疫、神经内分泌及迷走神经途径参与IS 的发病过程。尽管肠道菌群代谢产物与IS 之间关系的研究已经取得了一定的进展,但仍存在矛盾与不足。不同肠道菌群代谢产物发挥不同的作用,在今后的研究中需要进一步去研究其各自在IS 发病过程中的病理和生理分子机制,明确其在IS 不同阶段中的变化。进一步阐明代谢产物对IS 患者预防及治疗的影响,研究开发可用于改善肠道菌群代谢产物的方法,并寻找可信度高的肠道菌群代谢产物来判断IS 的风险、进展及预后,是未来的肠道菌群组学的发展方向。

