LINC02163靶向miR-338-3p影响乳腺癌细胞增殖、侵袭及迁移
张景臣,李 新,李江涛,李海平,陈艳丽,牛 冰,祁川川,叶贝贝
郑州人民医院乳腺科,河南 郑州 450053
乳腺癌作为在全球女性中最为常见的恶性肿瘤,尽管目前其诊断及治疗取得了极大的进步,但患者预后情况仍不能令人满意,其中,转移是造成患者死亡的主要原因之一,极大地降低了疗效,因此,全面了解乳腺癌的进展和转移机制对改善患者预后具有重要作用[1]。非编码RNA(non-coding RNA,ncRNA)包括长链ncRNA(long ncRNA,lncRNA)及微小RNA(micro RNA,miRNA)等,lncRNA可作为miRNA海绵来调控后者表达,两者已被发现在乳腺癌中失调,与肿瘤恶性生物学行为具有密切相关性[2-3]。LINC02163被发现在乳腺癌[4]、结直肠癌[5]等癌症中异常上调,将其敲除可抑制乳腺癌细胞的恶性行为[4],目前关于其在乳腺癌中的相关机制研究甚少。有研究[6]证实,miR-338-3p在乳腺癌组织中呈低表达状态,抑制其表达可增强乳腺癌细胞(MCF7、HCC1937)生长、迁移及侵袭和上皮-间充质转化(epithelial-mesenchymal transition,EMT)过程。LINC02163对乳腺癌细胞恶性生物学行为的促进是否与其靶向调控miR-338-3p表达有关值得探究,因此,本研究通过探究LINC02163靶向miR-338-3p对乳腺癌细胞增殖、侵袭及迁移的影响,以期为阐明乳腺癌的发生机制提供线索。
1 材料和方法
1.1 实验动物
将从河南省实验动物中心购买的25只6周龄BALB/c裸小鼠[19~22 g,无特定病原体(specific pathogen free,SPF)级]饲养于保持12 h昼夜交替的环境中7 d,许可证号:SCXK(豫)2017-0001。
1.2 试剂和仪器
MCF-10 A、MCF-7、BT-20、MDA-MB-231、T47D细胞系(A2789、SG2226、A2874、ATCC-Y2455、SY4472)购自上海酶研生物科技有限公司,sh-NC、sh-LINC02163、inhibitor-NC、miR-338-3p inhibitor购自广州市锐博生物科技有限公司,LipofectamineTM2000 Transfection Reagent(11668-019)购自上海伟进生物科技有限公司,DMEM 培养基(PM150210)购自武汉益普生物科技有限公司,二辛可宁酸(bicinchoninic acid,BCA)法蛋白检测试剂盒(mlE3254)购自上海酶联生物科技有限公司,双荧光素酶检测试剂盒(Omt-03)购自北京奥秘佳得医药科技有限公司,兔抗β-actin、c-Myc、E-钙粘素(E-cadherin)、N-钙粘素(N-cadherin)、基质金属蛋白酶(matrix metalloproteinase,MMP)2、MMP9抗体、羊抗兔免疫球蛋白G H&L[辣根过氧化物酶(horseradish peroxidase,HRP)标记](ab8227、ab32072、ab40772、ab18203、ab37150、ab38898、ab6721)购自英国Abcam公司,MTT检测试剂盒、反转录试剂盒(M1020-500、RP1105)购自北京索莱宝科技有限公司,组织化学试剂盒(G1210)购自上海经科化学科技有限公司,兔源抗体Ki-67(100 µg、0.8~1.04 mg/mL,ab15580)购自英国Abcam公司,实时荧光定量聚合酶链反应(real-time fluorescence quantitative polymerase chain reaction,RTFQPCR)试剂盒(QPG-020~QPG-023)购自上海吉玛制药技术有限公司,Gentier 48E/48R RTFQPCR检测系统(FQD-96A)购自西安天隆科技有限公司,SH-520凝胶成像系统购自杭州申花科技有限公司。
1.3 实验方法
1.3.1 临床组织样本获取
收集郑州人民医院2020年1月—2021年9月收治的9例女性乳腺癌患者的乳腺癌组织及距癌组织2 cm外的癌旁组织样本,患者年龄40~60岁,平均(45.68±3.05)岁。本研究经郑州人民医院伦理委员会批准且患者及家属均签署知情同意书。通过RTFQ-PCR检测组织中的LINC02163表达。
1.3.2 细胞培养
在DMEM培养基中接种人正常乳腺上皮细胞系(MCF-10A)和乳腺癌细胞系(MCF-7、BT-20、MDA-MB-231、T47D),于37 ℃、CO2体积分数为5%的常规培养箱中培养至细胞融合度为80%。
1.3.3 分组及转染
以2×105个/孔将MDA-MB-231细胞接种到6孔板中,于37 ℃恒温培养24 h后,将其分为control组、sh-NC组、sh-LINC02163组、sh-LINC02163+inhibitor-NC组和sh-LINC02163+miR-338-3p inhibitor组,使用LipofectamineTM2000试剂盒将sh-NC、sh-LINC02163、inhibitor-NC和miR-338-3p inhibitor分别转染至相应组的MDAMB-231细胞中,48 h后采用RTFQ-PCR检测LINC02163及miR-338-3p表达。
1.3.4 双荧光素酶报告基因实验分析LINC02163与miR-338-3p的靶向关系
采用starBase2.0网址预测LINC02163与miR-338-3p的结合位点;扩增LINC02163上与miR-338-3p结合的片段,插入pmirGLO载体:构建野生型LINC02163-wt质粒;采用基因突变技术对结合位点进行突变,构建突变型LINC02163-mut质粒。将MDA-MB-231细胞分为LINC02163-wt+miR-338-3p mimics组、LINC02163-wt+miRNC组、LINC02163-mut+miR-338-3p mimics组和LINC02163-mut+miR-NC组,将miR-NC、miR-338-3p mimics、LINC02163-wt和LINC02163-mut分别共转染至MDA-MB-231细胞中,24 h后检测海肾及萤火虫荧光素酶值,计算MDA-MB-231细胞的相对荧光素酶活性。
1.3.5 RTFQ-PCR检测LINC02163及miR-338-3p表达
使用TRIzol试剂提取乳腺癌组织样本及MCF-10A、MCF-7、BT-20、MDA-MB-231、T47D细胞总RNA,反转录成cDNA后行RTFQPCR扩增(GAPDH作为LINC02163内参,U6作为miR-338-3p内参),引物见表1,用2-∆∆Ct分析LINC02163及miR-338-3p的表达水平(n=5)。
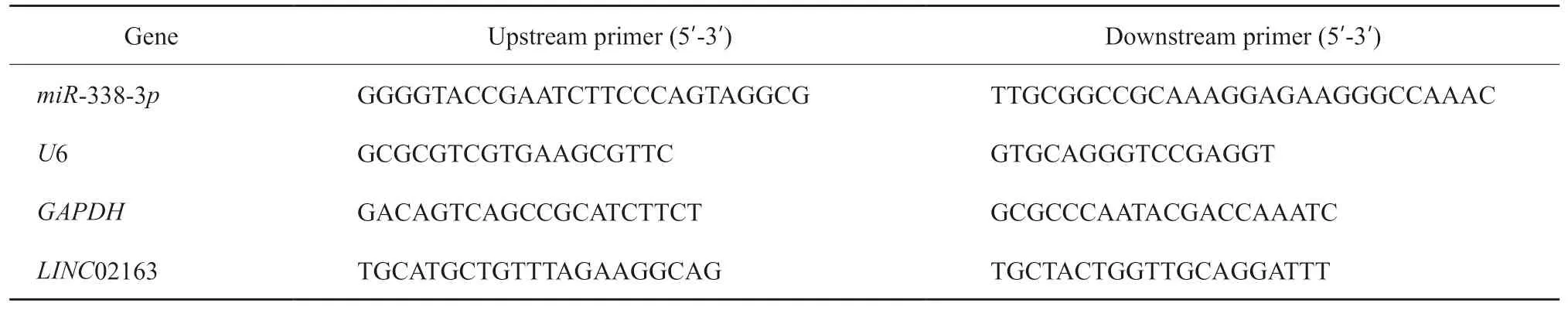
表1 RTFQ-PCR引物Tab.1 RTFQ-PCR primers
1.3.6 MTT法检测MDA-MB-231细胞活力
收集各组MDA-MB-231细胞按2.5×104个/孔接种到96孔板中,48 h后按20 μL/孔添加5 mg/mL MTT溶液温育4 h,吸去培养液后加入二甲基亚砜(dimethyl sulfoxide,DMSO)(150 μL)振荡摇晃,待结晶消失后用酶标仪测定细胞490 nm处的吸光度(D)值,细胞存活率(%)=[(实验组D值-空白组D值)/(对照组D值-空白组D值)]×100%,重复5孔。
1.3.7 Transwell实验检测MDA-MB-231细胞侵袭
使用Matrigel 基质胶将上室包被24 h后,于上室接种各组MDA-MB-231细胞悬液(1×104个/孔),下室添加DMEM培养基500 μL,培养48 h后弃培养基,使用无菌棉签将上室未穿膜的细胞擦去,下层细胞经过多聚甲醛溶液固定后进行结晶紫染色(30 min),在倒置显微镜下随机观察5个视野,并对穿膜细胞进行计数(n=5)。
1.3.8 划痕实验检测MDA-MB-231细胞迁移
收集MDA-MB-231细胞接种在6孔板中(2×105个/孔),培养24 h,用移液枪吸嘴(200 μL)于6孔板底部划痕,用磷酸缓冲盐溶液(phosphate-buffered saline,PBS)清洗,测量划痕间距,记为d0h,24 h后再次测量间距,记为d24h,计算迁移率=(d0h-d24h)/d0h]×100%,重复5孔。
1.3.9 Western blot检测MDA-MB-231细胞c-Myc、MMP2、MMP9、E-cadherin和N-cadherin蛋白的表达
采用RIPA试剂裂解MDA-MB-231细胞后提取总蛋白,通过BCA法定量分析蛋白浓度,经十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecylsulphate polyacrylamide gel electrophoresis,SDS-PAGE)后将所分离的蛋白转到PVDF 膜上,封闭2 h 后添加兔抗c-Myc、β-actin、MMP2、MMP9、E-cadherin和N-cadherin抗体(1∶1 000),摇床上温育过夜后添加二抗(1∶3 000)温育2 h,电化学发光(electrochemical luminescence,ECL)显色,凝胶系统曝光,计算c-Myc、MMP2、MMP9、E-cadherin和N-cadherin蛋白的表达(n=5)。
1.3.10 体内成瘤实验
在BALB/c裸小鼠腋下分别注射各组MDAMB-231细胞(2×107个),每周测量1次:肿瘤体积(mm3)=0.5×肿瘤最长径×肿瘤最短径2,饲养30 d后处死裸小鼠,取瘤体并称重(n=5)。体内成瘤实验经郑州人民医院伦理委员会批准。
1.3.11 免疫组织化学法检测裸小鼠肿瘤组织的Ki-67增殖指数
取1.3.10的肿瘤组织进行常规石蜡切片制作,经脱蜡及水化后,添加3%的H2O2以去除内源性的过氧化物酶,枸橼酸缓冲液对抗原进行热修复后封闭(牛血清白蛋白)20 min,Ki-67一抗温育1 h,温育生物素标记的二抗30 min,依次进行二氨基联苯胺(diaminobenzidine,DAB)液染色、苏木精复染,HCl分化、脱水、透明及观察(×200),Ki-67阳性细胞呈棕褐色(n=5)。
1.4 统计学处理
2 结果
2.1 LINC02163在乳腺癌及相应癌旁组织中的表达比较
与癌旁组织相比,LINC02163在乳腺癌组织中的表达显著升高(1.00±0.06vs1.92±0.20)(n=9,t=13.218,P<0.05,图1)。
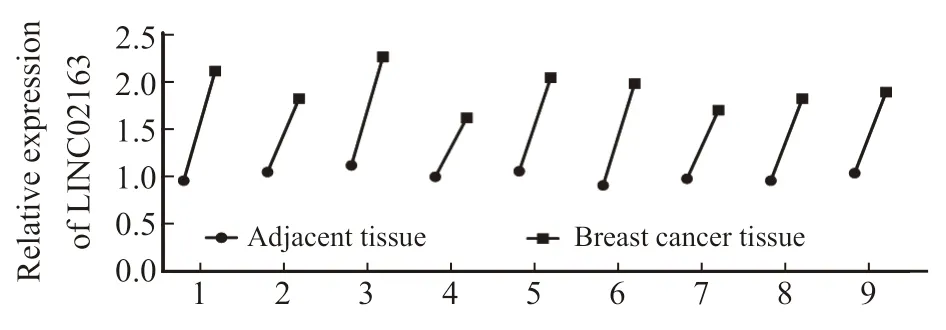
图1 LINC02163在乳腺癌及相应癌旁组织中的表达比较Fig.1 Comparison of the expression of LINC02163 in breast cancer and corresponding adjacent tissues
2.2 LINC02163在人正常乳腺上皮细胞系(MCF-10A)和乳腺癌细胞系(MCF-7、BT-20、MDA-MB-231、T47D)中的表达水平比较
与MCF-10 A 细胞(1.01±0.09)相比,LINC02163在MCF-7、BT-20、MDAMB-231和T47D细胞中的表达均显著升高,分别为1.40±0.11、1.62±0.24、2.06±0.32和1.51±0.16,并且其在MDA-MB-231细胞中升高最为显著(P<0.05),因此取MDA-MB-231细胞进行后续实验。
2.3 LINC02163与miR-338-3p靶向关系的验证
采用starBase网址预测LINC02163与miR-338-3p间存在结合位点,详见图2。双荧光素酶报告基因实验结果显示,与LINC02163-wt+miRNC组相比,MDA-MB-231细胞荧光素酶活性在LINC02163-wt+miR-338-3p mimics组中显著降低(0.89±0.09vs0.41±0.05,P<0.05),而在LINC02163-mut+miR-338-3p mimics组、LINC02163-mut+miR-NC组中无显著变化(0.87±0.09vs0.88±0.10,P>0.05)。

图2 LINC02163与miR-338-3p结合位点Fig.2 Binding site of LINC02163 and miR-338-3p
2.4 各组MDA-MB-231细胞中LINC02163及miR-338-3p表达水平的比较
与control组相比,LINC02163及miR-338-3p表达在sh-NC组中无显著变化(P>0.05),sh-LINC02163组LINC02163表达显著降低,miR-338-3p表达显著升高(P<0.05)。与sh-LINC02163组相比,LINC02163及miR-338-3p表达在sh-LINC02163+inhibitor-NC组中无显著变化(P>0.05),sh-LINC02163+miR-338-3p inhibitor组LINC02163表达无显著变化(P>0.05),miR-338-3p表达显著降低(P<0.05,图3)。
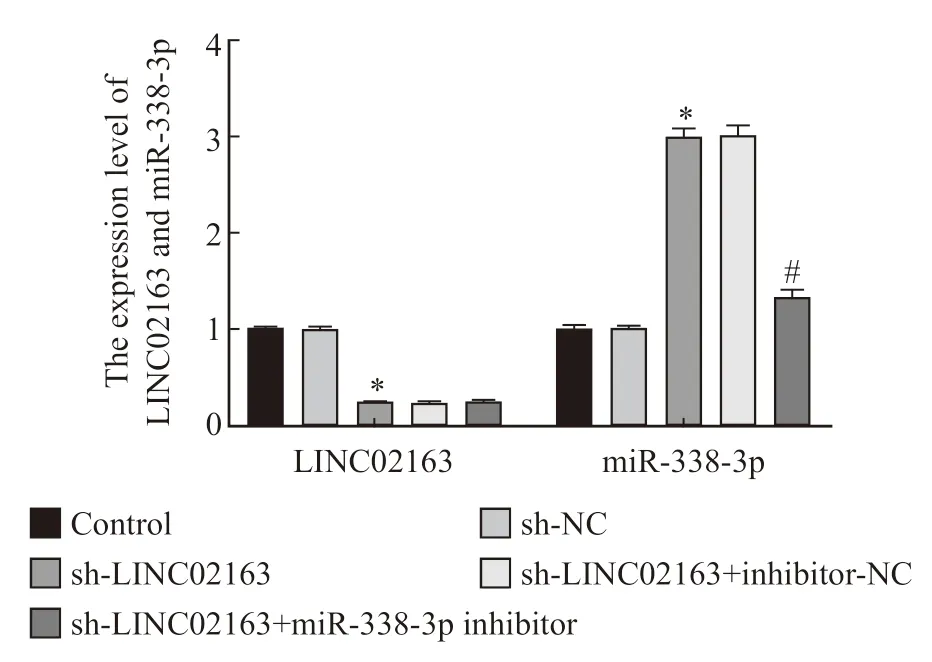
图3 各组MDA-MB-231细胞中LINC02163及miR-338-3p表达水平的比较Fig.3 Comparison of LINC02163 and miR-338-3p expression levels in MDA-MB-231 cells in each group
2.5 各组MDA-MB-231细胞存活率的比较
与control组相比,MDA-MB-231细胞存活率在sh-NC组中无显著变化(P>0.05),在sh-LINC02163组中显著降低(P<0.05)。与sh-LINC02163组相比,MDA-MB-231细胞存活率在sh-LINC02163+inhibitor-NC组中无显著变化(P>0.05),在sh-LINC02163+miR-338-3p inhibitor组中显著增加(P<0.05,图4)。
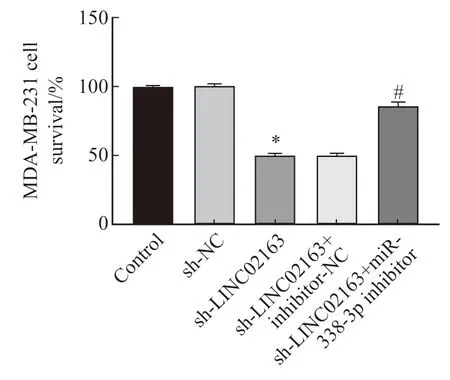
图4 各组MDA-MB-231细胞存活率的比较Fig.4 Comparison of MDA-MB-231 cell survival rate in each group
2.6 各组MDA-MB-231细胞侵袭能力的比较
与control组相比,MDA-MB-231细胞侵袭细胞数在s h-N C 组中无显著变化(P>0.05),在sh-LINC02163组中显著降低(P<0.05)。与sh-LINC02163组相比,侵袭细胞数在sh-LINC02163+inhibitor-NC组中无显著变化(P>0.05),在sh-LINC02163+miR-338-3p inhibitor组中显著增加(P<0.05,图5)。
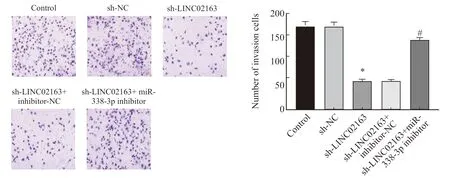
图5 各组MDA-MB-231细胞侵袭能力的比较Fig.5 Comparison of the invasion ability of MDA-MB-231 cells in each group
2.7 各组MDA-MB-231细胞迁移能力的比较
与control组相比,MDA-MB-231细胞迁移率在sh-NC组中无显著变化(P>0.05),在sh-LINC02163组中显著降低(P<0.05)。与sh-LINC02163组相比,细胞迁移率在sh-LINC02163+inhibitor-NC组中无显著变化(P>0.05),在sh-LINC02163+miR-338-3p inhibitor组中显著增加(P<0.05,图6)。

图6 各组MDA-MB-231细胞迁移能力的比较Fig.6 Comparison of MDA-MB-231 cell migration ability in each group
2.8 各组MDA-MB-231细胞c-Myc、MMP2、MMP9、E-cadherin和N-cadherin蛋白水平的比较
与control组相比,MDA-MB-231细胞c-Myc、MMP2、MMP9、E-cadherin和N-cadherin蛋白水平在sh-NC组中无显著变化(P>0.05),c-Myc、MMP2、MMP9和N-cadherin水平在sh-LINC02163组中显著降低,E-cadherin水平显著增加(P<0.05)。与sh-LINC02163组相比,c-Myc、MMP2、MMP9、E-cadherin和N-cadherin水平在sh-LINC02163+inhibitor-NC组中无显著变化(P>0.05),c-Myc、MMP2、MMP9和N-cadherin水平在sh-LINC02163+miR-338-3p inhibitor组中显著增加,E-cadherin水平显著降低(P<0.05,表2,图7)。
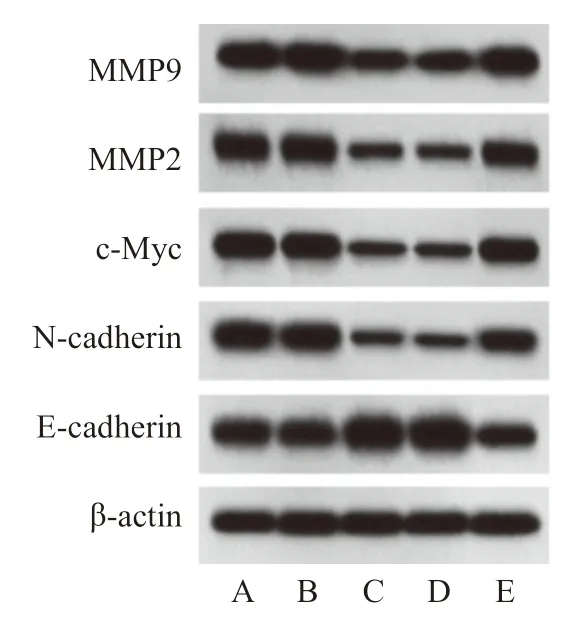
图7 各组MDA-MB-231细胞蛋白水平的比较Fig.7 Comparison of MDA-MB-231 cell protein level in each group
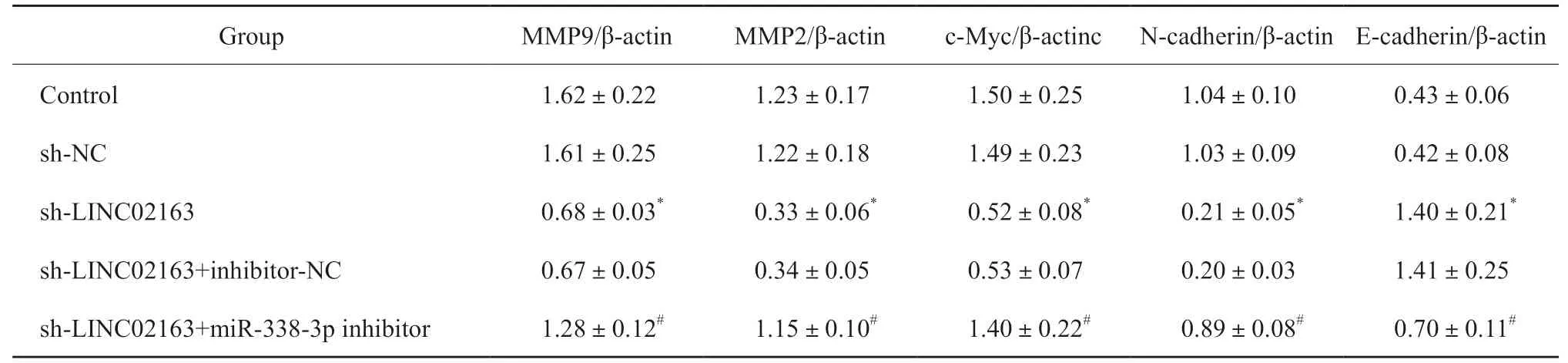
表2 各组MDA-MB-231细胞c-Myc、MMP2、MMP9、E-cadherin、N-cadherin蛋白表达的比较Tab.2 Compare of c-Myc,MMP2,MMP9,E-cadherin,and N-cadherin protein expression in each group of MDA-MB-231 cells
2.9 各组MDA-MB-231细胞成瘤能力及移植瘤组织Ki-67增殖指数的比较
与control组相比,肿瘤体积及重量、Ki-67增殖指数在sh-NC组中无显著变化,差异无统计学意义(P>0.05),在sh-LINC02163组中显著降低,差异有统计学意义(P<0.05)。与sh-LINC02163组相比,肿瘤体积及重量、Ki-67增殖指数在sh-LINC02163+inhibitor-NC组中无显著变化,差异无统计学意义(P>0.05),在sh-LINC02163+miR-338-3p inhibitor组中显著增加,差异有统计学意义(P<0.05,图8)。
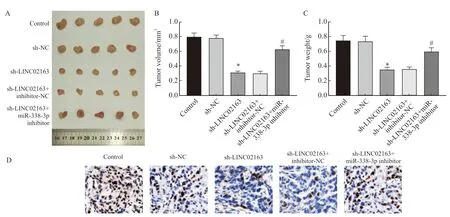
图8 各组MDA-MB-231细胞成瘤能力及Ki-67增殖指数的比较Fig.8 Comparison of tumor-forming ability and Ki-67 proliferation index of MDA-MB-231 cells in each group
3 讨论
随着生活节奏的加快及工作压力的增加,乳腺癌的发生率也在逐渐升高,尽管近年来患者的生存率明显提高,预后也明显改善,但术后复发转移仍是患者死亡的主要原因[7-8],乳腺癌患者整体5年生存率约为90%,而转移患者5年生存率仅为26%,因此,阐明乳腺癌的潜在转移机制,寻找新的治疗靶点对患者生存至关重要[9]。
长度大于200个核苷酸的lncRNA作为一类来自基因组非编码区的转录本,被发现可调节癌症的许多重要病理学过程,如肿瘤发生、增殖、转移及抗药性[10]。LINC02163是近几年新发现的lncRNA,尽管被发现在胃癌[11]、结直肠癌[12]、肝癌[13]及乳腺癌[4]中具有明显的促癌作用,但其机制仍不完全清楚。LINC02163可通过抑制miR-511-3p/蛋白激酶B(protein kinase B,AKT)3轴促进结直肠癌进展,而抑制其表达则可减弱癌细胞的增殖和转移[12]。LINC02163在乳腺癌组织中表达上调,其表达与淋巴结转移、TNM分期、肿瘤大小密切相关,在体外抑制LINC02163表达可降低MDA-MB-231及MCF-7细胞增殖、迁移和侵袭并增加细胞凋亡,这可能与其激活miR-511-3p/高迁移率族蛋白A2(high mobility group A2,HMGA2)轴有关[4]。EMT是细胞由上皮极性向间充质细胞特性转化的过程,该过程中由于E-cadherin表达降低,而N-cadherin表达增加,可降低细胞间的黏附作用,从而促进肿瘤细胞转移[14]。本研究发现,LINC02163在乳腺癌组织及细胞系中表达显著升高,抑制其表达可显著降低MDA-MB-231细胞存活率、侵袭细胞数及迁移率、c-Myc、MMP2、MMP9、N-cadherin表达、裸小鼠移植瘤体积及重量、肿瘤组织中的Ki-67增殖指数,增加E-cadherin表达,与之前的研究[4]一致,本研究结果表明,LINC02163表达降低可抑制乳腺癌细胞增殖、迁移、转移及EMT过程,其可作为乳腺癌复发、转移机制研究的潜在靶点。
有研究[15]显示,miRNA在癌症中失调,可充当肿瘤抑制因子或癌基因参与癌症进程。miR-338-3p可在胃癌中通过直接靶向SOX5并阻断Wnt/β-连环蛋白(β-catenin)信号转导来充当肿瘤抑制因子[16]。Zhang等[17]研究发现,miR-338-3p在乳腺癌组织及乳腺癌细胞系(BCAP-37和HCC1937)中表达降低,Hsa_circ_0008945可通过靶向抑制miR-338-3p表达来促进同源框A3(homeobox A3,HOXA3)表达,从而加快乳腺癌进程。黄芩苷可通过促进miR-338-3p表达来抑制MORC4表达,从而抑制MCF-7及MDAMB-231细胞活力、迁移及侵袭,并促进细胞凋亡[18]。本研究证实在乳腺癌中miR-338-3p是LINC02163的靶基因,LINC02163过表达可抑制miR-338-3p表达,因此,LINC02163可能通过靶向miR-338-3p促进乳腺癌细胞增殖、侵袭及迁移。本研究还发现,LINC02163表达沉默可促进miR-338-3p表达,而降低miR-338-3p表达可逆转LINC02163低表达对MDA-MB-231细胞增殖、迁移、转移及EMT过程的抑制作用,表明LINC02163低表达可能是通过促进miR-338-3p表达来抑制乳腺癌细胞的恶性生物学行为。
综上所述,LINC02163低表达可通过促进miR-338-3p表达来抑制乳腺癌细胞增殖、侵袭及迁移。本研究不仅有助于阐明LINC02163在乳腺癌中的作用机制,还为寻找新的治疗靶点提供了线索,但仍需深入研究。
利益冲突声明:所有作者均声明不存在利益冲突。

