DZNep调控乳腺癌外泌体在肿瘤微环境中的作用
吕 叶,英叶霞,杨文静,厚玉瑾,袁春秀,曹相玫
1.宁夏医科大学总医院肿瘤医院肿瘤内科,宁夏 银川 750002;
2.宁夏医科大学基础医学院病理学系,宁夏 银川 750002
乳腺癌是全球女性发病率最高的恶性肿瘤,复发和转移是乳腺癌患者死亡的主要原因[1]。外泌体介导肿瘤细胞与肿瘤微环境之间的信息交流,促进细胞因子、生长因子和血管生成因子的分泌,诱导肿瘤增殖和转移[2]。外泌体是由多囊泡体与细胞中的质膜融合后释放的直径为40~140 nm的双层膜纳米囊泡[3]。释放到微环境中的外泌体,通过参与细胞间的通信而发挥功能[4]。例如,胃癌源性外泌体携带的蛋白质和miRNA在肿瘤增殖和侵袭中发挥关键作用[5];肿瘤干细胞(cancer stem cell,CSC)分泌的外泌体对肿瘤细胞有重新编程的作用,CSC微环境中的其他细胞同样可以通过外泌体使肿瘤细胞向CSC转化[6]。我们的前期研究[7]发现,DZNep能够抑制癌细胞生长和侵袭,但其对乳腺癌外泌体形成的影响还尚不清楚。
DZNep作为1个全新的靶向癌症表观遗传学过程的染色质修饰药物,通过组蛋白修饰和miRNA等多种途径抑制肿瘤增殖、侵袭和转移,其抗肿瘤作用日益受到关注[8]。DZNep是一种S-腺苷同型半胱氨酸水解酶抑制剂[8],作为首次发现的EZH2酶活性抑制剂,它能够降低EZH2的蛋白表达水平,阻断EZH2介导的甲基化作用[9]。EZH2常作为恶性肿瘤侵袭和转移抑制研究中的重要靶点,其是多梳抑制复合物2(polycomb repressive complex 2,PRC2)最关键的核心成员[10],为靶向组蛋白H3在H3K27甲基化中的组蛋白甲基转移酶[10],在前列腺癌、乳腺癌和多形性胶质母细胞瘤(glioblastoma multiforme,GBM)等肿瘤中呈高表达[11],参与调节控制细胞周期、DNA修复和细胞分化的关键基因转录,在组织特异性干细胞维持和肿瘤发展中发挥关键作用[10],能够减弱肿瘤抑制基因的表达,导致恶性信号通路被激活,包括磷脂酰肌醇3-激酶(phosphoinositide3-kinase,PI3K)/蛋白激酶B(protein kinase B,AKT)和Wnt/β-catenin通路[11-12]。DZNep对癌细胞的作用相对特定于EZH2[13],可能通过抑制EZH2发挥抗肿瘤作用[13-15],因此从乳腺癌外泌体形成的角度分析其影响肿瘤演进的潜在机制具有重要意义。本研究首先观察DZNep对乳腺癌源性外泌体的影响,并深入探讨DZNep改变乳腺癌微环境的作用和机制。
1 材料和方法
1.1 实验材料及试剂
乳腺癌MDA-MB-231细胞、EZH2小分子抑制剂DZNep NSC617989购自美国Selleck Chemicals公司,anti-CD9抗体ab92726、anti-CD63抗体ab216136和anti-TSG101抗体ab125011购自英国Abcam公司,辣根过氧化物酶标记山羊抗兔免疫球蛋白(immunoglobulin G,IgG)(H+L)A0208、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)A0216、Western及IP细胞裂解液P0013、苯甲基磺酰氟(phenylmethylsulfonyl fluoride,PMSF)ST505购自上海碧云天生物技术有限公司,Pierce二辛可宁酸(bicinchoninic acid,BCA)protein assay kit 23225、PageRulerTM prestained protein ladder 26617购自美国Thermo Fisher Scientific公司,LumiBest卓越型电化学发光(electrochemical luminescence,ECL)液SB-WB011购自上海圣尔生物科技有限公司,多功能酶标仪Spark10M购自瑞士Tecan公司,稳压稳流电泳仪EPS-600、微型垂直电泳槽VE-180和转移电泳槽VE-186购自上海天能科技有限公司,超净台SW-CI-1F购自苏州净化科技有限公司,普通碳支持膜BZ11022A购自北京中镜科仪技术有限公司,低速离心机Cence购自湘潭湘仪仪器有限公司,超速离心机转子型号为P50AT2(Himac CP80WX,日本Hitachi公司),透射电子显微镜G2spititi(Tecnai Spirit 120 kV)购自美国FEI公司。
1.2 实验方法
1.2.1 数据库在线分析
通过癌症基因组图谱(The Cancer Genome Atlas,TCGA)数据库和在线分析软件GEPIA2分析EZH2在乳腺癌中的表达,使用肿瘤免疫估计资源(Tumor Immunity Estimation Resources,TIMER)分析EZH2与肿瘤微环境细胞因子及上皮-间充质转化(epithelial-mesenchymal transition,EMT)相关蛋白表达的关系。
1.2.2 纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)检测
采用差速超速离心法提取外泌体,采用NTA技术追踪和分析外泌体的布朗运动:用0.025%的TEA和0.004 g/mL的NaOH混合溶液作为溶剂,稀释样本浓度为1/200,监测样本颗粒运动情况,每个样品监测60 s,重复3次。结合Stokes-Einstein方程式计算出外泌体颗粒的流体力学直径和浓度[16]。
1.2.3 透射电镜检测
将15 μL的外泌体样本于铜网上静置1 min,用滤纸将外泌体样本吸干,取15 μL 2%的醋酸双氧铀染色液室温染色1 min,然后于灯下烤10 min,用透射电镜观察拍摄。
1.2.4 蛋白质印迹法(Western blot)检测
应用BCA工作液进行蛋白浓度测定,用多功能酶标仪测定A562的吸光度(D),根据标准品测值绘制标准曲线,通过标准曲线计算出待测样品的蛋白浓度。
试验分组为外泌体上清组和DZNep处理组,将等量蛋白(40 μg/10 μL)上样进行聚丙烯酰胺凝胶电泳(8%),湿转电泳转移蛋白至PVDF膜(0.45 μm孔径)上,5%脱脂奶粉封闭1 h,用含有3%的牛血清白蛋白(bovine serum albumin,BSA)和0.02%的叠氮化钠的1×含有吐温-20三乙醇胺缓冲盐溶液(tris-buffered saline Tween,TBST)稀释一抗(PCL2 1∶200,GADPH 1∶1 000),4 ℃温育过夜,二抗(山羊抗兔IgG、山羊抗小鼠IgG 1∶2 000)室温温育1 h,ECL试剂显色1 min,曝光并进行灰度测量[17]。
2 结果
2.1 DZNep改变乳腺癌源性外泌体颗粒的浓度和直径
外泌体标志蛋白CD9、CD63和TSG101的相对分子质量分别为25×103、26×103和44×103,NC组和DZNep组细胞的培养基上清颗粒均可检出上述蛋白表达,提示该培养基上清颗粒为外泌体。应用纳米颗粒追踪分析外泌体粒径、分布表征,结果显示,外泌体颗粒基本处于30~200 nm的分布范围,NC组检测浓度为2.7×107个/ mL,粒径峰值为180.5 nm,实测平均粒径大小为185.8 nm;DZNep组外泌体颗粒检测浓度为3.3×107个/mL,粒径峰值为161.4 nm,实测平均粒径大小为162.6 nm,提示DZNep干预后外泌体浓度降低、体积变小。透射电镜观察显示,外泌体是具有独特性质的小囊泡,直径50~100 nm,双脂质层的密度为1.12~1.19 g/mL。观察可见,与对照组相比,DZNep组外泌体数量减少、体积变小(图1)。

图1 DZNep处理前后乳腺癌源性外泌体的变化Fig.1 Changes of Exosomes in Breast Cancer before and after DZNep Treatment
2.2 基于TCGA数据库分析EZH2的表达及与乳腺癌肿瘤微环境和EMT的关系
TCGA数据库检测分析发现,EZH2在乳腺癌中表达可见,EZH2在癌组织中的表达高于癌旁组织(图2A)。韦恩图显示肿瘤微环境成分,当EZH2上调表达时,UP显示是免疫细胞(蓝色)在Luminal B型乳腺癌(BRCA-Luminal B)、GBM等肿瘤中含量增多,基质细胞(橙色)在结肠癌(colon adenocarcinoma,COAD)、弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)等肿瘤中增多,其中交集表示免疫细胞和基质细胞均增多的肿瘤类型,包括Luminal A型乳腺癌(BRCA-Luminal A);同样,DOWN显示各肿瘤类型免疫细胞和基质细胞减少的分组。该结果提示EZH2高表达与免疫细胞上调呈正相关,与BRCA-Luminal A免疫细胞和基质细胞上调均呈正相关,EZH2高表达会改变乳腺癌组织的肿瘤微环境(图2B)。与EMT相关的分子表达关系显示,EZH2高表达与乳腺癌E-cadherin、N-cadherin、vimentin表达呈正相关,与BRCA-Luminal B型E-cadherin表达呈正相关、N-cadherin表达呈负相关,与BRCA-Luminal A型N-cadherin表达、vimentin表达呈正相关(P<0.05,图2C)。
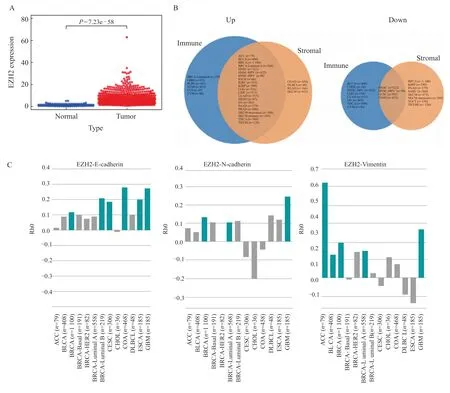
图2 EZH2在多种肿瘤中的表达分析与比较Fig.2 Analysis and comparison of EZH2 expression in various tumors
2.3 DZNep下调EZH2,调节EMT相关蛋白的表达
DZNep是EZH2抑制剂,本研究显示,5 μmol DZNep处理24 h能够明显抑制EZH2表达,抑制转录因子ZEB1/ZEB2和N-cadherin的表达。DZNep处理乳腺癌MDA-MB-231细胞后,EMT相关蛋白E-cadherin表达增加,vimentin表达降低,提示DZNep能够调节EMT相关蛋白的表达(图3)。

图3 EZH2与EMT相关蛋白的表达情况Fig.3 Expression of EZH2 and EMT-related proteins
2.4 DZNep改变细胞间连接蛋白的表达
细胞间连接是肿瘤微环境的重要组成部分之一,细胞间连接蛋白表达异常与肿瘤EMT过程相关。本研究显示,DZNep干预后,闭合蛋白(occludin)及闭锁小带蛋白-1(zonula occludens-1,ZO-1)、层粘连蛋白(laminin)、水通道蛋白4(aquaporin 4,AQP4)、连接子蛋白43(connexin 43)的表达均明显降低;封闭蛋白5(claudin 5,CLDN5)和Ⅵ型胶原蛋白(collagen Ⅵ)表达明显增加(图4)。
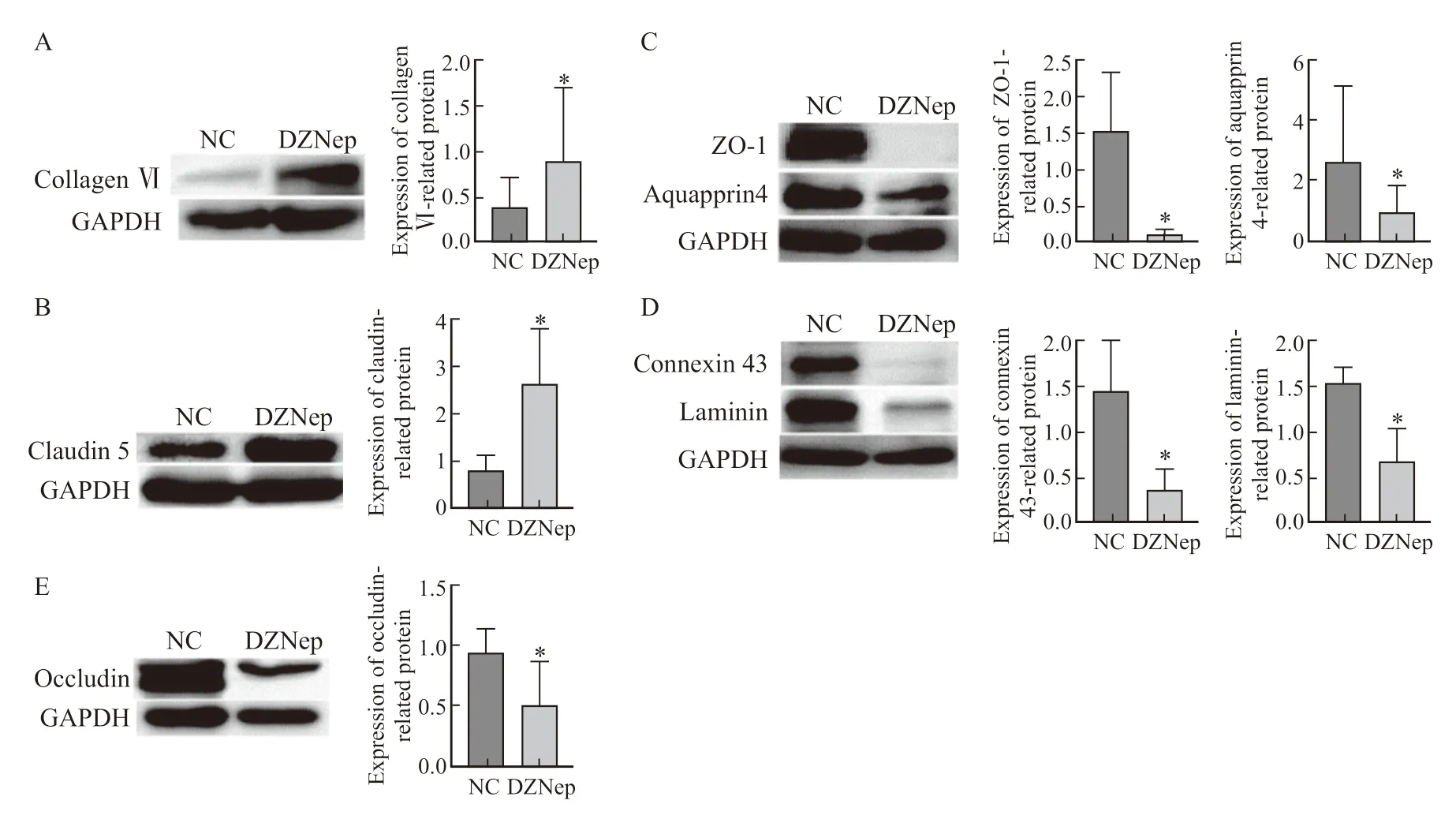
图4 DZNep作用下,细胞间连接蛋白的表达情况Fig.4 Expression of intercellular junction proteins in response to DZNep
3 讨论
乳腺癌是严重危害女性健康的恶性肿瘤,据统计,2018年全球乳腺癌新发病例约210万例,死亡约63万例,其危害在女性恶性肿瘤中居首位[1]。外科手术、放疗、化疗及靶向治疗等是乳腺癌临床治疗的主要方式,采用乳腺X射线、乳腺磁共振成像、乳腺超声及生物标志物等筛查方式有助于乳腺癌的早期诊断[18]。但迄今为止,乳腺癌患者的预后并不乐观,仍需探索新的治疗策略。
肿瘤微环境与肿瘤的发生、发展及转移密切相关,肿瘤细胞来源的外泌体内含有与细胞来源相关的核酸和蛋白质,可以传递mRNA、miRNA、lncRNA、circRNA及蛋白质等进入受体细胞,参与细胞间通讯、肿瘤微环境的调控,这些研究将为肿瘤的诊断和治疗提供新的思路[19]。肿瘤外泌体是肿瘤细胞与其微环境信息交流最重要的工具。与正常细胞相比,肿瘤细胞能够分泌出更多的外泌体,招募和驯化其周围的基质细胞,引起相应基质细胞表型转化,随后产生大量的生长因子、细胞趋化因子和基质降解酶,引起肿瘤微环境发生基质重组、免疫抑制及肿瘤血管生成等变化[20]。本研究首先提取乳腺癌MDA-MB-231细胞的外泌体,结果显示,经DZNep处理后外泌体粒径明显减小且数量下降,推测DZNep能够减少乳腺癌源性外泌体生成,调控肿瘤微环境。
DZNep是3-去氮腺苷的环戊醇类似物,可抑制甲硫氨酸循环的成员S-腺苷高半胱氨酸水解酶的活性,逆转S-腺苷高半胱氨酸水解为腺苷和高半胱氨酸[6],引起细胞内S-腺苷高半胱氨酸的积聚,抑制S-腺苷蛋氨酸依赖的赖氨酸甲基转移酶的活化[7]。在肺癌细胞的死亡过程中,DZNep靶向调节多个HMTases从而抑制肺癌细胞的生长[21],通过诱导细胞衰老和凋亡抑制结肠癌HCT116细胞的生长和存活[22]。
作为EZH2的抑制剂,DZNep通过降低EZH2蛋白的表达水平,激活PRC2靶基因,靶向调控H3K27me3组蛋白甲基转移酶的降解,并特异性地诱导肿瘤细胞凋亡,从而抑制食管鳞癌、结直肠癌和肺癌的增殖[7],并通过抑制EZH2的表达从而使丝氨酸高度磷酸化,减少结直肠癌细胞的迁移[22]。临床研究显示,评价EZH2靶向药物(包括DZNep)的临床试验应考虑根据TP53基因组的状态对肿瘤患者进行分层[23]。EZH2基因定位于7号染色体长臂3区5带,含有20个表达序列,具有组蛋白赖氨酸甲基转移酶活性[24]。EZH2蛋白功能区主要集中在N端和C端,包括H1、H2、富半胱氨酸结构域(cysteine-rich domain,CRD)及SET结构域复合体,CRD和SET结构域在酶的催化反应中有重要作用[25]。在EZH2的启动子区发现了与缺氧诱导因子HIF-1α相互作用的保守HRE序列,HIF-1α与该HRE区域结合以激活EZH2转录,促进乳腺癌生长[26]。最近有研究[27]显示,EZH2可促进肿瘤来源外泌体miRNA表达量的升高,诱导EMT促进细胞侵袭和迁移。本研究应用数据库资料分析可知,EZH2在乳腺癌癌组织中的表达高于癌旁组织,与乳腺癌免疫细胞和基质细胞上调相关,与乳腺癌EMT现象相关。
EMT与肿瘤的起始、肿瘤干性、肿瘤转移及耐药等多种恶性行为密切相关[28]。甲状腺癌、胰腺癌等来源的CSC可以通过分泌外泌体作用于受体细胞,使受体细胞获得EMT能力[6]。肿瘤微环境的改变是肿瘤转移重要的背景因素,这个过程通常伴随着EMT现象的发生[29]。EMT期间,上皮细胞间连接蛋白下调,从而分解黏附连接、桥粒和紧密连接,促使顶端-基底极性丧失,细胞间黏附被破坏,使得肿瘤细胞的侵袭能力增强,为肿瘤转移创造条件[30]。发生EMT时,细胞通常会高表达参与细胞外基质和基底膜降解的相关蛋白,破坏原有组织学屏障,便于肿瘤细胞从原发灶脱落导致侵袭和转移[30]。EZH2能够通过调节E-cadherin改变胶质瘤分化和侵袭等生物学行为[31];DZNep可通过激活抑癌miRNA发挥多种抗癌作用,也可以抑制EZH2与miR-1246、miR-302a和miR-4448的启动子区域结合,进一步抑制双特异性酪氨酸(Y)磷酸化调控激酶1A[dual-specificity tyrosine-(Y)-phosphorylation regulated kinase 1A,DYRKLA]、细胞周期蛋白依赖性激酶2(cyclin-dependent kinase 2,CDK2)、B细胞特异性莫洛氏鼠白血病病毒插入位点1(B-cellspecific Moloney murine leukemia virus insertion site 1,BMI-1)和微丝附着梁蛋白表达,诱导细胞凋亡、细胞周期停滞和抑制细胞迁移[32]。本研究显示,DZNep能够通过抑制EZH2来抑制乳腺癌MDA-MB-231细胞的EMT现象。
抑制EZH2可改善肾小管细胞黏附和连接损伤[33]。乳腺瘤来源的外泌体含有的miR-105可以下调内皮细胞紧密连接蛋白ZO-1的表达,直接影响内皮细胞紧密连接,增加肿瘤血管的通透性[34]。Occludin和ZO-1是紧密连接的主要组成成分,它们与肿瘤细胞的分化程度、浸润深度、是否伴有淋巴结转移及进展情况明显相关[35]。Laminin是基底膜所特有的非胶原糖蛋白,能够在细胞表面形成网络结构并将细胞固定在基底膜上。AQP4在维持水和离子平衡中起关键作用,在乳腺癌组织中的表达显著高于癌旁组织[36]。Connexin 43是中枢神经系统中表达最丰富的间隙连接蛋白,与肿瘤的恶性生物学行为及恶性程度呈正相关[37]。CLDN5是Claudin家族的重要成员,在细胞间紧密连接的构成和维持中发挥着重要作用,能够诱导肿瘤细胞的EMT现象,其表达丢失是细胞与细胞之间黏附能力降低的重要原因,低表达能促进乳腺癌转移[37]。本研究中DZNep干预后occludin、ZO-1、laminin、AQP4、connexin 43表达降低,CLDN5表达增加,提示DZNep能够阻止细胞间黏附的破坏或降解,并改变其结构。Collagen Ⅵ是细胞外基质中主要的成分之一,癌细胞团分泌基质金属蛋白酶(matrix metalloproteinase,MMP)降解Collagen Ⅵ变成胶原肽,随后在间质中重新沉积形成线性胶原,增加癌巢周围间质张力,进一步激活整联蛋白,驱动黏着斑形成并增加黏着斑激酶活性,促进癌细胞增生、侵袭、转移及肿瘤血管生成[37]。当癌细胞生长抑制时,MMP降解减少导致collagenⅥ累积增多[37]。本研究中DZNep干预后collagenⅥ表达增加。上述结果提示DZNep能够改变乳腺癌细胞微环境,抑制乳腺癌细胞侵袭和迁移。
综上所述,DZNep通过抑制EZH2减少乳腺癌MDA-MB-231细胞中的外泌体生成,进一步改变肿瘤细胞微环境,从而影响EMT现象,具有成为乳腺癌靶点治疗新药物的潜能。
利益冲突声明:所有作者均声明不存在利益冲突。
——外泌体与老年慢性疾病相关性的研究进展

