辅助化疗对胃神经内分泌癌患者预后的意义
张日虹,郭 宇,梁 贇,陈洛海,陈 洁,王 玮
1.中山大学肿瘤防治中心胃外科,华南肿瘤学国家重点实验室,肿瘤医学协同创新中心,广东 广州 510060;
2.中山大学附属第一医院消化内科,广东 广州 510080;
3.复旦大学附属肿瘤医院神经内分泌肿瘤中心,头颈及神经内分泌肿瘤内科,复旦大学上海医学院肿瘤学系,上海 200032
胃神经内分泌肿瘤(neuroendocrine neoplasm,NEN)是胃恶性肿瘤中一种较为罕见的类别,根据2019年世界卫生组织(World Health Organization,WHO)消化系统NEN的分类标准,分为分化好的神经内分泌瘤(neuroendocrine tumor,NET)和分化差的神经内分泌癌(neuroendocrine carcinoma,NEC)。其中,NEC包括大细胞NEC和小细胞NEC;此外,还存在一种特殊的混合性神经内分泌-非神经内分泌肿瘤(mixed neuroendocrine-nonneuroendocrine neoplasm,MiNEN)[1]。相比于胃腺癌,胃NEC(gastric NEC,GNEC)具有恶性程度更高、复发和远处转移概率更高、预后更差的特性[2]。
目前GNEC的外科治疗原则类似于胃腺癌(根治性切除+D2淋巴结清扫),大多数临床医师考虑到GNEC患者根治术后复发的概率较大,推荐术后化疗,一线化疗方案参考小细胞肺癌,为依托泊苷+顺铂(etoposide plus cisplatin,EP)或伊立替康+顺铂(irinotecan plus cisplatin,IP)[3],但缺少关于GNEC预后的研究。个别小样本研究[4-5]提示化疗能够改善GNEC患者的预后,而另外个别研究[6-7]却提示化疗并不能改善该部分患者的预后。因此,GNEC患者治疗模式仍然存在较多争议。本研究旨在探讨辅助化疗能否使GNEC患者获益,以期为临床决策提供参 考。
1 资料和方法
1.1 一般资料
本研究采用病例对照研究方法,选取中山大学肿瘤防治中心、中山大学附属第一医院和复旦大学附属肿瘤医院2008年7月—2019年6月GNEC患者的临床病理学数据,共计184例,随访截至2022年5月31日。
1.2 纳入和排除标准
纳入标准:①经病理学检查确诊为GNEC;②有完整的临床病理学信息,包括手术情况、T分期、N分期、M分期及化疗信息等;③随访信息完整。排除标准:①胃NET;②其他类型胃恶性肿瘤。
1.3 观察指标和治疗情况
观察指标包括年龄、性别、肿瘤部位、Ki-67增殖指数、T分期、N分期、M分期、是否手术、是否化疗及化疗方案等。化疗方案分为3类:①EP、IP;②奥沙利铂+卡培他滨(oxaliplatin plus capecitabine,XELOX)、奥沙利铂+替吉奥(oxaliplatin plus tegafur,SOX)、奥沙利铂+5-氟尿嘧啶(oxaliplatin plus 5-fluorouracil,FOLFOX);③伊立替康+5-氟尿嘧啶(irinotecan plus 5-fluorouracil,FOLFIRI)、替莫唑胺+卡培他滨(temozolomide plus capecitabine,CAPTEM)、紫杉醇等。综合治疗模式分为手术+化疗组、单纯手术组、单纯化疗组和无治疗组。
1.4 统计学处理
将年龄、性别、肿瘤部位、T分期、N分期、M分期、是否手术、是否化疗及化疗方案等多个可能影响GNEC患者预后的临床病理学参数纳入研究。生存曲线采用Kaplan-Meier法绘制,单因素分析采用单因素COX回归分析法,将单因素分析中差异有统计学意义(P<0.05)的变量纳入多因素分析。多因素分析采用COX比例风险回归和风险比(hazard ratio,HR),并计算95% CI,检验水准为α=0.05。总生存期(overall survival,OS)指从疾病诊断至死亡或随访截止时间。所有统计分析均使用SPSS 25.0软件。P<0.05为差异有统计学意义。
2 结果
2.1 184例GNEC患者的临床病理学资料
全组患者中,男性148例(80.4%),女性36例(19.6%)。54例(29.3%)患者<60岁,130例(70.7%)患者≥60岁。在肿瘤部位上,胃上部占比较大,为85例(46.2%),胃中部和胃下部分别为66例(35.9%)和33例(17.9%)。NEC 为141 例(76.6%),MiNEN 为43 例(23.4%)。43例(23.4%)患者的Ki-67增殖指数为20%~55%,127例(69.0%)患者的Ki-67增殖指数>55%。肿瘤TNM分期:Ⅰ期11例,Ⅱ期60例,Ⅲ期43例,Ⅳ期70例。手术组和非手术组患者分别为137例(74.5%)和47例(25.5%)。化疗组和非化疗组患者分别为143例(77.7%)和41例(22.3%)。详见表1。
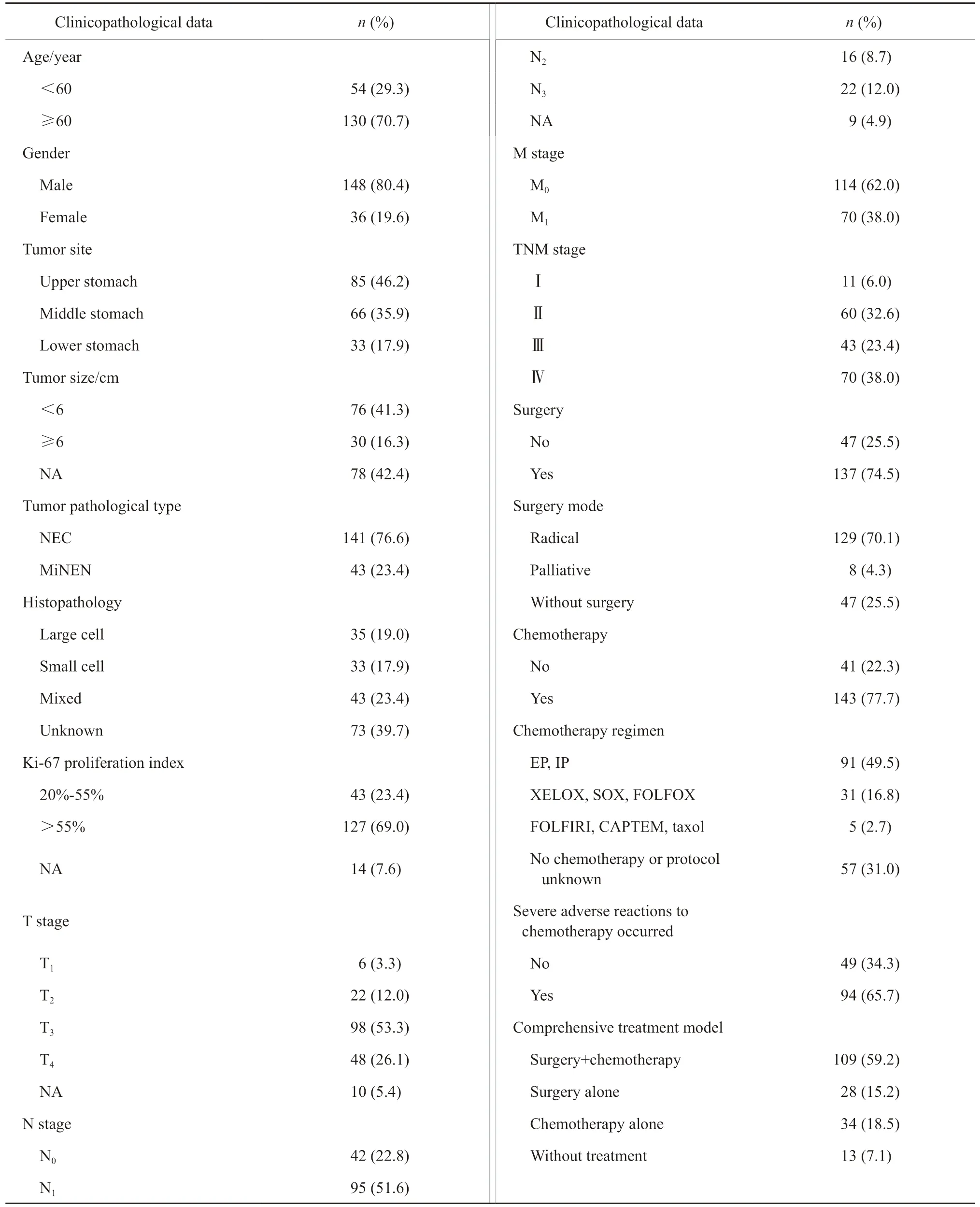
表1 184例胃神经内分泌癌患者的临床病理学资料Tab.1 Clinicopathological data of 184 patients with gastric neuroendocrine carcinoma
2.2 与GNEC患者预后相关的单因素分析及多因素COX回归分析结果
单因素分析显示,手术(P<0.001)、化疗(P<0.001)、综合治疗模式(P<0.001)、N分期(P=0.029)、M分期(P<0.001)及TNM综合分期(P<0.001)是影响GNEC患者预后的变量,而Ki-67增殖指数、肿瘤病理学类型及化疗方案等与GNEC患者的预后无关(P>0.05)。多因素COX回归分析结果显示,手术(P<0.001)、化疗(P<0.001)及M分期(P<0.001)是GNEC患者生存的独立预后因素(表2,图1)。
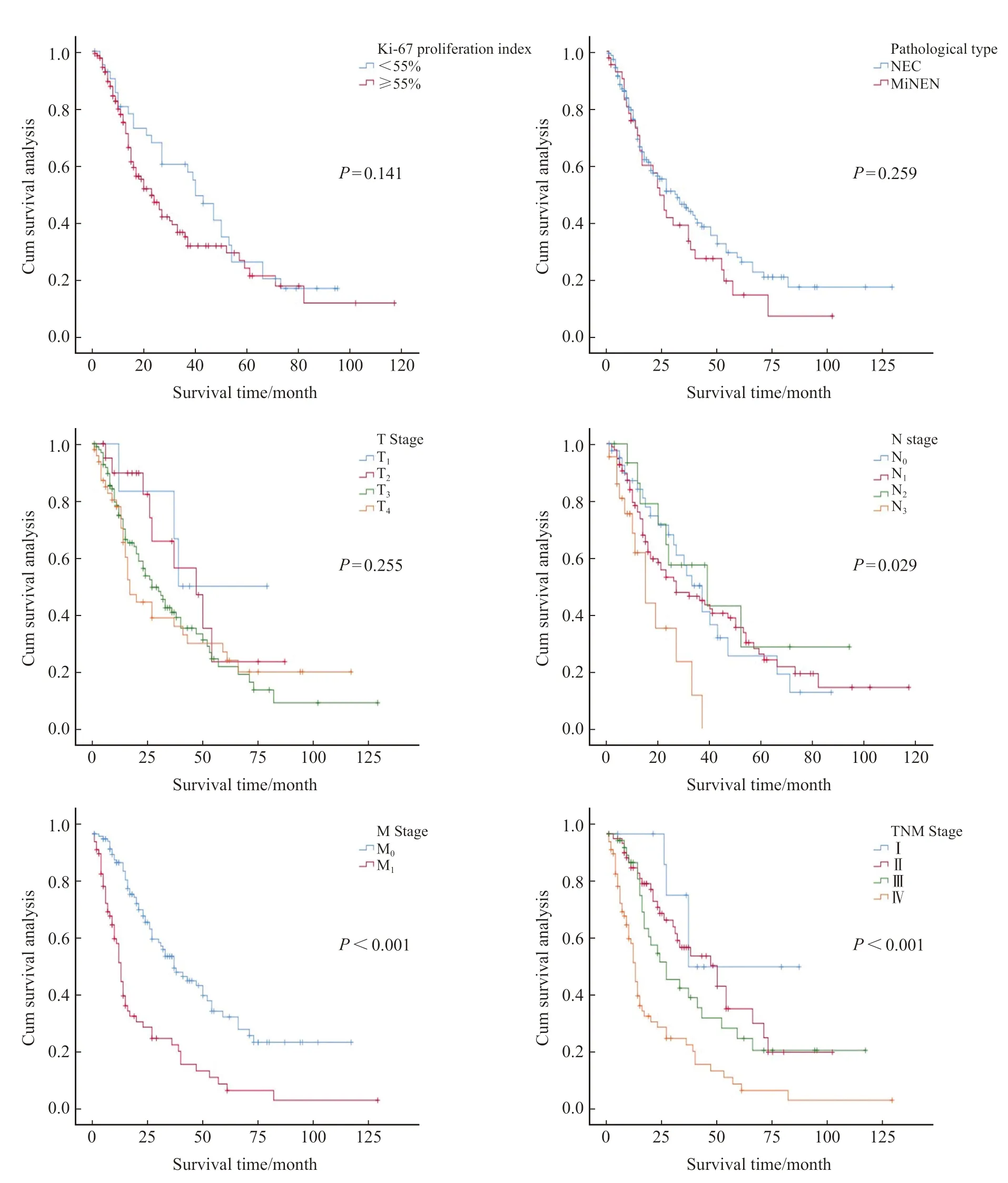
图1 部分预后变量的生存曲线Fig.1 Survival curves for several prognostic variables

表2 单因素和多因素分析结果Tab.2 Results of univariate and multivariate analysis
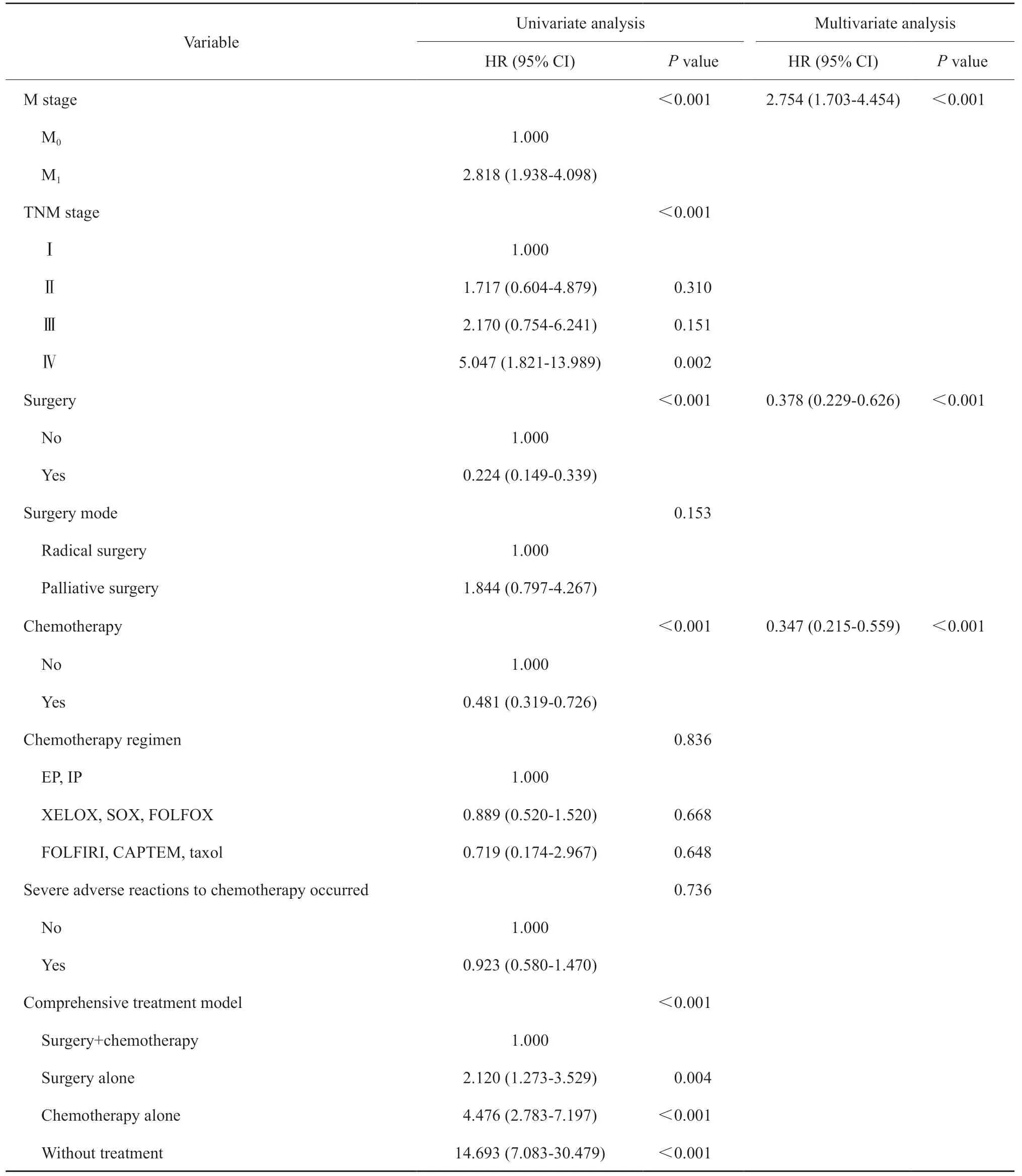
续表 单因素和多因素分析结果
2.3 手术、化疗对GNEC患者预后的影响
目前GNEC的外科治疗原则类似于胃腺癌(根治性切除+D2淋巴结清扫),本组数据多因素分析结果显示,手术(P<0.001)为GNEC患者的独立预后因素,根治性手术组、姑息性手术组和无手术组患者的3年累积生存率分别为52.7%、18.8%和8.3%。
此外,单因素分析结果显示,化疗对GNEC患者预后有显著影响(P<0.001),同时也是独立预后因素(P<0.001)。在根治性手术组患者中,辅助化疗可以使GNEC患者预后获益,辅助化疗和非辅助化疗的3年累积生存率分别为58.8%和33.3%(P=0.008),中位生存时间分别为47和17个月,辅助治疗的死亡风险降低(HR=0.467,95% CI:0.275~0.790)。此外,本研究还在不同的TNM分期亚组中分析了化疗对患者预后的影响。结果显示,在根治性手术组中,辅助化疗能够使TNM Ⅱ(P=0.018)和Ⅲ期(P=0.023)患者预后获益,而在TNM Ⅰ期中差异无统计学意义(P=0.535),同时,化疗也能使晚期患者预后获益(P<0.001,表3,图2)。
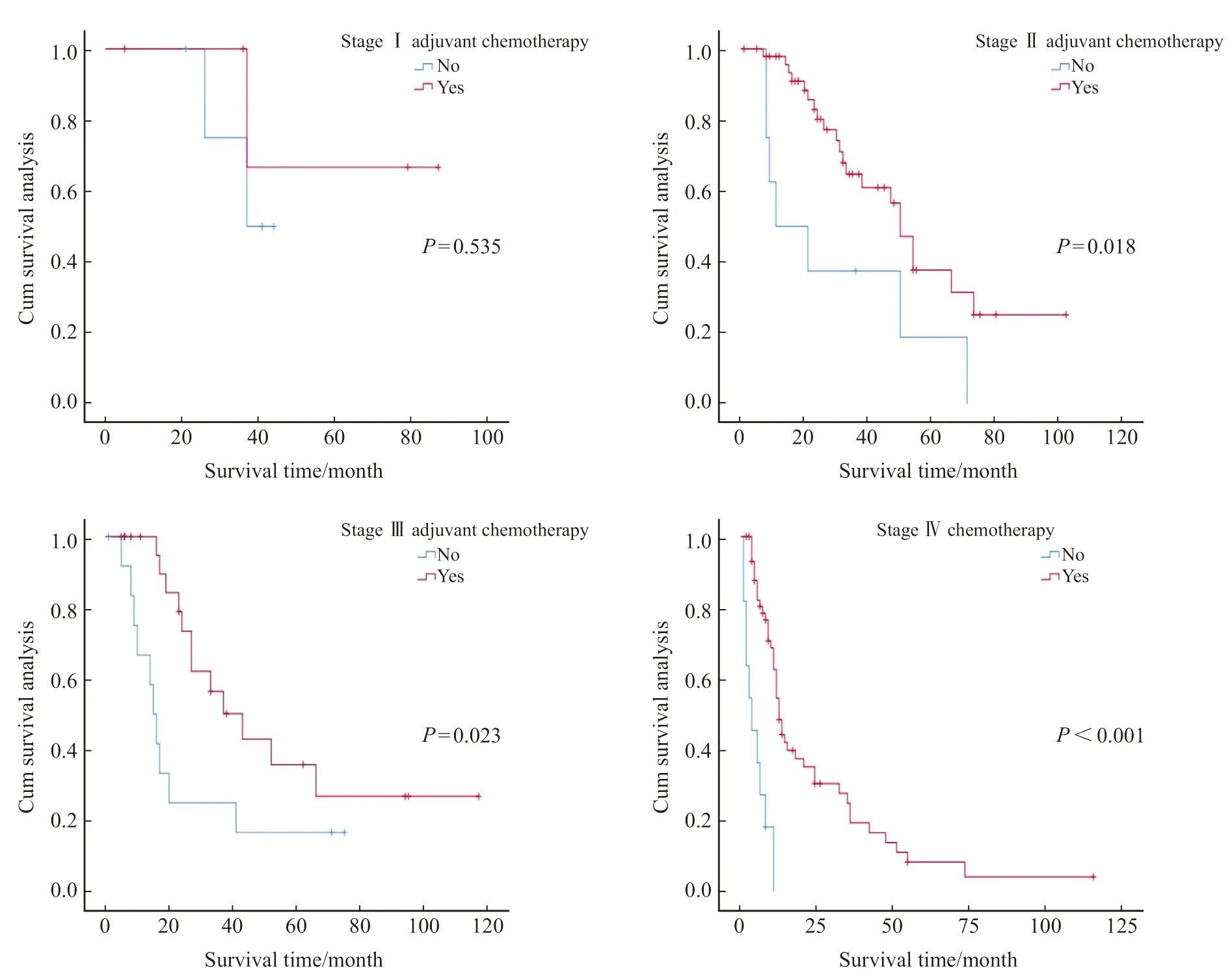
图2 化疗对不同TNM分期亚组的GNEC患者预后的影响Fig.2 Effect of chemotherapy on the prognosis of patients with GNEC in different TNM staging subgroups
本研究结果显示,化疗方案并未对患者预后产生显著影响(P=0.836),即推荐用于神经内分泌癌的一线化疗方案(EP、IP)与推荐用于胃腺癌的方案(XELOX、SOX、FOLFOX)及推荐用于神经内分泌癌的二线化疗方案(FOLFIRI、CAPTEM、紫杉醇)在改善患者预后方面无显著差异。分析综合治疗模式对患者预后影响的结果显示,手术+化疗组患者的预后优于其他治疗组(单纯手术组、单纯化疗组、无治疗组),手术+化疗组、单纯手术组、单纯化疗组及无治疗组的中位生存时间分别为43、16、13及4个月,差异有统计学意义(P<0.001,表3,图3)。
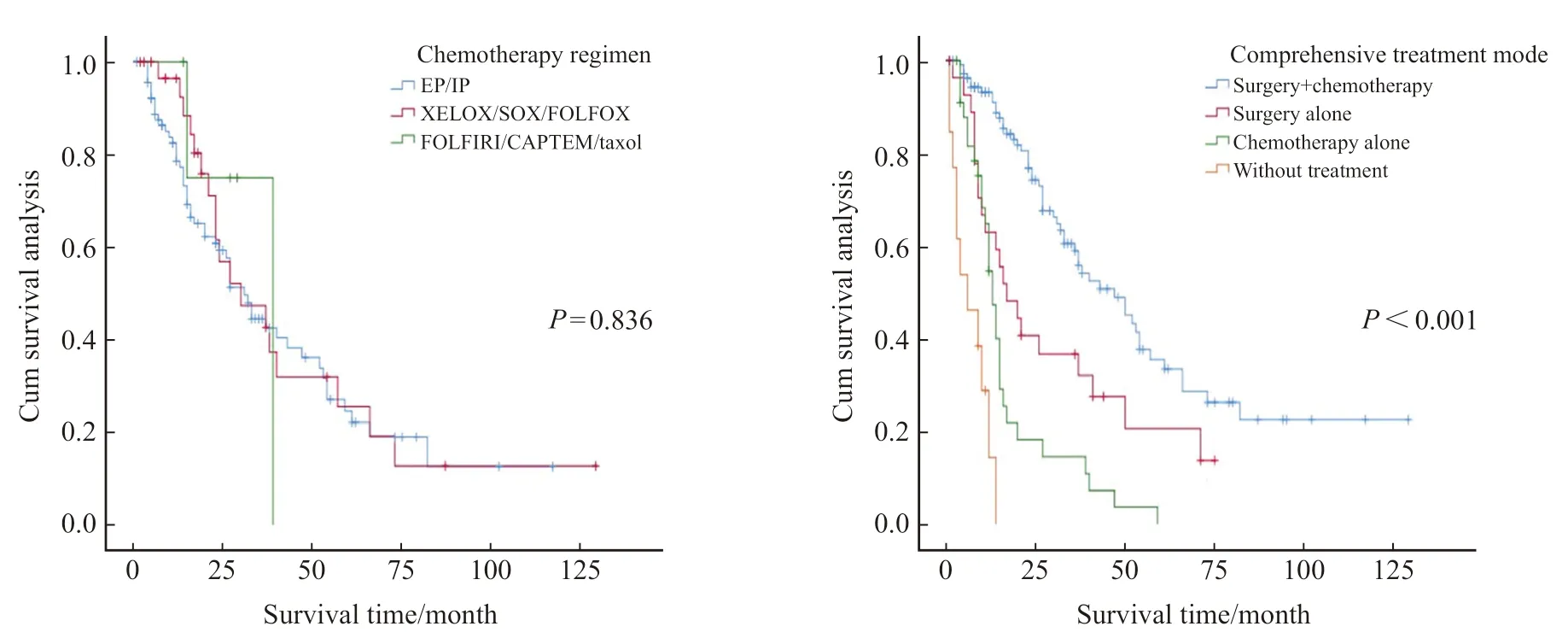
图3 化疗方案及综合治疗模式对GNEC患者预后的影响Fig.3 Effects of chemotherapy regimen and comprehensive treatment mode on the prognosis of patients with GNEC
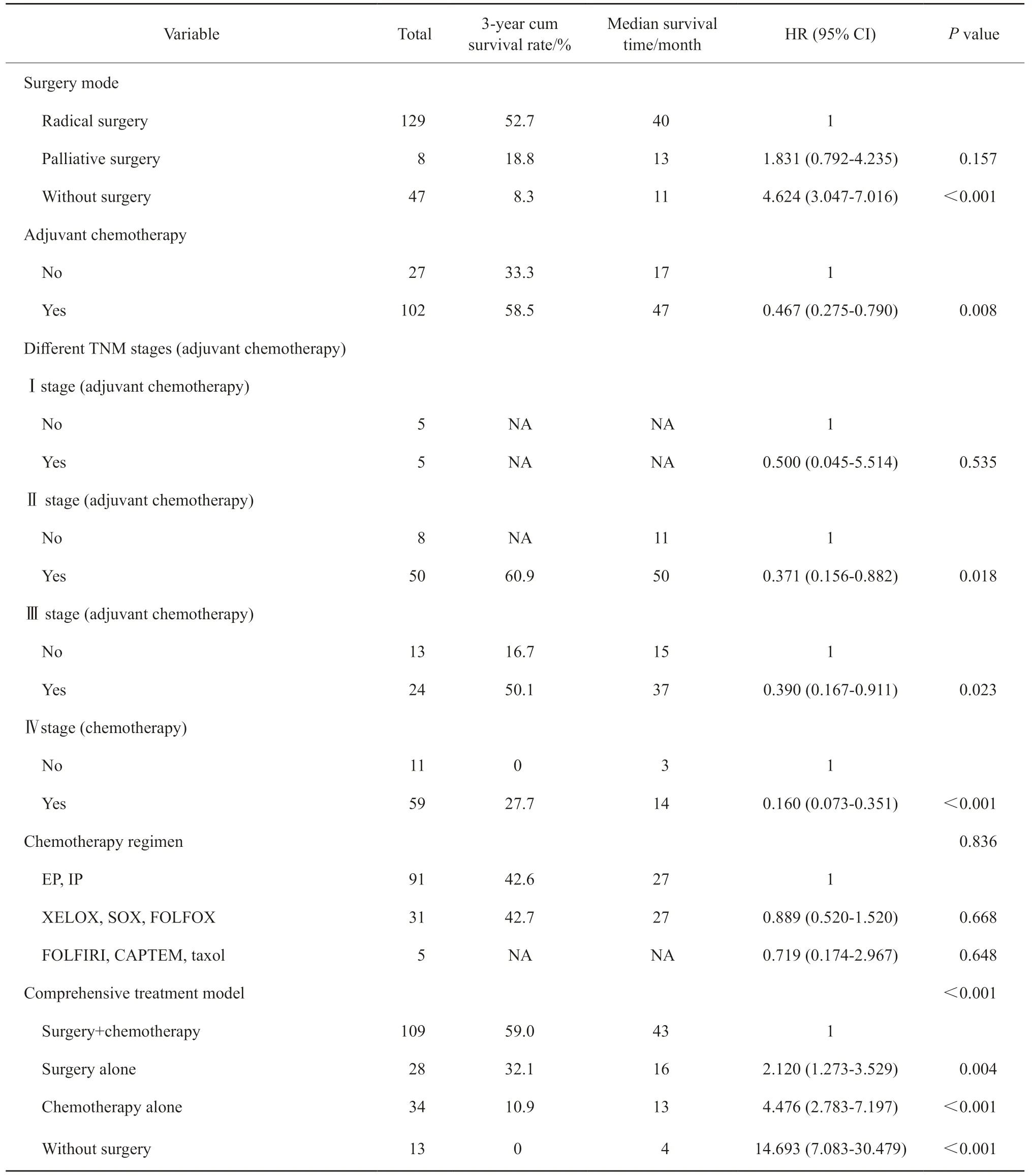
表3 手术和化疗对GENC患者预后的影响Tab.3 Effects of surgery and chemotherapy on the prognosis of patients with GENC
3 讨论
相比胃腺癌,GNEC预后更差,也更容易发生远处转移[2]。本研究结果显示,手术(P<0.001)、化疗(P<0.001)、综合治疗模式(P<0.001)、N分期(P=0.029)、M分期(P<0.001)及TNM综合分期(P<0.001)都是影响GNEC患者预后的变量。相比于非手术组,手术组的死亡风险降低(HR=0.224,95% CI:0.149~0.339);相比于非化疗组,化疗组的死亡风险也降低(HR=0.481,95% CI:0.319~0.726)。在综合治疗模式方面,手术+化疗组的预后优于其他治疗组(单纯手术、单纯化疗及无治疗)(P<0.001),手术+化疗组患者3年累积生存率和中位生存时间分别为59.0%和43个月,而无治疗组患者3年累积生存率和中位生存时间分别为0.0%和4个月,提示手术联合化疗仍然是GNEC患者的首选治疗模式。此外,Ki-67增殖指数、肿瘤病理学类型及化疗方案等在本研究中与GNEC患者的预后无关(P>0.05)。目前,GNEC与胃MiNEN两者的预后是否有差别尚存在争议,Kim等[8]比较各类别胃NEN的预后发现,胃MiNEN的预后比GNEC好(P<0.05),也有研究[9-10]提示GNEC与胃MiNEN的预后无显著差异。在本研究中,GNEC与胃MiNEN的预后无明显差异(P=0.259)。
根据《胃肠胰神经内分泌肿瘤诊治专家共识(2020·广州)》及《中国抗癌协会神经内分泌肿瘤诊治指南(2022年版)》[11-12],对于分化差的GNEC,鉴于其较高的肿瘤恶性程度,应严格参照相应部位的胰腺癌行根治性手术和彻底的区域淋巴结清扫;对于伴有远处转移的胃肠NEN,目前尚无大型、前瞻性、随机对照研究比较转移性胃肠NEN系统治疗与姑息手术的生存获益;在化疗方面,推荐一线化疗方案为EP、EC和IP,二线化疗没有标准方案,推荐FOLFOX、FOLFIRI和CAPTEM等。这些方案的选择是基于治疗小细胞肺癌的化疗方案,但是化疗能否改善GNEC患者的预后以及不同化疗方案的增益是否不同,仍然存在争议。本研究发现,在根治性手术组患者中,辅助化疗的3年累积生存率和中位生存时间分别为58.8%和47个月,而非辅助化疗的3年累积生存率和中位生存时间分别为33.3%和17个月,组间比较差异有统计学意义(P=0.008),提示辅助化疗能使GNEC患者获益。同时,在针对根治术组中的不同TNM分期进行亚组分析时发现,辅助化疗在TNM Ⅱ(P=0.018)和Ⅲ期(P=0.023)中差异均有统计学意义,而在TNM Ⅰ期中差异无统计学意义(P=0.535),为GNEC术后辅助化疗提供了一定的参考依据。在化疗方案的选择方面,本次研究中的一线化疗方案(EP、IP)与胃腺癌方案(XELOX、SOX、FOLFOX)、二线药物(FOLFIRI、CAPTEM、紫杉醇)在改善患者预后方面差异无统计学意义(P=0.836)。
综上所述,手术、化疗及远处转移是影响GNEC的独立预后因素。辅助化疗能改善Ⅱ和Ⅲ期GNEC患者的预后,一线化疗方案(EP、IP)与胃腺癌方案(XELOX、SOX、FOLFOX)在改善预后方面差异无统计学意义。此外,手术联合化疗仍是GNEC患者治疗的首选治疗模式。
利益冲突声明:所有作者均声明不存在利益冲突。

