人类疱疹病毒7 型肺炎一例
唐鸿 翟慧媛 方小谦
人类疱疹病毒7 型(HHV-7)属于玫瑰疹病毒属β 疱疹病毒亚科,是一种有包膜的双链DNA病毒,常潜伏于单核细胞及唾液腺细胞中[1]。婴幼儿及免疫功能受损人群对HHV-7 易感,HHV-7可引起幼儿急疹、玫瑰糠疹和中枢神经系统感染等[2]。目前国内关于HHV-7 肺炎的报道较为罕见。为此,本文报告1 例用支气管肺泡灌洗液(BALF)行宏基因组二代测序(mNGS)确诊的成人HHV-7肺炎病例。
病例资料
一、病史及体格检查
患者女,46 岁。因咳嗽、咳痰2 周于2021 年12 月5 日收入院。患者2 周前受凉后出现阵发性咳嗽,每次2~3 声,咳少量黄黏痰,晨起及睡前明显,活动后稍感气喘,3 d 前凌晨患者自觉发热,未测体温,无鼻塞、流涕,无咽痛、咽痒,无盗汗乏力,自服连花清瘟胶囊、强力枇杷露1 周后症状无改善。2021 年12 月4 日至本院急诊查胸部X 线片示右肺感染?静脉输注莫西沙星、地塞米松、喜炎平1 d。2021 年12 月5 日本科门诊查胸部CT 示两侧肺部感染可能,其他待排除(图1A~C)。血常规示白细胞11.3×109/L、中性粒细胞0.858、淋巴细胞0.111,CRP 164.96 mg/L。新型冠状病毒核酸检测阴性。既往HBsAg、抗-HBe、抗HBc 阳性(小三阳)10 余年; 双侧甲状腺结节史3 年,1 年前行左侧甲状腺切除术,病理示结节性甲状腺肿,平素规律服用左甲状腺素钠片,后续复查甲状腺功能正常,自行停药近10 d;1 年前发现血糖偏高,自行控制饮食,近1 年体质量减轻15 kg。
体格检查:体温36.6 ℃,脉搏96 次/分,呼吸18次/分,血压135/82 mmHg (1 mmHg = 0.133 kPa)。咽部轻度充血,扁桃体无肿大。双肺呼吸音减低,未闻及干、湿性啰音。心律整齐,未闻及杂音。腹软,无压痛、反跳痛,肝、脾肋下未扪及,肠鸣音正常。双下肢无水肿。
二、实验室检查及辅助检查
2021 年12 月6 日血常规示白细胞7.9×109/L,中性粒细胞0.787,淋巴细胞0.152,凝血功能指标正常。ESR 44 mm/h,CRP 77.92 mg/L,降钙素原正常。肺炎支原体抗体IgG 79.4 AU/mL,结核感染T 细胞161.9 pg/mL,促甲状腺激素7.2 µIU/mL,HBsAg > 1000 IU/mL。血生化、GHbA1c、癌胚抗原、神经元特异性烯醇化酶、 细胞角蛋白19、鳞状上皮细胞癌抗原等检测结果均未见异常,痰培养、痰找抗酸杆菌、结核菌素试验、嗜肺军团菌抗体、副流感病毒抗体、Q 热立克次体抗体、肺炎衣原体抗体、腺病毒抗体、呼吸道合胞病毒抗体、甲型流感病毒抗体、乙型流感病毒抗体IgM、真菌G 试验+ GM 试验、隐球菌荚膜抗原、丙型肝炎病毒抗体、HIV 抗体、梅毒抗体等检测结果均为阴性。心电图、腹部B 超正常。
三、诊疗经过
患者入院后仍有阵发性咳嗽,以干咳为主,偶有盗汗,入院第2~5 日傍晚均有发热,体温38.2~38.6 ℃,无寒战。第4 日行纤维支气管镜检查(图2A),BALF 细菌培养、真菌培养、结核分枝杆菌基因A~E(Xpert 法)均阴性。予患者静脉滴注亚胺培南西司他丁钠2 g 每12 h 1 次、依替米星0.1 g 每日2 次抗感染治疗5 d。第6 日复查示白细胞9.58×109/L,中性粒细胞0.793,淋巴 细 胞0.122,CRP 112.35 mg/L。胸 部CT 示 右肺下叶病灶有新发空洞,周围病灶有吸收,左肺病灶较前增大增多(图1D~F)。抗感染治疗方案调整为莫西沙星0.4 g 每日1 次静脉滴注。第13 日复查纤维支气管镜(图2B),取右下叶背段BALF 行mNGS。第14 日mNGS 结 果(图3)显示HHV-7,序列数49,覆盖度5.69%,相对丰度0.043%。诊断:社区获得性肺炎(CAP),HHV-7感染。即日起增加更昔洛韦0.25 g/d 抗病毒治疗。治疗6 d 后复查胸部CT,结果显示患者两肺病变较前吸收(图1G~I),予出院。出院后予序贯口服阿昔洛韦10 d。2022 年1 月6 日门诊复诊,无不适主诉;查血常规、CRP、IgA、IgM、IgG、补体(C)3、C4 检测结果均正常;淋巴细胞亚群比例分析CD3+T 淋巴细胞0.773(正常值参考范围0.617~0.770)、CD4+T 淋巴细胞0.480(正常值参考范围0.258~0.416)、CD56+T 淋巴细胞0.070(正常值参考范围0.104~0.198)、CD4+/CD8+T 淋巴细胞1.8(正常参考值范围0.9~1.9)、CD19+T 淋巴细胞0.098(正常值参考范围0.090~0.014)、CD8+T 淋巴细胞 0.266(正常值参考范围0.181~0.296),表明患者免疫功能恢复正常。
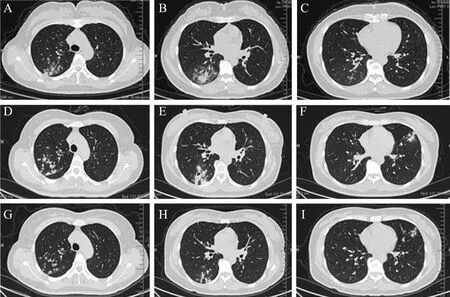
图1 一例HHV-7 肺炎患者诊治前后的胸部CT 变化
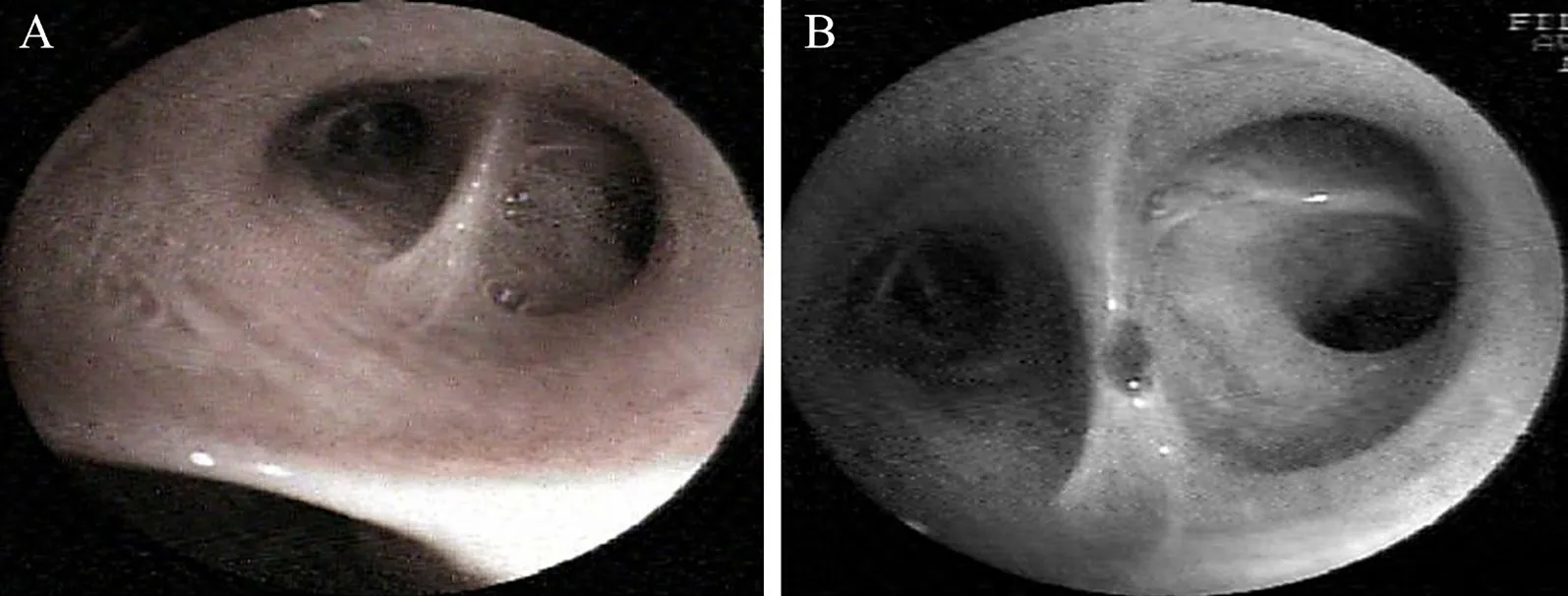
图2 一例HHV-7 肺炎患者2 次纤维支气管镜检查结果
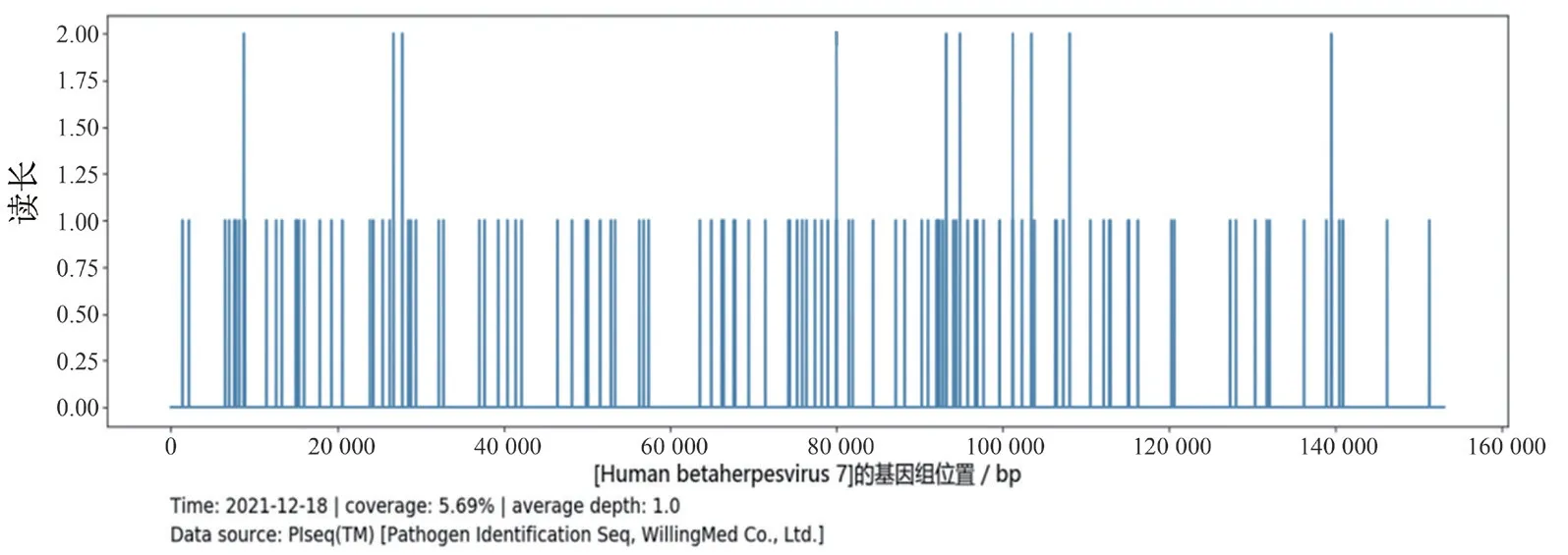
图3 HHV-7 基因组位置分布
讨 论
人类共有8 种疱疹病毒,包括单纯疱疹病毒1 型(HSV-1)、单纯疱疹病毒2 型(HSV-2)、水痘-带状疱疹病毒(VZV)、EB 病毒(EBV)、人类巨细胞病毒(HCMV)、HHV-6、HHV-7 和卡波西肉瘤相关病毒[3]。其共同特征是在初次感染后,病毒会在感染者体内建立终身潜伏期[4]。Amanati等[5]对83 例接受机械通气的重症患儿行支气管肺泡灌洗术,通过PCR 得出HSV-1、HHV-6、HHV-7、EBV 和HCMV 的估计流行率为2.4%、13.2%、2.4%、7.2%和2.4%。
HHV-7 是普遍存在的病毒,常见于人血白细胞中,健康人群血清HHV-7 抗体阳性率较高[6]。其原发性感染通常发生于儿童时期,病毒会在包括肺、唾液腺在内的一些器官组织中潜伏或持续存在[2]。HHV-7 在宿主免疫功能下降时,被重新激活后可引发感染且伴有明显临床症状。HHV-7 传播途径与其潜伏部位密切相关,再激活机制目前尚不明确,该病毒能够导致脊髓炎、脑炎、面神经炎等神经感染性病变;也可在接受造血干细胞或器官移植以及放射治疗或化学治疗、应用免疫抑制剂等免疫功能低下的人群中再激活,表现为发热、皮疹、肝炎、肺炎和心肌炎等[7]。有研究者发现,实体器官移植后常发生HHV-7 感染,而HHV-7 的再激活与骨髓抑制、脑炎和肺炎有关[4]。
CAP 的感染病原体多样化,提高病原学实验室诊断水平有助于尽早明确病因,进而从对症经验性治疗转变为目标治疗。mNGS 具有检测范围广和无需临床预判的优点,可快速、全面地获取病原微生物种属信息,实现精准的感染病学诊断[8-9]。本例患者入院后表现为干咳及傍晚中等程度发热,影像学检查结果显示右肺上、下叶片絮状密度增高影,结节伴晕征;初步诊断CAP 的同时还考虑结核待排。肺结核临床表现不典型,影像学多见两上肺多发小叶中心结节或片状阴影,痰液或BALF 中找到结核分枝杆菌可确诊,然而该患者3次痰找抗酸杆菌、PPD 均为阴性,首次BALF 结核Xpert 法也是阴性,再次观察肺部病灶周围的弥漫磨玻璃影(GGO)和短期复查发现病灶进展,不符合肺结核为慢性进展的特点,故排除。患者前后2 次的胸部CT 示GGO、进展空洞、多发环形结节,且抗炎治疗无效,疑诊为真菌感染,但BALF真菌培养阴性,真菌G 试验+ GM 试验阴性,故真菌性肺炎可能性不大。患者连续CT 表现外周结节样病灶进展为磨玻璃状的环形结节,斑片状的GGO 等似乎符合VZV 感染的表现,然而mNGS 结果推翻了这种猜测[10]。其他检查结果亦排除了常见呼吸道病毒、肺炎支原体、军团菌等感染。为进一步明确病原体,本例患者行第2 次支气管镜检查后进行了BALF-mNGS 检测,结果回报HHV-7序列数为49,未发现其他有意义的病原体,故考虑HHV-7 为主要致病微生物,并进行针对性抗病毒治疗,获得良好疗效。该病例的诊疗过程,突出了mNGS 在罕见感染类型中的重要意义。值得注意的是,有研究通过采集5 岁以下病因不明的CAP患儿鼻咽或口咽拭子,进行下一代测序(RNAseq)和泛病毒组(PVG)PCR 发现靶向病毒基因组DNA 的PVG PCR 比RNA-seq 更能检测到HHV[10]。
目前HHV-7 肺炎尚无标准的治疗方案,其临床用药与其他类型疱疹病毒感染相似,常用核苷或核苷酸类似物治疗,药物的抗病毒机制主要为干扰或抑制裂解期病毒DNA 的合成,对裂解期的病毒复制有抑制作用[3]。本例患者确诊后静脉滴注更昔洛韦,出院后序贯口服阿昔洛韦;其在病程前5 d 经验性抗感染治疗后咳嗽无减轻,反复发热,血CRP 水平较前上升,至第6 日调整为单药莫西沙星抗感染后症状改善。故不能排除其合并二次细菌感染的可能,因此在mNGS 回报检出HHV-7 后,选择予其更昔洛韦与莫西沙星联合治疗。
针对该病例还有几点值得思考:HHV-7 感染多发生于免疫功能低下患者,而该患者免疫功能正常,表明免疫正常群体也有一定发病率[7]。慢性病毒性肝炎患者往往存在免疫应答缺陷,而该患者有乙型肝炎小三阳病史,这是否此次感染的诱因?患者1 年前行甲状腺部分切除术,术后长期服用左甲状腺素钠片替代治疗,在入院前半个月停药,入院后检查发现甲状腺功能仍低下;近1 年自行控制饮食,体质量下降15 kg。此次感染是否与甲状腺功能减退或减重有关?目前国内鲜少有对上述因素与HHV-7 感染关系的文献报道,在此提出疑问,以期为今后同仁们更深入地探索研究提供思路和方向。
综上所述,HHV-7 肺炎发病率低,临床症状不典型,影像学表现无特异性,对于早期抗感染治疗效果欠佳的患者应及时行BALF-mNGS 检测以明确诊断。

