人脐带和胎盘间充质干细胞细胞因子分泌的比较研究
张坤 李芳 肖东杰 高德海 孙志军 刘华
随着细胞生物学的进步,细胞治疗作为一种新型疗法登上历史舞台,其中间充质干细胞(MSC)在新型冠状病毒肺炎、脊髓损伤等难治性疾病中取得了显著进展[1-2]。MSC 已被证实可从多个组织器官中分离获得。而取材脐带及胎盘的MSC 由于无需采取有创性操作,属于产后医疗废弃物,其体外提取简单,不受伦理限制,低免疫源性,成为较好的MSC 种子细胞来源。不同组织来源和培养条件的MSC 具有不同的生物学特性,这成为影响MSC 药品研发的挑战与难点。近年来,有研究比较了不同MSC 的生物学特性,例如扩增能力、表面标记能力、多向分化能力、免疫调节及基因表达差异等[3-4]。尽管MSC 的具体治疗机制尚不清楚,但MSC 分泌的细胞因子在促进组织再生和调节免疫应答方面都发挥重要作用[5]。
本研究的目的是使用人细胞因子芯片检测脐带间充质干细胞(UC-MSC)与胎盘间充质干细胞(P-MSC)细胞因子的分泌情况。细胞因子表达水平的检测,有助于更好地探索MSC 的作用机制,为临床选择MSC 类型提供实验数据支持。
材料与方法
一、试剂与耗材
MEM 培养基、胎牛血清、胰蛋白酶-EDTA、重组碱性成纤维细胞生长因子(bFGF)、表皮生长因子(EGF)均购自美国Gibco 公司,胶原酶Ⅰ购自美国Worthington公司。鼠抗人单克隆抗体CD13-PE、CD34-PE、CD44-PE、CD45-FITC、CD73-PE、CD90-PE、CD105-FITC、HLA-DR-FITC 均购自美国BD 公司。油红O、茜素红S 染色试剂购自武汉谷歌生物科技有限公司,硝酸银试剂购自上海国药集团化学试剂有限公司。OriCellTMMSC 成脂/成骨诱导分化培养基试剂盒购自广州赛业生物科技有限公司公司。TGF-β1、ICAM-1 ELISA 试剂盒购自武汉博士德生物工程有限公司,IL-1β ELISA 试剂盒购自武汉伊莱瑞特生物科技股份有限公司。RNAex Pro Reagent、反转录试剂盒购自湖南艾科瑞生物工程有限公司,UltraSYBR Mixture 试剂购自北京康为世纪公司。细胞因子(QAH-CAA-1000)芯片购自瑞博奥(广州)生物科技股份有限公司。
二、方 法
1. MSC 的分离培养
人体组织标本采集已获得济南市中心医院伦理委员会的批准(2021-093-02),样本采集前获得所有供者知情同意,脐带取自山东第一医科大学附属中心医院产科,通过贴壁法获得UC-MSC[6]。P-MSC来自山东医科元多能干细胞生物工程有限公司。每组经分离得到7 株细胞,P5 代用于后续实验。
2. MSC 的多向分化能力鉴定
MSC 以4×104或2×104细胞/孔的密度接种于6 孔板中,按照说明书,在成脂或成骨细胞诱导分化液中培养14~21 d 后进行油红O、硝酸银和茜素红S 染色,显微镜下拍照。使用ImageJ 软件进行定量分析。
3. MSC 的流式细胞术鉴定
消化后的MSC 加入下列抗体:FITC-HLA-DR、PE-CD34、FITC-CD45、PE-CD13、PE-CD44、PECD73、PE-CD90、FITC-CD105。孵育20 min,磷酸盐缓冲液(PBS)洗1 次,BD FACSCalibur 流式细胞仪检测,FlowJo 软件进行分析。
4.细胞培养上清的获取
将MSC 以4×105细胞/孔的密度接种于6 孔板中。细胞贴壁用PBS 洗涤两次,加入含有2%FBS 的MEM 中培养。收集48 h 的条件培养基,1107×g 离心10 min,上清-80 ℃保存。
5.细胞因子的芯片检测
按照说明书检测上清液中80 种细胞因子的表达量。采用激光扫描仪扫描信号,使用QAHCAA-1000 的数据分析软件来分析。
6.差异表达蛋白(DEP)筛选及KEGG 通路富集分析
检测的原始数据用软件归一化后进行DEP 筛选。筛选条件如下:①logFC > log2(1.2),差异阈值为1.2;②校正后P < 0.05,并以聚类热图进行可视化。对分泌量前20 的细胞因子进行KEGG通路富集分析。挑选的标准是落在某个KEGG 上细胞因子数目≥2, P < 0.05,取前20 个富集的信号通路结果制图。
7. ELISA 检测细胞因子的表达
为验证芯片检测结果,使用人ELISA 试剂盒按照说明书分别检测培养上清中IL-1β、人细胞间黏附分子-1(ICAM-1)和TGF-β1 的表达水平。每个样品做3 个复孔。
8.实时PCR(RT-PCR)检测相关基因的表达
TRIzol 法抽提MSC 总RNA,采用反转录试剂盒按步骤进行反转录为cDNA。以cDNA 为模板,引物序列见表1,分别扩增,以β-肌动蛋白(β-actin)作为PCR 的内参基因。RT-PCR 反应条件:95 ℃10 min,95 ℃ 15 s,63 ℃ 30 s,40 个循环。

表1 引物列表
三、统计学处理
芯片数据使用来自Bioconductor 的limma 分析,2 组比较采用moderated t 检验。本文其他数据采用SPSS 22.0 统计学软件处理数据,符合正态分布的计量资料以表示,比较采用t 检验。P <0.05 为差异有统计学意义。柱状图均采用GraphPad Prism 6 软件绘制,图像分析采用ImageJ 软件分析。
结 果
一、MSC 分化能力比较
流式细胞术检测P5 代MSC 细胞表面标志物,结果显示UC-MSC 和P-MSC 高表达CD13、CD44、CD73、CD90 和CD105(> 95%),低表达HLA-DR、CD34 和CD45(< 2%)。两种MSC 表面标志物的表达差异均无统计学意义(P 均> 0.05),见表2。
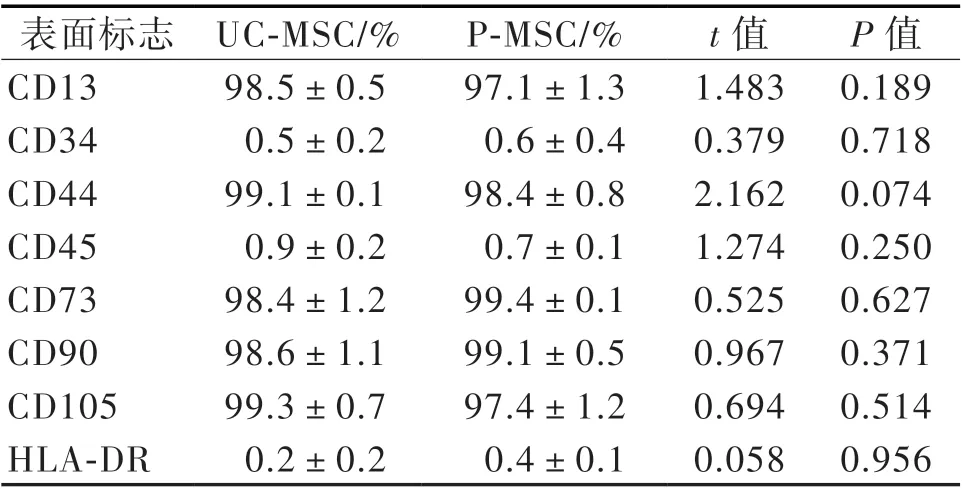
表2 流式细胞术检测MSC 的表面标志物表达(n = 7)
光镜下观察UC-MSC 和P-MSC 细胞呈长梭形,经过3 周的成脂和成骨诱导分化,油红O 染色可以观察到MSC 呈橘红色,有脂滴形成。硝酸银及茜素红S 染色可以在MSC 细胞质中观察到黑色和橘红色的钙盐沉积。这说明人脐带及胎盘来源的MSC 均具有成脂和成骨分化能力。脂肪细胞及骨钙化结节计数显示两种细胞成脂(t = 1.370,P =0.220)、成骨(t = 2.252,P = 0.065)分化能力差异均无统计学意义(P 均> 0.05),见图1。
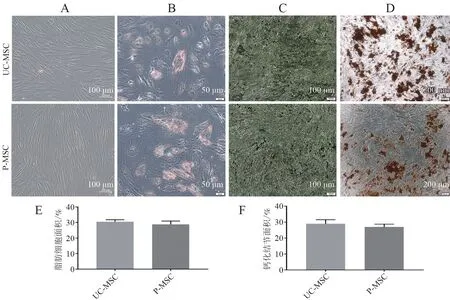
图1 UC-MSC 和P-MSC 的培养形态及多向分化潜能
二、UC-MSC 和P-MSC 细胞因子分泌的表达
收集条件培养基,通过芯片分析80 种细胞因子的相对表达水平。芯片结果显示,UC-MSC 与P-MSC 上清中前10 位高表达细胞因子依次为胰岛素样生长因子结合蛋白4(IGFBP-4)、IGFBP-3、IGFBP-6、基质金属蛋白酶组织抑制剂(TIMP)-1和TIMP-2、IL-6、TGF-β1、 肝 细 胞 生 长 因 子(HGF)、单核细胞趋化蛋白-1(MCP-1)和人细胞间黏附分子-1(ICAM-1);低表达或不表达的因子依次为EGF、IL-17、IL-12p40、B 淋巴细胞趋化因 子(BLC)、TNF-β、IL-13、MIP-1δ、Eotaxin-2、IL-12p70、血小板衍生生长因子-BB(PDGF-BB),见表3、4。
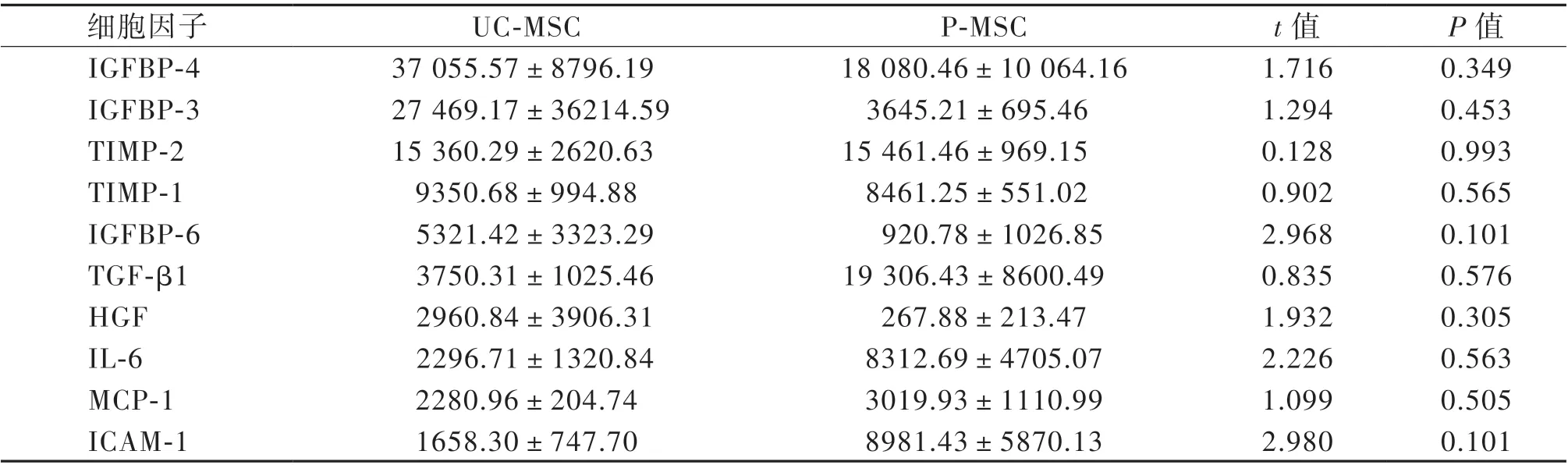
表3 芯片检测MSC 细胞因子表达前10 位(n = 3) 单位:pg/mL
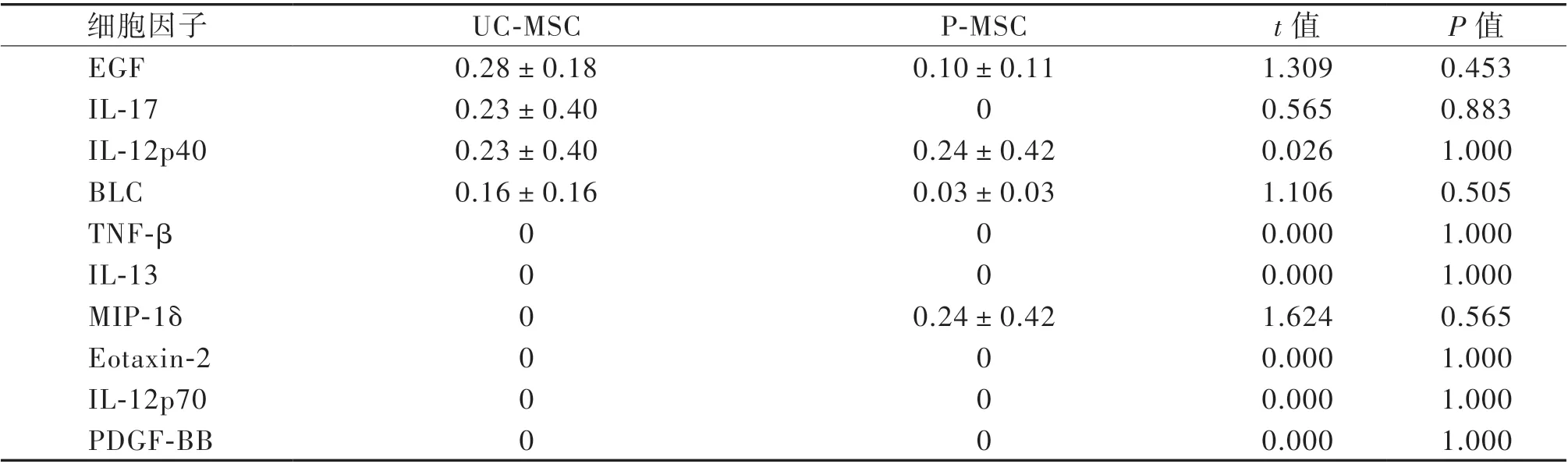
表4 芯片检测MSC 细胞因子表达后10 位(n = 3) 单位:pg/mL
三、筛选UC-MSC 和P-MSC 分泌细胞因子的DEP 及KEGG 通路富集分析
比较UC-MSC 和P-MSC 上清中细胞因子差异,发现有5 个DEP,分别为TNFRⅡ、干细胞因子(SCF)、神经生长因子受体(NGFR)、TGF-β3 和IL-1β(P 均< 0.05,图2A)。
利用clusterProfiler 软件包对分泌量前20 的细胞因子进行KEGG 通路富集分析,观察这些因子在信号通路中的富集情况。选取前20 个富集的信号通路,分析发现分泌量前20 的细胞因子主要富集在“细胞因子-细胞因子受体相互作用”“TNF信号通路”和“MAPK 信号通路”等通路(P < 0.05,图2B)。
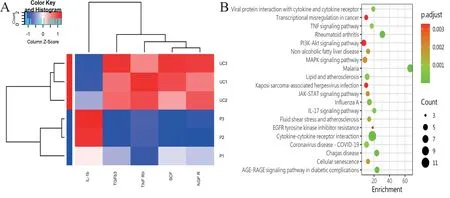
图2 UC-MSC 和P-MSC 分泌细胞因子的聚类热图和KEGG 通路富集分析
四、ELISA 和RT-PCR 验证芯片检测结果
通过ELISA 检测条件培养基中细胞因子的表达水平,结果显示,UC-MSC 和P-MSC 表达量较高的两个因子TGF-β1(t = 1.976,P = 0.119)、ICAM-1(t = 0.953,P = 0.377)两者之间差异无统计学意义,P-MSC 的IL-1β 水平高于UC-MSC(t =5.176,P = 0.001)(图3A)。此外,RT-PCR 检测结果表明,UC-MSC 与P-MSC 相比,基因TGF-β3(t = 4.090,P = 0.002)、SCF(t = 3.552,P = 0.005)和TNFRⅡ(t = 2.374,P = 0.039)表达水平较高。IL-1β 基因在P-MSC 中的表达水平高于UC-MSC(t = 3.546,P = 0.005)。TGF-β1(t = 0.774,P =0.457)、ICAM-1(t = 1.008,P = 0.331)基因在UC-MSC 和P-MSC 之间表达差异无统计学意义(图3B)。ELISA 和RT-PCR 结果与细胞因子芯片结果一致。
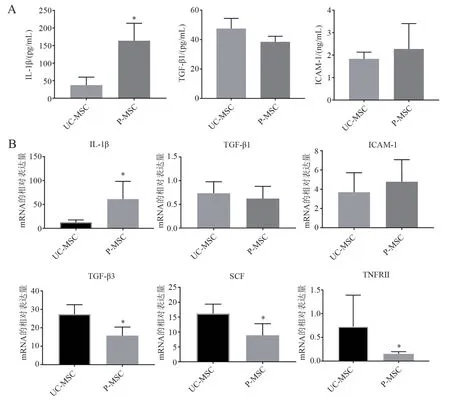
图3 ELISA 和RT-PCR 检测相关因子及基因表达
讨 论
由于MSC 具有自我更新、多向分化潜力和旁分泌作用,被认为是再生医学干细胞治疗的重要种子细胞。迄今为止,骨髓MSC(BM-MSC)、脂肪MSC(A-MSC)、UC-MSC 和P-MSC 是临床研究中最常用的干细胞[7-8]。有荟萃分析比较了不同来源的MSC 在临床治疗中的效果,发现不同来源的MSC 在临床研究中发挥不同的治疗作用[9-10]。
在本研究中,笔者团队采用相同的培养基,从人的胎盘和脐带组织中分离获得MSC。通过形态观察,流式细胞仪分析和诱导分化,UC-MSC 和P-MSC 表现出相似的形态、表面标志物和分化潜能。这与Li 等(2014 年)的研究结果一致。
最近研究表明,MSC 可以通过旁分泌因子来促进邻近细胞的增殖和分化能力[11-12]。有研究检测了不同MSC 的细胞因子表达,如 HGF、bFGF、血管细胞黏附分子-1 和血管内皮生长因子(VEGF)[13-14]。但目前还没有系统地研究不同MSC 分泌的细胞因子。在本研究中,使用细胞因子芯片检测两种MSC 分泌的80 种细胞因子,结果显示人胎盘与脐带MSC 分泌的细胞因子基本一致。Park 等[15]检测了BM-MSC 分泌的120 种细胞因子,高表达IL-6、IL-8、TIMP-2、MCP-1、VEGF和骨保护素,与本研究高表达细胞因子不同,可见不同组织来源的MSC在细胞因子分泌上存在差异。也有研究用ELISA 检测UC-MSC 和P-MSC 中TGF-β1、HGF、VEGF 和EGF 的表达量,两种MSC 的表达没有差异,与笔者团队的研究结果相同[13-14]。而在Wu 等[13]的研究中发现UC-MSC 分泌的bFGF 高于P-MSC,分泌的SCF 低于P-MSC,这与本研究的结果不同,这可能与胎盘的取材部位有关,他们的MSC 取自胎盘的蜕膜,本研究的则取自绒毛膜。
UC-MSC 和P-MSC 高分泌的细胞因子IGFBP,是一类与IGFs 有高度亲和力并调控其作用的蛋白,IGFBP-4 能增强神经元祖细胞的分化[16]。IGFBP-3是一种不稳定的亲水性蛋白,可调控细胞增殖、凋亡、蛋白质磷酸化和信号转导通路等。已有研究证明IGFBP-3 可以诱导血管生成[17]。IGFBP-6影响MSC 多能性和肌原性分化[18]。MSC 大量分泌的IGFBP 可能在血管生成及神经和肌肉修复方面发挥作用。TIMP 可以通过抑制MMPs 来调节细胞外基质的重塑。Clarke 等(2015 年)发现TIMP-1和TIMP-2 可以减少MSC 的迁移和侵袭,促进细胞增殖并发挥抗凋亡的作用。TGF-β1 是TGF-β 超家族的关键成员,Li 等(2015 年)认为MSC 分泌的TGF-β1 能降低T 细胞增殖,以帮助治疗免疫性疾病。同时笔者团队前期研究显示MSC 通过激活TGF-β1/Smad3/PLOD2 通路改善脊髓损伤后的功能恢复[19]。HGF 在细胞增殖分化,组织纤维化,肿瘤发生、转移、耐药等方面起着重要作用。Yang(2015 年)发现MSC 可以通过旁分泌HGF稳定急性肺损伤中的内皮屏障功能。ICAM-1 是黏附Ig 超家族的成员,可以促进MSC 归巢至靶器官,并增强在炎症性肠病和GVHD 模型中的免疫抑制作用[20]。有研究发现,在动物实验中MSC 通过ICAM-1 的表达来促进脑微血管内皮细胞的血管生成,从而有助于帕金森病的恢复[21]。MSC 通过分泌大量的细胞因子在修复受损组织,促进组织分化再生,免疫调节方面发挥作用。Manochantr 等(2013 年)研究报道,在体外UC-MSC 和P-MSC具有相似的免疫抑制功能。在小鼠模型中,UCMSC 和P-MSC 对预防GVHD 发生具有相似的效果[22]。
本研究KEGG 通路富集分析UC-MSC 和P-MSC高表达的细胞因子,发现这些因子主要富集在“细胞因子-细胞因子受体相互作用”“TNF 信号通路”“MAPK 信号通路”等通路中,这些信号通路介导多种细胞过程,参与细胞增殖、分化、衰老、凋亡、免疫调节和炎症反应[23-24]。聚 类 热 图表明UC-MSC 和P-MSC 分泌的细胞因子基本一致,仅有5 个DEP,分别为TNFRⅡ、SCF、NGFR、TGF-β3 和IL-1β。在差异表达的细胞因子中,已有的研究证明TNFRⅡ对维持MSC 再生功能,例如伤口愈合、内皮促血管生成支持有重要作用,能够改善阿尔茨海默病,是MSC 免疫和再生功能的关键调节因子[25]。有研究证明TGF-β3 在体外能够诱导MSC 向软骨分化[26]。同时TGF-β3 能促进MSC的肌腱分化能力[27]。虽然两种MSC 在因子表达上略有差异,但其分泌量较少,且在机体内发挥的作用尚值得商榷。
本研究在体外培养条件下比较了UC-MSC 和P-MSC 细胞因子分泌情况,细胞因子表达情况大致相同,关于UC-MSC 和P-MSC 移植后在不同疾病模型中,是否分泌相似的细胞因子,尚需要进一步研究。

