Cx32、Src/FAK 信号通路在肝癌组织中的表达及其与肝癌术后患者预后的关系
余美玲 马翔 董淑英 童旭辉
肝细胞癌(肝癌)是我国第四高发的恶性肿 瘤,其致死率在所有恶性肿瘤中排名第二[1]。细胞缝隙连接(GJ)是细胞之间的一种蛋白质连接通道,由特殊的通道蛋白[连接蛋白(Cx)]组成[2]。研究显示,肿瘤的发生、发展过程往往伴随着Cx表达的降低或者缺失,而上调或恢复肿瘤细胞中的Cx 表达水平,可抑制肿瘤细胞的生长、分化,降低细胞的侵袭、转移能力,逆转耐药[3-6]。Cx32在正常肝细胞表达的主要连接蛋白中占90%,是肝细胞缝隙连接最主要的结构基础[7]。在肝癌的发生、发展过程中,Cx32 表达水平会明显下降[7]。Src/局部黏着斑激素(FAK)信号通路在多种肿瘤细胞中持续性激活,Src 是一种相对分子量为60 kDa 的非受体酪氨酸激酶。对于人源的Src 而言,主要的磷酸化位点包括激酶区负责活化的pTyr416位点和C 端尾链抑制性的pTyr530 位点。当激活时,Src 在酪氨酸残基 416 位点自磷酸化,因此在本研究中主要分析了p-Src Y416 的表达水平。Src可以激活Src 蛋白的细胞质复合物蛋白,如FAK。人FAK 含有6 个可以被磷酸化的酪氨酸,Tyr397、Tyr407、Tyr576、Tyr577、Tyr861、Tyr925。 笔 者在前期研究证实,肝癌细胞中Cx32 是Src/FAK 信号通路的上游调控因子[4]。为进一步探讨Cx32、Src/FAK 信号通路在预测肝癌患者预后中的作用,本研究在前期研究的基础上对97 例接受肝癌根治性手术的患者进行随访,分析肝癌组织中Cx32、Src/FAK 的表达水平与患者预后之间的关系。
对象与方法
一、研究对象
收集2014 年1 至12 月在蚌埠医学院第一附属医院肝胆外科接受根治性手术的97 例患者的肝癌组织标本和相应的癌旁组织标本(距离肝癌病灶2 cm 的肝组织)。所有标本均经中性甲醛固定,常规石蜡包埋, 5 µm 厚连续切片。所有患者术前都未接受放射治疗、化学治疗和免疫治疗等相关治疗。对患者进行随访,随访时间至2019 年12月,最终入组97 例。本研究方案经蚌埠医学院伦理委员会批准(批件号:[2020]第120 号),患者均已签署知情同意书。
二、方 法
1. 临床资料收集
收集97 例患者的临床资料,包括年龄、性别、是否肝硬化、是否乙型肝炎、肿瘤最长直径、有无包膜、甲胎蛋白水平、肿瘤分化程度、生存与否或死亡时间。分层分析时将肝癌分化程度依据《肝脏活检病理解读(第2 版)》分为高分化(肝癌组织接近正常组织,恶性程度低)、中分化(肝癌组织与正常组织差别不大,中度成熟,中度恶性程度)、低分化(肝癌组织与正常组织相差大,成熟度差,恶性度高)3 种情况;根据甲胎蛋白水平分为 ≤400 µg/L 和> 400 µg/L 2 种情况。
2. 免疫组织化学(免疫组化)染色法检测
使用免疫组化染色法检测Cx32、磷酸化-Src(p-Src)Y416、 总Src(total Src)、 磷 酸 化FAK(p-FAK)Y925、总FAK(total FAK)在肝癌组织以及相应癌旁组织中的蛋白表达:取病理组织切片脱蜡,梯度乙醇水化,枸橼酸盐缓冲液(pH =6.0)高温修复,3% 过氧化氢阻断内源性过氧化物酶后滴加血清封闭;然后将切片与一抗在4 ℃孵育过夜,复温后滴加二抗室温下孵育 15 min,二氨基联苯胺显色5 min;苏木精复染,脱水透明后中性树胶封片。以细胞内出现黄色或棕黄色颗粒为阳性表达,按阳性细胞所占百分比评分:<5%为(-),5%~10% 为(+),11%~50% 为(++),51%~75%为(+++),>75%为(++++)[8]。分层分析时将不表达和表达(+)归为低表达,表达(++ ~++++)归为高表达。
三、统计学处理
使用SPSS 20.0 对数据进行统计分析,计数资料采用配对χ2检验。采用单因素Cox 回归分析收集到的肝癌手术患者的各项指标与肝癌术后患者的生存预后是否有关。将单因素Cox 回归分析结果中有统计学意义的指标纳入多因素Cox 回归模型(纳入法),分析肝癌术后患者生存的影响因素。通过绘制生存曲线(Kaplan-Meier 法)以及对数秩检验(Log-rank test)探讨Cx32、p-Src Y416、p-FAK Y925 蛋白表达与患者生存时间的关系。P <0.05 为差异有统计学意义。
结 果
一、研究对象的基本信息
97 例肝癌患者中,男72 例、女25 例,年龄25~78 岁、中位年龄55 岁;肝硬化77 例(79%),乙型肝炎66 例(68%);甲胎蛋白> 400 µg/L 28例(29%);低分化17 例(18%),中分化70 例(72%),高分化10 例(10%);肝癌标本无包膜82 例(85%);肿瘤最大直径> 5 cm 54 例(56%);随 访5 年 最 终 生 存55 例(57%), 死 亡42 例(43%)。
二、Cx32、Src/FAK 蛋白在肝癌组织以及相应的癌旁组织中的表达情况
免疫组化染色结果显示,肝癌组织的Cx32蛋白表达阳性率低于相应的癌旁组织,其p-Src Y416、 total Src、 p-FAK Y925、total FAK 的蛋白表达阳性率均高于相应的癌旁组织(P 均< 0.05),见表1 及图1。97 例肝癌组织以及相应癌旁组织中各蛋白的具体表达情况见表2。
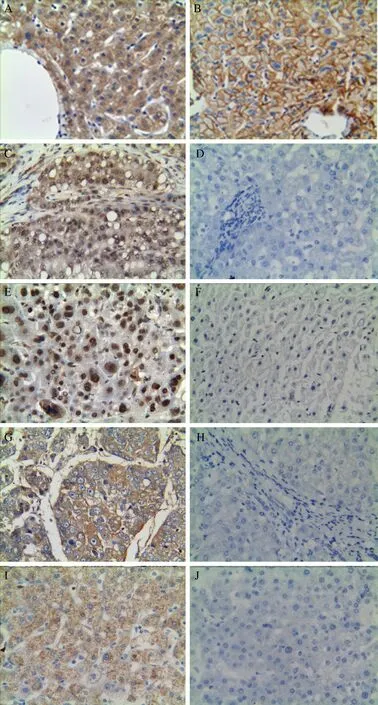
图1 肝癌组织与癌旁组织的Cx32、p-Src Y416、p-FAK Y925、total Src、total FAK 蛋白表达比较(免疫组化染色,×200)

表1 97 例肝癌组织以及相应的癌旁组织中Cx32、Src/FAK 蛋白的表达情况[例(%)]
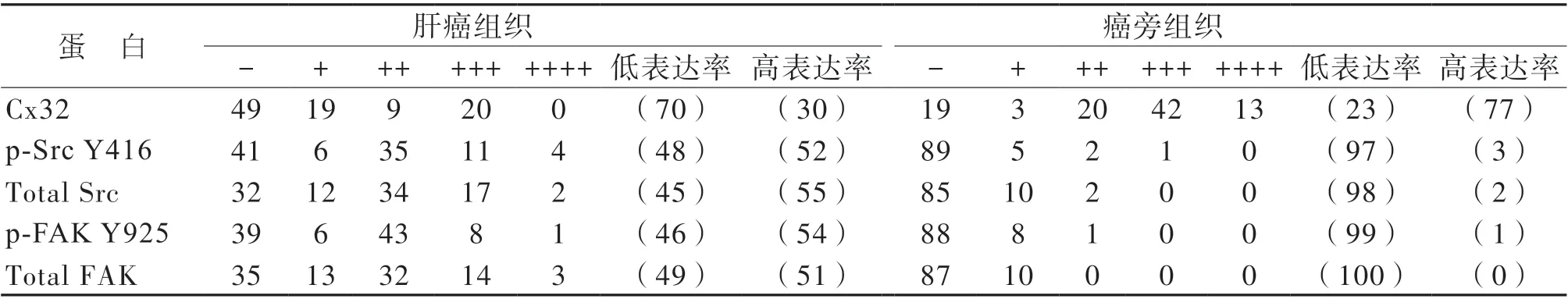
表2 97 例肝癌组织以及相应的癌旁组织中Cx32、Src/FAK 蛋白的具体表达情况[例(%)]
三、97 例肝癌根治性术后患者死亡的单因素和多因素Cox 回归分析结果
单因素回归分析显示,肝癌患者死亡有8 项可疑影响因素,分别为年龄、肿瘤分化程度、肿瘤直 径、Cx32、p-Src Y416、total Src、p-FAK Y925、total FAK 蛋白的表达(P 均< 0.05)。多因素回归分析显示,性别、甲胎蛋白> 400 µg/L、乙型肝炎、包膜、肿瘤长径和total FAK 的蛋白表达均非肝癌患者死亡的影响因素(P 均> 0.05)。高表达Cx32 的肝癌患者死亡的风险可能为低表达Cx32 患者的12%(P < 0.05);高表达p-Src 的肝癌患者死亡的风险是低表达p-Src 肝癌患者的14.306 倍(P< 0.05);高表达p-FAK 的肝癌患者死亡的风险是低表达p-Src 肝癌患者的12.152 倍(P < 0.05)。另外,年龄和高表达Total Src 为独立危险因素,中分化(与低分化对照)为独立保护因素(P 均<0.05),见表3。

表3 97 例肝癌患者单因素和多因素分析结果
四、Cx32、p-Src Y416、p-FAK Y925 与97例肝癌术后患者总体生存时间的关系
生存分析显示,肝癌患者中Cx32 高表达者与Cx32 低表达者的生存率分别为46.39%、10.31%(log-rankχ2= 23.856,P < 0.001);p-Src Y416 低表达者与p-Src 高表达者的生存率分别为45.36%、11.34%(log-rankχ2= 56.637,P < 0.001);p-FAK Y925 低表达者与p-FAK Y925 高表达者的生存率分别为42.27%、14.43%(log-rankχ2= 43.599,P <0.001),见图2。
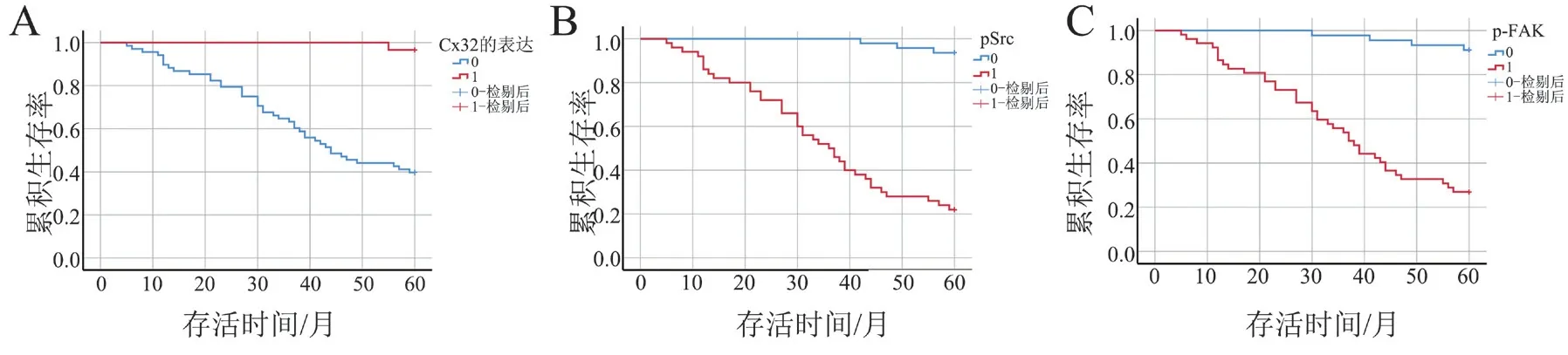
图2 Cx32、p-Src Y416、p-FAK Y925 的生存曲线(Kaplan-Meier 法)
讨 论
Cx32 是肝癌细胞最主要的连接蛋白。研究证实,Cx32 表达下降会促进肝癌的进展、化学治疗耐药,提高肿瘤的侵袭、转移能力[3-4,7]。但Cx32能否作为肝癌的预后预测因子还有待于进一步验证。Sheen 等(2004 年)的研究显示,低表达Cx32 mRNA 的肝癌术后患者预后差,但该研究样本量仅34 例。本研究共收集并成功随访97 例肝癌患者,验证了与低表达Cx32 的患者相比,高表达Cx32 可能是肝癌患者术后死亡的独立保护因素,Cx32 有望成为预测肝癌术后患者预后的标志蛋白。
Src/FAK 信号通路在多种肿瘤细胞中持续性激活[9-10]。Src 在细胞外可以激活Src 蛋白的细胞质复合物蛋白,如FAK 等,Src-FAK 复合物与许多底物的复合物相互作用,包括Crk 相关基质、桩蛋白和p190RhoGAP, 他们在细胞的生长、增殖过程中起重要作用。Src 也可以通过SH2 区域与FAK的C 末端酪氨酸残基结合而磷酸化而使FAK 激活,激活的FAK 调节B1 整联蛋白的活性,调节肿瘤细胞的生长、增殖。Src/FAK 信号通路的激活可促进肿瘤的侵袭、转移、化学治疗耐药,笔者前期研究显示,Src/FAK 信号通路的激活会促进肝癌细胞对多柔比星产生耐药[4]。但Src/FAK 信号通路与肝癌患者生存预后的关系仍有待于进一步探讨。Chen 等(2011 年)的研究显示高表达的p-Src Y416 是肝癌患者死亡的独立危险因素,低表达患者有更长的生存期。本研究显示,高表达p-Src Y416、p-FAK Y925 是肝癌患者死亡的独立危险因素,进一步明确了Src/FAK 信号通路与肝癌术后患者生存预后的关系。
结合笔者既往研究,本研究表明Src 是Cx32在肿瘤细胞中重要的下游调控因子。Sato 等(2007年)研究显示,Cx32 可以通过抑制肾癌细胞Src的活性而抑制肿瘤的侵袭;Fujimoto 等(2005 年)通过Src-STAT3 信号通路抑制血管内皮生长因子介导的血管生成;Hada 等(2006 年)研究显示,Cx32 通过抑制A549 肺腺癌细胞Src 的活性而抑制肿瘤细胞的增殖及迁移;Sato 等(2013 年)研究表明Cx32 还可以通过抑制Src 的活性来增加长春碱在人肾细胞癌中的毒性作用。上述研究均说明,Cx32 可通过影响Src 的活性而调控肿瘤细胞的生长、分化、侵袭、转移以及化学治疗的细胞毒性。但在肝癌细胞中Cx32 如何调控Src/FAK 信号通路尚未阐明。Finn 等(2008 年)报道,Src 能被胞质中的蛋白激活,因此推测随着肝癌的发生、发展、耐药的发生,Cx32 会从细胞膜上异位至胞质中,从而激活Src,下一步我们将进行研究验证该推测。
由于本研究中Cox 多因素回归分析中,高表达Cx32 对肝癌术后患者的影响P 值为0.049,故本研究进一步分析Cx32、Src/FAK 信号通路与接受肝癌根治性手术后患者生存预后的关系,结果显示,低表达Cx32、高表达p-Src Y416、p-FAK Y925 患者生存预后差,患者中位生存期明显缩短,Cx32、p-Src Y416、p-FAK Y925 可能为肝癌术后患者预后的标志。
本研究虽初步证实了肝癌组织中低表达Cx32、高表达p-Src Y416、p-FAK Y925 是肝癌患者预后的独立危险因素,但样本量仍偏小,后续研究中将继续增加样本量,收集多中心的临床数据和标本,并设置更长的随访期,进一步探讨Cx32、Src/FAK 信号通路与肝癌术后患者临床预后的关系,明确Cx32、p-Src Y416、p-FAK Y925 是否能作为肝癌术后患者预后的标志蛋白。

