人乌头酸脱羧酶1基因及其编码蛋白的生物信息学分析
汪涛,孙新,蒋佩佳,肖锦仁,李玲,2
1.湖南中医药大学药学院,湖南 长沙 410208;2.湖南省中药现代化实验室,湖南 长沙 410208
乌头酸脱羧酶1(aconitate decarboxylase 1,ACOD1,又称IRG1)是炎症和感染中免疫代谢的调节因,子能够催化衣康酸的合成。免疫细胞(如巨噬细胞和单核细胞)在病原体感染(如细菌和病毒)、病原体相关分子模式分子(如LPS)、细胞因子(如肿瘤坏死因子和干扰素)等刺激下被激活,会高表达ACOD1[1]。
研究发现,ACOD1参与肿瘤、病原菌感染等多种免疫性疾病,激活ACOD1信号可抑制病原菌感染及炎症反应[2-4]。从细胞层面上,在LPS等病原体相关分子模式分子的刺激下,高表达ACOD1能诱导免疫细胞发生免疫耐受[2];此外,高表达ACOD1也能抑制病原菌对免疫细胞的侵染[3]。通过高表达ACOD1,为进一步研究抗菌抗炎等免疫作用提供了思路,但目前对ACOD1的研究较少,从转录水平上如何激活ACOD1基因的表达,以及ACOD1蛋白的调控作用、分子功能等均有待进一步探讨。因此,ACOD1基因的转录调控因素及ACOD1蛋白的分子功能对于进一步研究免疫细胞的耐受机制、ACOD1的抗炎抗菌活性具有重要意义。
基因的启动子区域一般位于基因转录起始点(transcriptional start site,TSS)上游2 000 bp至下游100 bp[5]。研究基因启动子区域的转录因子结合情况、甲基化位点、单核苷酸多态性(single nueleotide polymorphism,SNP)位点等,是进一步从转录水平上研究基因表达的重要手段[6]。因此,本研究通过预测人ACOD1基因启动子区域转录因子结合位点、甲基化CpG位点、SNP位点,探讨了人ACOD1基因的转录调控因素。此外,通过对人ACOD1基因编码的蛋白进行GO(Gene onotology)蛋白功能注释分析及蛋白互作网络分析,进一步探讨了人ACOD1蛋白的分子功能,以期为进一步研究人ACOD1基因和蛋白的表达调控机制及生物功能,及其在炎症反应、病原体感染等复杂疾病中的调控机制提供参考。
1 方法
从NCBI数据库(https://www.ncbi.nlm.nih.gov;UniProt:https://www.uniprot.org/)中获取人ACOD1基因的基本信息(人ACOD1基因、mRNA及蛋白的GenBank登录号分别为NC_000013、NM_001258406.2、NP_001245335,UniProtKB登 录 号 为A6NK06),以TSS上游2 000 bp至下游100 bp为样本序列,对人ACOD1基因中可能的启动子序列进行预测;运用启动子分析软件Neural Network Promoter Prediction(NNPP)(http://www.fruitfly.org/seq_tools/promoter.html)对人ACOD1基因启动子序列进行分析[7];运用PROMO网站(http://alggen.lsi.upc.es/cgi-bin/promo_v3/promo/promoinit.cgi?dirDB=TF_8.3)和Gene-Regulatiion网站中AliBaba 2程序(http://generegulation.com/pub/programs/alibaba2/index.html)对人ACOD1基因启动子区转录因子及其结合位点进行预测[8];运用EMBOSS(https://www.ebi.ac.uk/Tools/seqstats/emboss_cpgplot/)、MethPrimer(http://www.urogene.org/cgi-bin/methprimer/methprimer.cgi/)和CpG finder(http://www.softberry.com/berry.phtml?topic=cpgfinder&group=programs&subgroup=promoter)对人ACOD1基因2 100 bp启动子区域甲基化CpG岛进行预测[5];运用SNP Function Prediction(https://manticore.niehs.nih.gov/snpinfo/snpfunc.html)对人ACOD1基因启动子SNP位点进行预测[5];运用Gene Ontology Consortium数据集库(http://geneontology.org/)对人ACOD1蛋白进行GO基因本体注释功能分析[9];运用STRING数据库(https://string-db.org/)对人ACOD1蛋白相互作用关系进行分析[9]。
2 结果
2.1 人ACOD1基因基本信息 人ACOD1基因位于13号染色体(13q22.3),全长10 128 bp,含有5个外显子,mRNA全长2 147 bp。
2.2 人ACOD1基因的启动子预测NNPP预测结果显示,人ACOD1基因上游可能存在3个不同的启动子序列,分别位于212~262、283~333和1 958~2 008 bp处。11 958~2 008 bp区域预测得分最高,见表1。
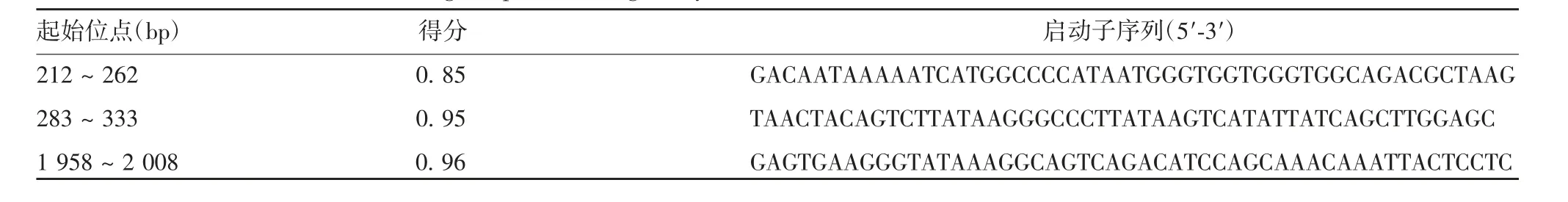
表1 Neural Network Promoter Prediction预测人ACOD1基因的启动子Tab.1 Prediction of human ACOD1 gene promoter region by Neural Network Promoter Prediction
2.3 人ACOD1基因转录因子及其结合位点分析PROMO数据库对人ACOD1基因5'调控区的转录因子结合位点的预测结果显示,共获得78个转录因子,见图1。AliBaba2.1联合TRANSFAC数据库对人ACOD1基因转录因子结合位点进行预测,参数认定为默认值,结果显示,获得65个转录因子,共201个转录因子结合位点,见图2。共有17个相同的转录因子,包括YY1、C/EBPalpha、PU.1、AP-1、NF-1、GATA-1、c-Jun、Oct-2.1、GR、TBP、C/EBPbeta、c-Ets-1、ATF、IRF-1、HNF-1C、CTF和NF-kappaB。

图1 PROMO对人ACOD1基因启动子区域转录因子分析的结果Fig.1 Analysis of transcription factor of promoter region of human ACOD1 gene by PROMO

图2 AliBaba2.1程序预测人ACOD1基因转录因子结合位点部分结果Fig.2 Analysis of partial results of transcription factor binding sites of human ACOD1 gene predicted by AliBaba2.1
2.4 人ACOD1基因启动子区域甲基化CpG岛及SNP位点预测EMBOSS、CpG Finder和MethePrimer 3种预测结果显示,人ACOD1基因启动子区域均无甲基化CpG岛。
SNP Function Prediction对人ACOD1基因启动子SNP位点的预测结果显示,共预测得到12个SNP位点,包括rs11618255、rs11620479、rs11620506、rs1-162511、rs12431246、rs12861343、rs485905、rs488689、rs9544516、rs9574069、rs9574070和rs9574071,保守性均很低。其中,rs9574070在3种人群中存在人种差异,并在3个地区中存在地区差异,见表2。各SNP位点所在的染色体位置、等位基因信息见表3。用于预测的基因序列为ACOD1的启动子区,为ACOD1基因非编码区,不存在非同义SNP(nonsynonymous singlenucleotide polymorphism,nsSNP)位点,与预测结果相同。此外,MYCBP2和SCEL为ACOD1基因的相邻基因,表明其可能与ACOD1具有相似的表达模式。
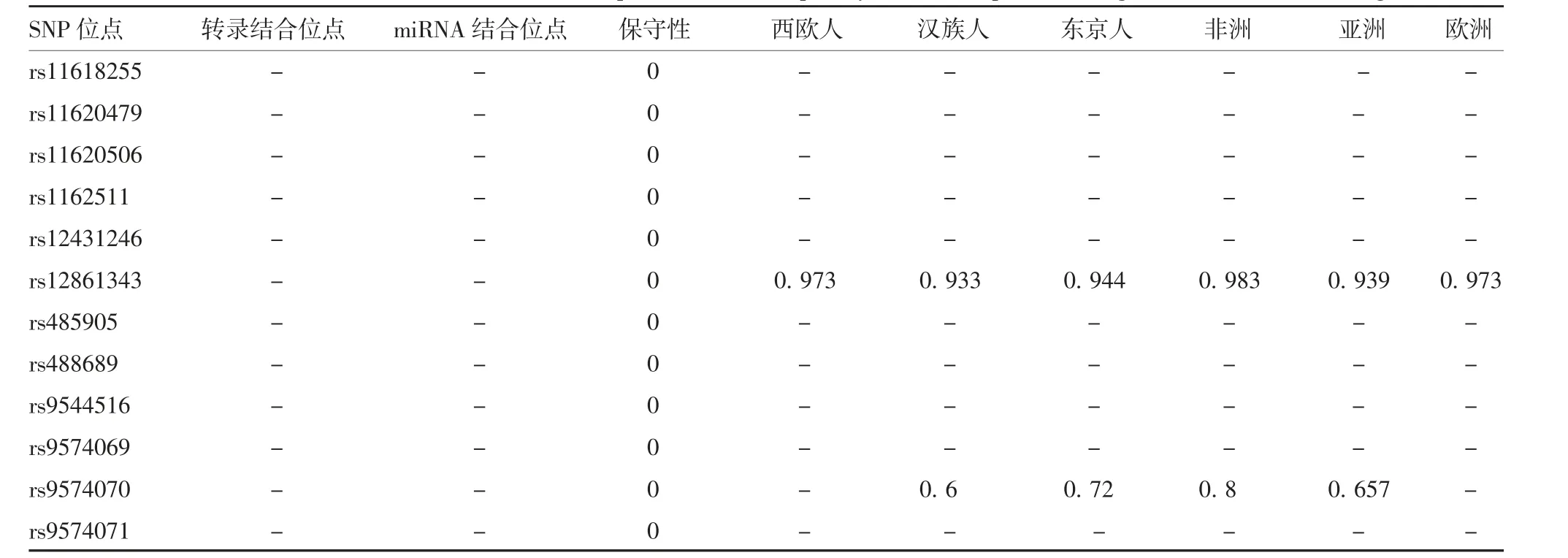
表2 人ACOD1基因启动子区SNP功能信息和种族特异等位基因频率预测Tab.2 Prediction of functional information and race specific allele frequency of SNP in promoter region of human ACOD1 gene
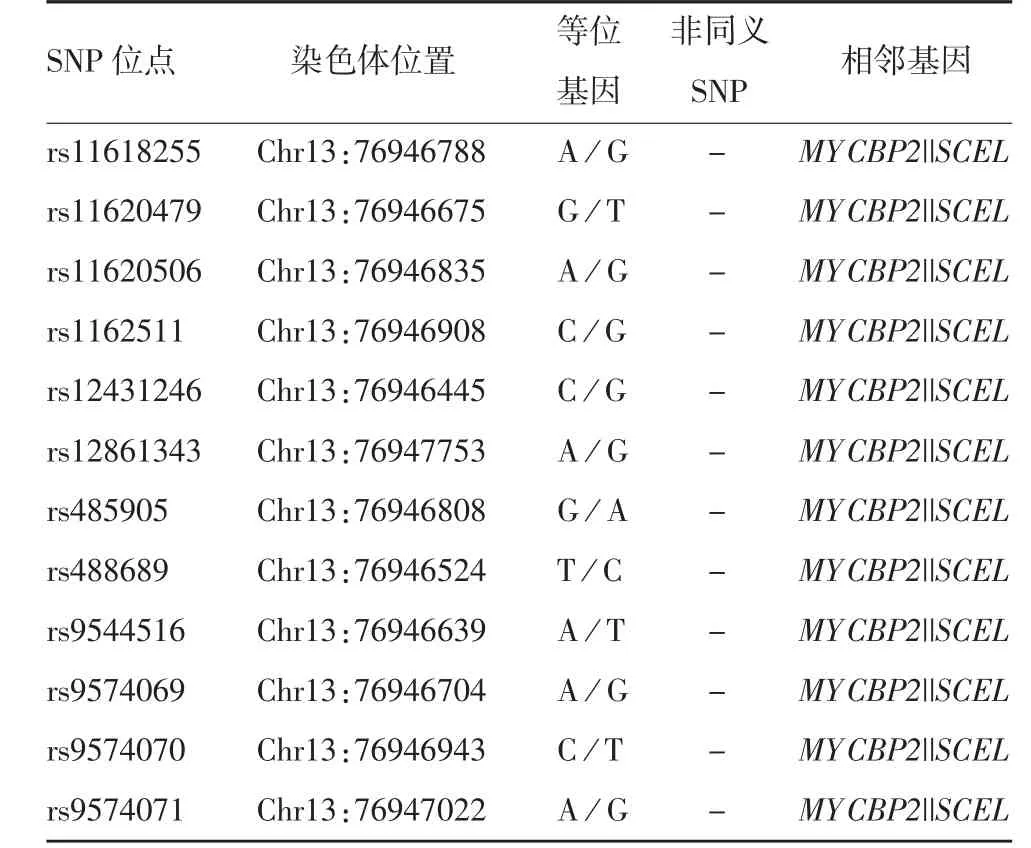
表3 人ACOD1基因启动子区SNP预测Tab.3 SNP prediction of promoter region of human ACOD1 gene
2.5 人ACOD1蛋白功能GO注释分析Gene Ontology Consortium数据库从细胞组成、分子功能和生物学过程对人ACOD1蛋白的分析结果显示,人ACOD1蛋白主要定位在线粒体基质和核质。人ACOD1蛋白参与负调节Ⅰ型干扰素产生、NF-κB转录活性、Toll样受体4信号通路、炎症反应等,参与谷氨酰胺代谢、氨基酸代谢等过程,参与防御反应、胚胎着床、对LPS诱导的免疫耐受等生物学过程。人ACOD1蛋白具有水解酶活性、天冬氨酸氨甲酰转移酶活性、水解酶活性、裂解酶活性、乌头酸脱羧酶活性等分子功能。
2.6 人ACOD1蛋白相互作用网络构建 使用STRING数据库搜索与人ACOD1蛋白相互作用信息,设置置信度为0.4,结果显示,10个蛋白可能与ACOD1具有相互作用关系,结合分数越高,表明结合能力越强。白细胞介素-1β(interleukin-1 beta,IL-1β)相互作用分数最高,表明其可能与ACOD1具有较好的互作关系。人ACOD1蛋白相互作用关系见图3,各分子与人ACOD1蛋白结合能力见表4。

表4 各分子与人ACOD1蛋白结合能力Tab.4 Binding ability of various molecules to human ACOD1 protein
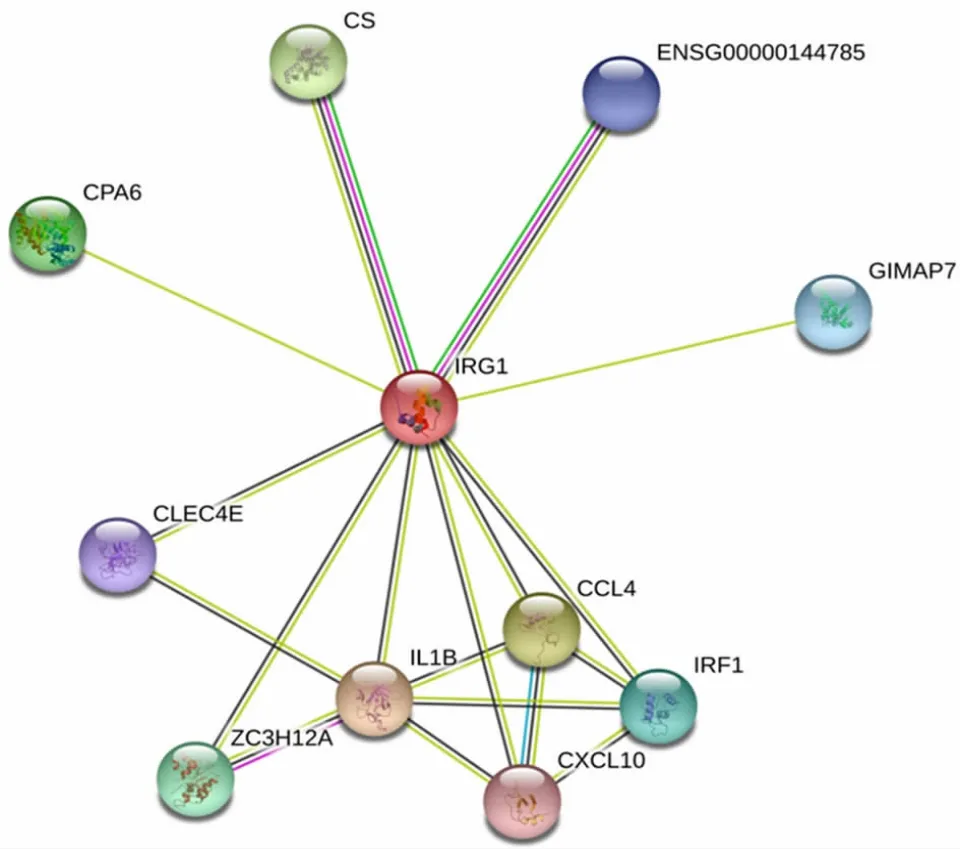
图3 人ACOD1蛋白相互作用预测Fig.3 Prediction of interaction of human ACOD1 protein
3 讨论
炎症反应、抗菌过程、肿瘤、神经退行性改变等病理状态下,均发现ACOD1表达下调,且ACOD1的高表达可抑制病原菌感染、抑制炎症反应等。表明适当激活ACOD1信号,可能对炎症、病原体感染、癌症等多种疾病起到治疗作用。人ACOD1基因定位于13号染色体(13q22.3)上,全长10 128 bp,ACOD1基因在黑猩猩、狗、牛、老鼠、鸡、斑马鱼、爪蟾和曲霉属等其他物种中高度保守[10-12]。ACOD1蛋白主要存在于免疫细胞线粒体中,催化衣康酸合成,并在氧化应激和抗原呈递上发挥重要作用[13-15]。
本文利用生物信息学方法对人ACOD1基因启动子区转录因子、甲基化CpG位点、SNP位点进行预测,并对ACOD1基因编码的蛋白进行GO功能注释及蛋白互作网络分析,对于研究人ACOD1基因及其编码蛋白的表达和调控,明确其生物学功能具有一定的意义。
TSS上游2 000 bp至下游100 bp区域内可能存在3个启动子区,特别是1 958~2 008 bp区域,预测分值最高,推测其可能是核心启动子区,为转录机制提供了高特异性和亲合力的结合位点。此外,预测到17种转录因子结合位点,包括YY1、C/EB-Palpha、PU.1、AP-1、NF-1、GATA-1、c-Jun、Oct-2.1、GR、TBP、C/EBPbeta、c-Ets-1、ATF、IRF1、HNF-1C、CTF和NF-kappaB。TALLAM等[16]通过沉默转录因子IRF1表达,发现转录因子IRF1可调控ACOD1基因的转录水平。
通常情况下,DNA高甲基化会导致基因转录抑制,低甲基化则会导致基因表达增加[17-18]。为研究甲基化修饰对调节人ACOD1基因的转录起始的作用,本研究利用EMBOSS、CpG Finder和Methe-Primer 3种预测软件对人ACOD1基因启动子区CpG岛进行分析,未发现人ACOD1基因启动子区域存在CpG位点,表明人ACOD1基因的表达可能不受启动子区域甲基化的影响。人基因组DNA包含一定水平的多态性,遗传背景可能是决定个体基因表达差异的重要因素。在基因的启动子区域,本研究证实ACOD1存在SNP,且可能以等位基因特异方式影响基因表达水平。表明人ACOD1基因启动子区域SNP存在人种差异和地区差异。
人ACOD1蛋白是以α-螺旋为主,含有481个氨基酸的亲水性蛋白,为同源二聚体结构[10]。8个活性位点残基(Asp93、Thr97、His103、His159、Lys207、Lys272、His277和Tyr318)被发现对人类ACOD1功能至关重要,而这些残基的突变可能导致ACOD1功能丧失[10]。经GO注释分析,进一步从细胞组成、分子功能和生物学过程方面明确了ACOD1蛋白的生物功能。人ACOD1蛋白主要参与负调节Ⅰ型干扰素产生、NF-κB转录活性、Toll样受体4信号通路、炎症反应等,参与对LPS诱导的免疫耐受等生物学过程。相关研究证明了部分生物功能。JAMAL等[3]研究发现,ACOD1蛋白可通过活性氧(reactive oxygen,ROS)增加巨噬细胞中A20的表达,从而促进内毒素耐受。经蛋白互作分析,ACOD1蛋白可能与IL-1β、CCL-4、IRF1、CXCL10等蛋白相互作用,且与IL-1β作用关系最强。
综上所述,本文利用生物信息学方法对人ACOD1基因及其编码的蛋白进行分析,有助于进一步研究人ACOD1基因和蛋白的生物功能,并有助于研究其在炎症反应、病原体感染、肿瘤等复杂疾病中的调控机制。但预测结果尚需在临床研究中得到更多的实验验证。本研究为进一步探索ACOD1基因及其编码蛋白的潜在功能提供了重要的参考依据。

