长链非编码RNA MALAT1在结肠癌中的表达及其对SW620细胞增殖、迁移的影响
吴 惧,殷海鹏,程 楠,尹 敏,尹家俊,李 贺
(1.大连大学附属中山医院 肝胆外科,辽宁 大连116001;2.肿瘤生物医疗和基因检测重点实验室,辽宁 大连116001;3.大连医科大学,辽宁 大连116044)
根据2021年结直肠癌症筛查指南结果显示,结肠癌是世界范围内最为常见的恶性肿瘤之一,发病率位居恶性肿瘤第三位[1-2]。结肠癌的发病过程缓慢隐匿并且早期无典型表现,相关统计显示早期有15%-25%发生远处转移,患者预后差,五年生存率低[3-5]。手术治疗是目前根治结肠癌的主要手段。肺癌转移相关转录本1(MALAT1)是通过对非小细胞肺癌恶性行为的研究首次被发现,随后又发现LncRNA MALAT1不仅仅在肺癌中起作用,还参与很多其他恶性肿瘤的发生进展过程,影响着肿瘤的恶性行为[6-8]。PI3K/Akt通路参与多种恶性肿瘤的发生,在骨肉瘤、卵巢癌等恶性肿瘤的相关研究中均存在该通路的参与[9-10],并且与LncRNA MALAT1的表达相关。在结肠癌中二者是否同样存在某些相关性,目前尚无明确报道。本研究旨在探讨LncRNA MALAT1在结肠癌中的表达情况,观察其对SW620细胞增殖、迁移的影响,并初步探究LncRNA MALAT1下游的潜在转导分子,阐明其在结肠癌发生发展中的作用。
1 材料与试剂
1.1 一般资料收集大连大学附属中山医院行结肠癌根治术患者的术后标本40例,所有手术均为同一团队完成,临床资料完整。细胞系为SW620,其高表达LncRNA MALAT1[11]。引物由大连宝生物科技有限公司设计及合成,RT-PCR仪购自美国ABI公司,蛋白电泳及转膜设备购自美国Bio-Rad公司,抗体购自华安生物技术有限公司,DAB试剂盒SP9001购自北京中杉金桥生物技术有限公司,DMEM培养基购自美国HyClone公司,siRNA干扰序列购自上海吉玛公司。
1.2 方法

1.2.2Western blot实验 提取总蛋白,考马斯亮蓝染色法对样品蛋白定量检测。SDS-PAGE电泳分离,湿法转膜,用含5%脱脂奶粉的TBST室温封闭 1 h,一抗(P13K 1∶2000,Akt l∶2000,Beta-actin 1∶500),4℃孵育过夜加二抗(1∶20 000),室温孵育1 h,用ECL法化学发光,用Image J分析扫描灰度值,β-actin设置为内参照。
1.2.3免疫组化实验 切片55℃烤片过夜或者60℃烤片2-4 h。脱蜡后梯度浓度酒精脱水,采用高压热修复法进行抗原修复,滴加内源性过氧化物酶阻断剂,山羊血清工作液对组织进行封闭,滴加一抗,置于4℃冰箱过夜。滴加生物素标记山羊抗兔IgG聚合物,滴加辣根酶标记链霉卵白素工作液,孵育20 min,DAB工作液显色。复染、树胶封片,阳性和阴性结果依据H-score评分方法进行判读。
1.2.4si-RNA细胞转染 干扰序列为si-MALAT1P:5′-GGGCUGACAUUAACUACAATT-3′;si-NC:5′-UGACCUCAACUACAUGGUUTT-3′。将细胞种入6孔板中,细胞密度要求大于70% 进行转染;5 μl DMEM 稀释于100 μl的无血清DMEM中,混匀,静置5 min;将20 μl si-MALAT1及si-NC分别稀释于100 μl的无血清DMEM 后,混匀,静置 5 min; A、B液室温下孵育 20 min;加入2 ml 完全培养基,再加入混合溶液,置于培养箱中。
1.2.5CCK-8增殖实验 在96孔的培养板内种下待检测细胞;分别于0 h、24 h、48 h、72 h时加入 CCK-8试剂(10 μl /孔),避光操作,孵育 2 h;用酶标仪对样品吸光度进行检测。
1.2.6Transwell实验 在含有20%胎牛血清培养基的下室中放入Transwell小室(孔径8 μm),将细胞接种在含无血清培养基的上室中,培养24 h。PBS清洗,多聚甲醛固定,最后结晶紫进行染色。显微镜下观察拍摄。
1.2.7集落形成实验 在6孔板中接种转染后的细胞,每孔约1000个;定期更换培养基,两周后固定(无水甲醇),染色(结晶紫),计数菌落形成数量。
1.3 统计学分析
SPSS19.0统计软件进行实验数据分析,计量资料采用均数±标准差表示,计数资料采用n(%)表示,两组间计量资料采用t检验,计数资料采用卡方检验,P<0.05表示差异存在统计学意义。
2 结果
2.1 组织中LncRNA MALAT1的表达情况及与患者临床特征的关系
RT-PCR技术对40例结肠癌组织及癌旁组织检测发现:癌组织中LncRNA MALAT1的表达较癌旁组织中更为明显,差异具有统计学意义(P<0.05)(图1)。癌组织中高于平均值水平作为高表达结果,与患者临床特征进行比较,发现LncRNA MALAT1的表达与患者的淋巴结转移存在相关性(P<0.05)(表1)。
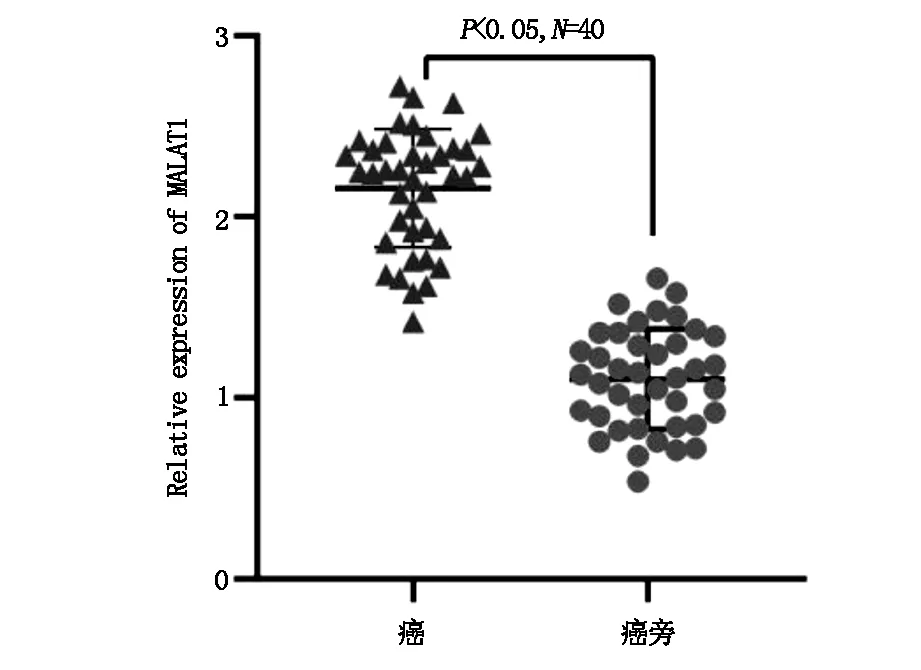
图1 RT-PCR法测定组织中LncRNA MALAT1的表达,P<0.05

表1 患者临床特征与LncRNA MALAT1高表达及低表达的比较
2.2 p-PI3K、p-Akt在结肠癌组织中的表达
通过免疫组化实验观察癌及癌旁组织中蛋白p-PI3K、p-Akt表达情况(图2),癌组织中p-PI3K的阳性染色结果28例(70%),癌旁组织9例(22.5%);癌组织中p-Akt的阳性染色结果27例(67.5%),癌旁组织7例(17.5%);通过卡方检验进行分析,发现二者在癌及癌旁组织中存在统计学差异(χ2=18.15,P<0.05,χ2=20.46,P<0.05)。
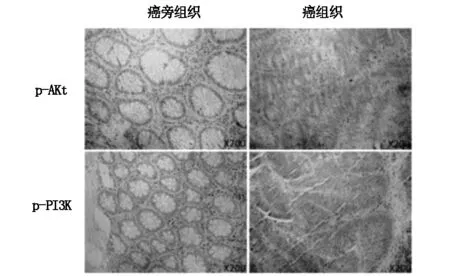
图2 免疫组化法检测组织中p-PI3k、p-Akt的表达(×200)
Wesern blot定量分析蛋白p-PI3K及p-Akt表达水平,实验结果同样显示,在癌组织中,p-PI3K及p-Akt蛋白表达水平升高(P<0.05)(图3)。
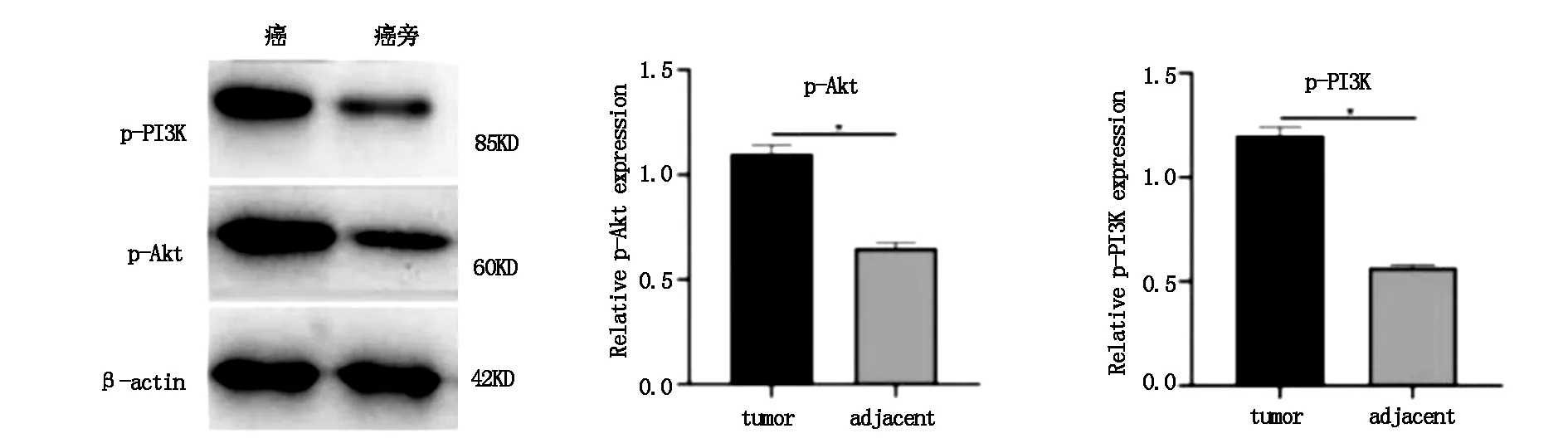
图3 Western blot检测组织中p-Akt、p-PI3k的表达(P<0.05)
2.3 结肠癌患者LncRNA MALAT1的表达与p-PI3K及p-Akt的关系
将p-PI3K、p-Akt表达结果与LncRNA MALAT1的表达情况进行卡方检验分析,其中LncRNA MALAT1表达水平高于平均值作为高表达的例数,结果显示二者之间有明显相关性(P<0.05)(表2)。
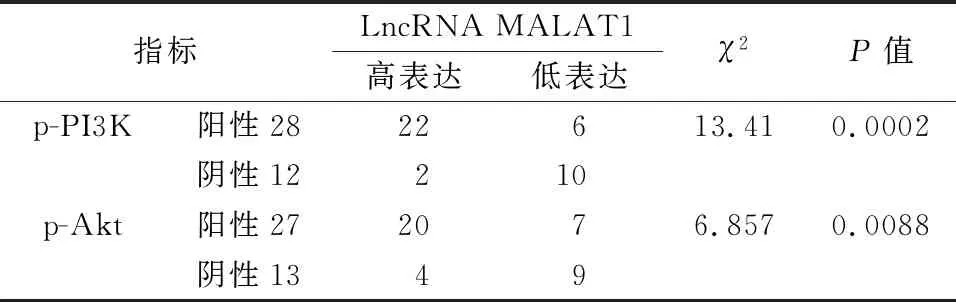
表2 LncRNA MALAT1与p-PI3K、p-Akt的关系
2.4 下调细胞中LncRNA MALAT1对p-PI3K、p-Akt表达的影响
通过转染siRNA至癌细胞中,转染后癌细胞中LncRNA MALAT1的表达水平明显下降(图4a),对si-MALAT1及si-NC组细胞中的p-PI3K、p-Akt的表达水平进行检测,结果发现,下调LncRNA MALAT1的表达,蛋白p-PI3K、p-Akt的水平也下降(P<0.05)(图4b、4c、4d)。

图4 细胞转染及Western blot检测转染后细胞中p-PI3K、p-Akt的表达(P<0.05)
2.5 下调LncRNA MALAT1的表达对结肠癌细胞增殖、迁移的影响
CCK-8实验检测si-MALAT1与si-NC组细胞增殖情况如图5a,72 h时,si-MALAT1(1.451±0.112)细胞的OD值较si-NC(2.019±0.131)组降低(t=8.405,P<0.05)。Transwell实验结果发现,si-MALAT1组细胞迁移数较si-NC组细胞迁移数减少(图5b、5c、5d)(P<0.05)。
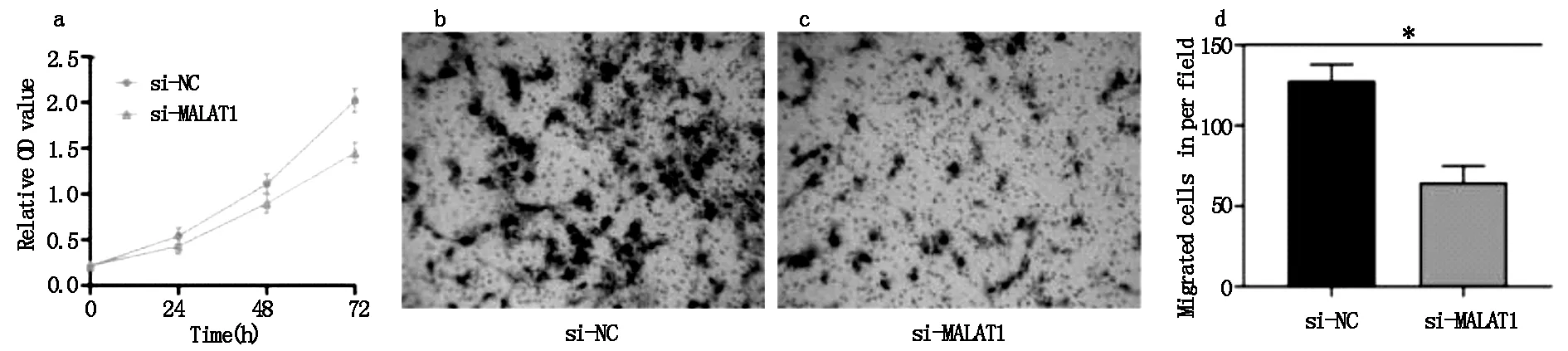
图5 细胞增殖曲线及细胞迁移实验检测细胞增殖、迁移能力(×200)(P<0.05)
2.6 下调LncRNA MALAT1对细胞集落形成能力的影响
结果显示:si-MALAT1组14.9%较si-NC组27.2%细胞集落形成率下降(P<0.05)(图6a、6b、6c)。

图6 细胞集落实验检测集落形成能力(P<0.05)
3 讨论
结肠癌在全球恶性肿瘤中的发病率持续上升,其转移率高,虽然对肿瘤基因的研究越来越深入,但机制复杂,尚不明确[12],治疗方式以手术切除为主,然而术后转移复发仍十分常见,有研究表明新辅助放化疗和肠系膜切除联合治疗可使局部复发率降低到10%以下,但并没有显著延长患者的生存期[13-15]。近年来,非编码基因在肿瘤相关研究中进展迅速,许多研究发现LncRNA与肿瘤的关系十分密切,可以通过影响基因转录、蛋白表达等过程参与肿瘤的进展[16]。LncRNA MALAT1作为一种新的LncRNA在2003年肺癌的相关研究中被发现[17],随后在其他恶性肿瘤的研究中发现其参与并影响肿瘤的进程,在膀胱、乳腺等恶性肿瘤中均有报道,LncRNA MALAT1促进了恶性肿瘤的进展过程,尤其与肿瘤转移及复发密切相关[18]。
本研究的结果显示,在结肠癌中,癌旁组织LncRNA MALAT1的表达量较癌组织中的表达降低;转染si-RNA后,肿瘤细胞中LncRNA MALAT1的表达下降,细胞的增殖、迁移、集落形成等能力明显减弱。该结果与LncRNA MALAT1最初在肺癌的相关研究中结果一致[19],而导致该结果的发生可能与LncRNA与其他基因相互作用有关。研究表明LncRNA MALAT1可以作用多种微小RNA来促进其恶性行为,有学者发现,在肝癌中LncRNA MALAT1可以通过抑制miR-140基因,使血管生成因子A增加;另有研究显示LncRNA MALAT1与miR-202存在相互结合位点,LncRNA MALAT1表达抑制了miR-202导致骨肉瘤肺转移能力增强;LncRNA MALAT1还能与miR-485-3p相互作用,解除对c-MET和Akt3/mTOR信号的抑制,下调LncRNA MALAT1或过表达miR-485-3p可抑制肿瘤生长和体内肺转移[20-21],以上均表明LncRNA MALAT1表达增高可以作用于其他的基因来行使功能。此外在胰管腺癌研究中发现LncRNA MALAT1敲除后,抑制miR-217的表达,而KRAS蛋白是其明确的作用靶点,最终影响KRAS蛋白的表达,影响了肿瘤转移侵袭过程[22]。本研究得到LncRNA MALAT1对结肠癌的恶性行为起到了促进作用结果,可能与LncRNA MALAT1表达增高,影响某些微小RNA的表达,导致肿瘤相关编码基因表达发生变化,促进肿瘤的发生。
本研究对PI3K/Akt通路中活化的关键蛋白进行检测发现,癌组织中LncRNA MALAT1表达高,p-PI3K和p-Akt的含量升高,下调细胞中LncRNA MALAT1表达,p-PI3K、p-Akt蛋白的表达量随之下降。肿瘤中的PI3K/Akt通路是一条证实参与肿瘤发生的传导通路,参与细胞周期的各个阶段,在细胞增殖和凋亡过程中起着不可替代的作用。研究发现PI3K、Akt总量相对恒定,其发挥作用取决于关键蛋白的活化情况,PI3K可被相应受体激活,如RAS蛋白、酪氨酸激酶受体等,活化后的PI3K可使下游分子Akt活化为p-Akt,进而作用于下游分子,影响细胞周期,促进细胞有丝分裂过程[23-25]。在肿瘤细胞中,该通路异常活化,可导致细胞出现异常增殖、细胞凋亡,促进新生血管形成,进而引发肿瘤细胞分化及远处转移等恶性行为[26]。LncRNA MALAT1可以通过PI3K/Akt途径调节细胞凋亡,影响肿瘤对化疗药物的耐药性[27];在骨肉瘤中PI3K/Akt信号通路可以被LncRNA MALAT1激活,从而使肿瘤发生了远处转移[28]。而结肠癌中LncRNA MALAT1与PI3K/Akt通路的关系尚未明确。根据既往研究及本实验结果,认为在结肠癌中,LncRNA MALAT1与PI3K/Akt通路存在一种正向的相关性,影响了肿瘤的进展。
综合以上结果,LncRNA MALAT1在结肠癌中的表达上调,促进了肿瘤的增殖、迁移;并且与PI3K/Akt通路存在着一种正相关性。

