21 ℃海水浸泡对失血休克大鼠主要器官功能的影响
邓皓月,朱 娱,吴 跃,李清晖,田昆仑,刘良明,李 涛
400042重庆,陆军特色医学中心战伤休克与输血研究室,创伤、烧伤与复合伤国家重点实验室
随着全球经济的飞速发展,海上交通愈发频繁,与此同时国际海难统计数据指出全世界每年发生近万次海难[1]。由于海水具有低温、高渗、富含特殊致病微生物等特点,创伤合并海水浸泡的死亡率较陆地伤高出几倍甚至十几倍[2]。海上事故的预防与救援日益受到重视,研究失血休克合并低温海水浸泡的病理生理特点对进一步研究制定海战伤早期救治措施具有重要意义。
创伤失血、休克所致死亡占创伤早期死亡的30%~40%,而多器官功能障碍(multi organ dysfunction syndrome,MODS)是创伤失血休克最严重的并发症,居ICU患者死因首位[3-4]。既往海水浸泡联合失血休克的研究主要集中在基础生命体征(如呼吸、心率、体温及肌颤变化)[5]、血浆蛋白质组(如肺表面相关蛋白A、丝氨酸蛋白酶抑制剂A3K)[1]等指标,对器官功能、组织代谢及内环境稳态的影响研究较少。近40年来,我国渤海、黄海、东海等海域表层海水温度呈缓慢上升趋势[6],全年平均海水表层温度为18.9~21.5 ℃[7]。据此,本研究以21 ℃海水浸泡合并40%失血休克大鼠为模型,观察21℃海水对失血休克大鼠存活、器官功能、组织代谢及内环境稳态的影响,探索海战伤落水伤员的病理生理变化特点,为制定急救方案提供科学证据。
1 材料与方法
1.1 试剂和耗材
戊巴比妥钠购自美国Sigma公司,肝素钠购自中国海普瑞药业有限公司,氯化钠注射液购自中国山东金洋药业有限公司,青霉素和硫酸链霉素购自中国河北远征药业有限公司,Na+/K+-ATP酶试剂盒购自中国南京建成生物工程研究所,注射器购自中国山东威高集团,真空采血管购自中国康卫仕医疗器械有限公司。
1.2 实验动物
12~14周龄健康SD大鼠128只,雄性,体质量为200~220 g,由陆军特色医学中心实验动物中心提供。实验动物在照明周期为12 h/d的标准明暗条件下饲养,动物房室温设定为26 ℃,给予标准化饲料和饮用纯净水,实验前禁食过夜,自由饮水。实验方案经过陆军军医大学实验动物福利伦理审查委员会批准。
1.3 实验方法
1.3.1 人工海水配置 采用国家海洋局第三研究所的配方,主要指标包括:渗透压(1250.00±11.52)mmol/L,钠离子浓度(630.00±5.33)mmol/L,钾离子浓度(10.88±0.68)mmol/L,氯离子浓度(658.80±5.25)mmol/L,海盐浓度2.54%,pH=8.20,海水温度21 ℃。
1.3.2 实验方案及模型制备 根据计算机随机分组法将大鼠分为4组(n=32):正常对照组(对照组)、40%失血休克组(休克组)、正常大鼠21℃海水浸泡组(海水组)及40%失血休克合并21 ℃海水浸泡组(休克+海水组)。实验分3批完成,第1批实验(n=16)用于观察各组大鼠72 h存活情况,第2批实验(n=8)用于检测器官功能指标,第3批实验(n=8)用于检测生化及组织代谢指标。利用3%戊巴比妥钠腹腔麻醉(45 mg/kg)SD大鼠,待大鼠肌张力消失后进行固定,行右颈动脉插管,后经三通管连接注射器与水银血压计,以监测平均动脉压与放血,同侧颈总动脉放置温度探头测定核心体温。待大鼠稳定10 min后,将其垂直浸泡于21 ℃海水中,腋窝以上露出水面,使其保持正常呼吸。对照组仅做插管处理;休克组仅进行40%控制性失血处理;海水组仅进行插管和海水浸泡处理;休克+海水组自大鼠入水起开始放血,1 h内放至全身血量的40%,持续在海水中浸泡2 h,取出后进行指标检测。
1.4 观察指标
1.4.1 存活情况 建模成功后,结扎颈动脉并缝合肌肉层、皮肤层,于休克前及放血后肌肉注射(10万U/kg)青霉素、硫酸链霉素,放回笼中自由进食饮水,并记录大鼠72 h内的存活时间。
1.4.2 器官功能指标 对照组和休克组在建模起2 h后,海水组和休克+海水组在浸泡末分别抽取5 mL动脉血检测心脏功能[肌钙蛋白T(cardiac troponin T,cTnT)]、肝脏功能[谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)]、肾脏功能[血尿素(blood urea nitrogen,BUN)、血肌酐(serum creatinine,SCr)]。
1.4.3 生化指标 对照组和休克组在建模起2 h后,海水组和休克+海水组在浸泡末分别抽取3 mL动脉血送陆军特色医学中心检验科检测生化指标[血浆渗透压(plasma osmolality,OSM)、Na+、K+、Cl-]。
1.4.4 组织代谢指标 各组完成生化指标检测血样采集后分别取肺与脑组织称量其湿质量,利用电热恒温鼓风干燥箱(DHG-9070)60℃烘烤24 h至恒量,采用干湿质量法测定组织的含水量;将肺与脑组织分别与9倍体积生理盐水混合后冰水浴下机械匀浆,离心后取上清液,再以生理盐水稀释10倍,后根据Na+/K+-ATP酶试剂盒操作步骤进行酶促反应和定磷,最终通过公式计算组织的Na+/K+-ATP酶活力单位。
1.5 统计学分析
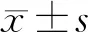
2 结果
2.1 21 ℃海水浸泡对失血休克大鼠生存情况的影响
统计发现休克组大鼠的72 h存活率为50.00%,中位存活时间为53.48 h;21 ℃海水浸泡可致正常大鼠死亡,72 h存活率为68.75%;而21 ℃海水浸泡可显著加速40%失血休克大鼠的死亡,72 h存活率降至18.75%,中位存活时间缩至10.50 h,与休克组比较有统计学差异(P<0.05,图1A、B)。
a:P<0.05,与对照组比较;b:P<0.05,与休克组比较;c:P<0.05,与海水组比较
2.2 21 ℃海水浸泡对失血休克大鼠主要器官功能的影响
2.2.1 心脏功能 与正常组比较,休克组大鼠cTnT显著升高至(1.85±0.91)μg/L(P<0.05,图2A);21 ℃海水浸泡后cTnT显著升高至(1.39±0.34)μg/L(P<0.05,图2A);而21 ℃海水浸泡进一步加剧40%失血休克大鼠cTnT的升高,达(7.25±0.66)μg/L,与休克组比较差异有统计学意义(P<0.05,图2A)。
2.2.2 肝脏功能 休克组大鼠ALT、AST较对照组分别升高104.19%、188.17%,升至(75.00±7.85)、(298.95±24.48)U/L(P<0.05,图2B、C);海水组ALT、AST较对照组分别升高82.38%、148.12%,升至(66.99±5.62)、(257.40±36.85)U/L(P<0.05,图2B、C);21 ℃海水浸泡进一步升高40%失血休克大鼠ALT、AST升至(118.60±13.29)、(455.95±46.76)U/L,差异具有统计学意义(P<0.05,图2B、C)。
2.2.3 肾脏功能 休克组大鼠BUN、SCr较对照组分别升高104.19%、188.17%,升至(11.89±1.74)、(43.48±4.81)μmol/L(P<0.05,图2D、E);海水组BUN、SCr较对照组分别升高82.38%、148.12%,升至(9.87±1.20)、(39.03±3.35)μmol/L(P<0.05,图2D、E);21 ℃海水浸泡进一步升高40%失血休克大鼠BUN、SCr,升至(19.74±2.12)、(56.73±4.08)μmol/L,与休克组比较具有统计学差异(P<0.05,图2D、E)。
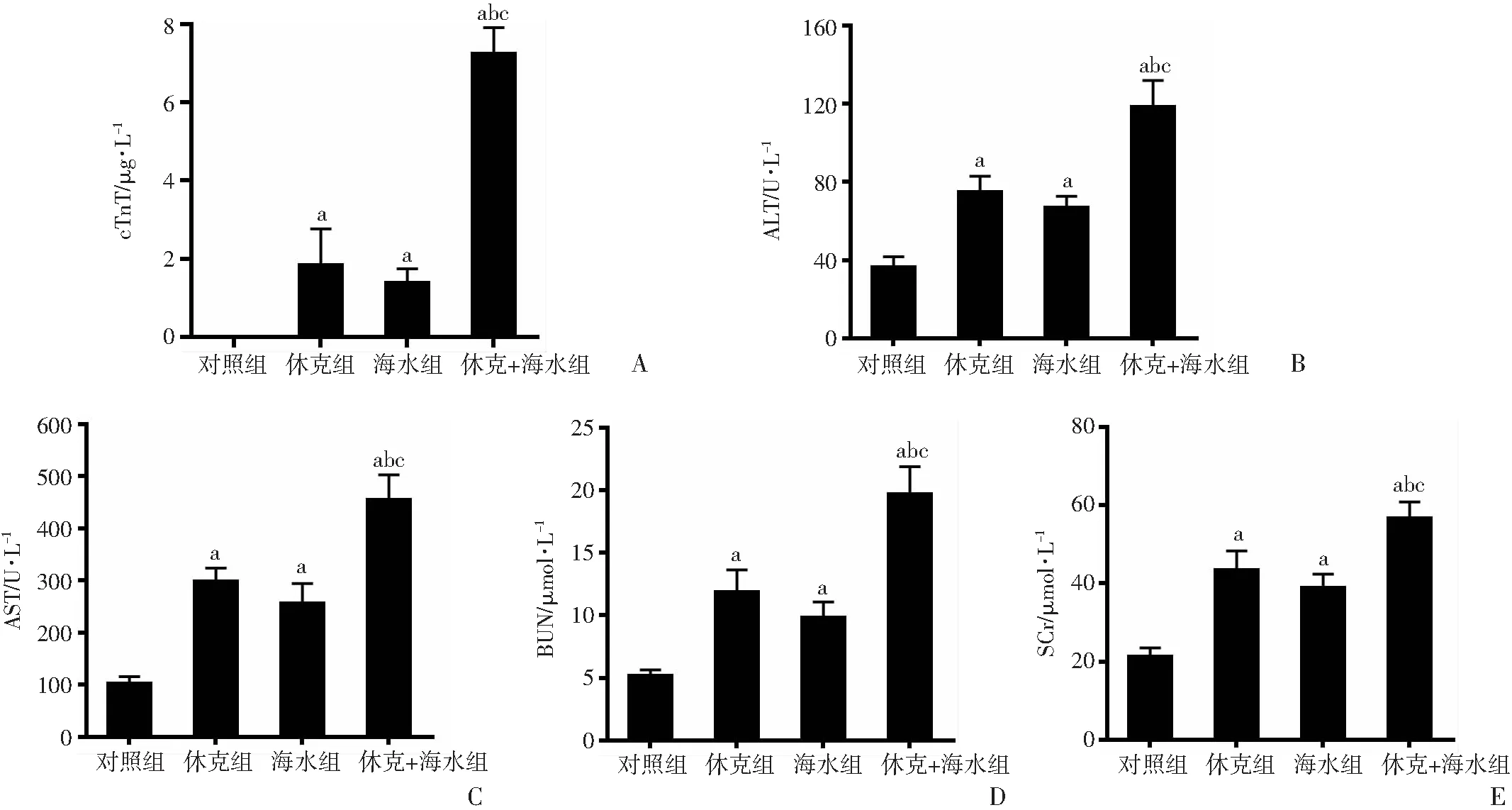
a:P<0.05,与对照组比较;b:P<0.05,与休克组比较;c:P<0.05,与海水组比较A:心脏功能;B、C:肝脏功能;D、E:肾脏功能
2.3 21 ℃海水浸泡对失血休克大鼠组织代谢的影响
2.3.1 肺脑含水量 休克组和海水组大鼠肺脑含水量与对照组比呈上升趋势,而21 ℃海水浸泡显著增加失血休克大鼠肺脑含水量,分别增至(79.38±0.85)%、(79.19±0.77)%,与休克组比较有统计学差异(P<0.05,表1)。
2.3.2 肺脑Na+/K+-ATP酶活性 休克组和海水组大鼠肺脑Na+/K+-ATP酶活性均较对照组显著降低(P<0.05,表1),而21 ℃海水浸泡使失血休克大鼠肺脑Na+/K+-ATP酶活性进一步降低,降至(3.81±0.30)、(7.17±0.51)U/mg,与休克组比较具有统计学差异(P<0.05,表1)。
表1 大鼠血浆组织代谢指标变化情况
2.4 21 ℃海水浸泡对失血休克大鼠内环境的影响
休克组和海水组大鼠血浆OSM、Na+、K+和Cl-均较对照组高,21 ℃海水浸泡进一步升高失血休克大鼠上述指标,分别升至(301.13±1.19)、(142.20±0.63)、(5.10±0.17)、(114.84±0.98)mmol/L,与休克组比较具有统计学差异(表2,P<0.05)。

表2 大鼠血浆生化指标变化情况
3 讨论
创伤失血休克后,全身循环血量急剧减少,组织缺血缺氧,进而引发MODS,这一系列的病理生理变化大大增加了创伤失血休克的死亡率。既往研究指出,海水浸泡可引发机体核心体温降低、酸中毒及凝血功能障碍,对机体造成极大的危害[8]。而海上作业与远海作战中,落水伤员遭受创伤与海水浸泡的双重打击,加之海水具有高渗、富含特殊致病微生物等特点,创伤合并海水浸泡的死亡率远高于陆地伤[2,9-10]。本研究以40%失血休克大鼠合并21 ℃海水浸泡为模型,发现21 ℃海水浸泡可明显加剧失血休克大鼠的内环境紊乱、组织代谢障碍、MODS并显著增加死亡率。
本研究采用失血休克合并海水浸泡模型,一方面,由于40%失血休克导致机体循环血量锐减,组织器官灌注不足缺血缺氧导致Na+/K+-ATP酶活性降低,ATP生成不足,细胞膜上Na+、K+的转运障碍,使细胞外K+不易进入细胞内,从而导致血浆K+升高,OSM增加[11]。另一方面,海水属于高渗、强碱性液体,渗透压是人体血浆渗透压的4.3倍[2,8],海水浸泡可引起高渗性脱水,导致血液浓缩,失血休克合并海水浸泡后进一步引起机体OSM、Na+、K+和Cl-升高;此外海水较体温低,长时间浸泡可导致血管通透性增加,使血浆进入第三间隙引发组织水肿,同时引发低温性利尿,血液浓缩,使血浆黏滞度增加[12],影响血液携氧能力,进一步加重失血休克引发的内环境失衡、组织缺血缺氧及代谢障碍,包括Na+/K+-ATP酶活性降低,最终对机体多脏器功能造成严重损伤,进而对机体产生致命危害[13-15]。
本研究发现失血休克大鼠存在多器官功能受损,而失血休克大鼠合并21 ℃海水浸泡后心、肝、肾功能明显损害,较单纯休克大鼠器官功能损伤程度明显加重,这可能与低温及海水两方面的因素有关。机体40%失血休克后,循环总量减少,加上低温海水浸泡促进血管收缩及心输出量减少,机体血容量不足以满足全身脏器需求。因休克时血液优先供应脑、心脏等重要脏器,肾脏因灌注不足而功能受损[15-16],与本研究中BUN、SCr指标升高相符。同时,低温刺激引发肝代谢率降低、肝功能合成酶的活性改变,最终致使肝功能受损[16],即AST和ALT明显升高。当机体后期无法代偿,出现心肌收缩力、心输出量、心率及血压降低,进入缺血缺氧的恶性循环,出现心脏功能受损,最终导致多器官功能障碍[8]。
本实验结果发现,21 ℃海水浸泡可通过加剧40%失血休克大鼠内环境紊乱及组织代谢障碍,导致多器官功能损伤加重,促使死亡率升高。因此,针对海水浸泡战创伤伤员,尽早给予有效的复温,纠正电解质紊乱、酸碱平衡及调节渗透压的补液方式,同时增加保护器官功能等针对性措施可能有效降低死亡率。目前,对于失血休克合并海水浸泡患者早期救治方案的研究甚少,我们将在本实验病理生理学变化特点研究基础上,进一步研究针对性的防治措施研究。

