面向肺功能检测的便携式电阻抗成像系统开发
李芳,方海东,吴阳,高贵锋,刘凯,姚佳烽
(1. 南京航空航天大学 机电学院,江苏 南京 210016;2. 三江学院 机械与电气工程学院,江苏 南京 210012;3. 深圳市安保科技有限公司,广东 深圳 518052)
0 引言
近年来,受肺部疾病影响的人数日益增加。新型冠状病毒肺炎是一种具有严重传染性的疾病,常伴有发热、咳嗽、乏力、呼吸困难等临床表现,近期在全球范围内流行[1]。急性呼吸窘迫综合征是一种潜在的致命性肺损伤,死亡率高达75%以上[2]。慢性阻塞性肺疾病是一种具有气流受限特征的长期反复性疾病,具有患病人数多、死亡率高、社会经济负担重等特点,高居全球死亡原因的第四位[3]。而肺功能检测能及时发现肺部的变化,因此,肺功能检测对肺部疾病的诊断是必需的。
X光、CT、超声等传统成像手段虽能满足临床疾病诊断和评估的需要,但会对患者造成一定的伤害,而且无法做到实时监测,因此迫切需要一种便携、无创、实时、无辐射的功能成像方法,对肺功能进行动态监测与评估,这对及时掌握患者的肺部状况,调整呼吸康复方案具有重要的临床意义。电阻抗成像技术(electrical impedance tomography, EIT)具有非侵入、无害、低成本等优点[4],能够配合其他影像学成像技术检测肺功能的变化,很好地满足了上述需求。
国内外研究者针对肺功能检测开发了不同的EIT系统。韩国首尔大学的AKHTARI-ZAVARE M等提出了一种可穿戴式的实时三维肺通气监测电阻抗成像系统,能够实现无线通信[5]。英国密德萨斯大学的BARDILL A等提出的穿戴式电阻抗成像系统,可同时进行肺功能和心率监测[6]。天津科技大学的陈晓艳等设计了一种能获得清晰的肺呼吸过程图像的电阻抗成像系统[7]。上海交通大学的WANG G X等提出一种基于频分复用的电阻抗实时肺生理成像系统[8]。
上述EIT系统具有较高信噪比和成像速度,但人机交互部分和成像算法依赖PC平台,设备体积大、操作复杂、功能冗余,限制了EIT系统在临床、家庭健康监测等需要便携式设备领域的发展。随着嵌入式技术飞速发展,ARM系列处理器的运算速度已经与Intel媲美且具有丰富的外设接口。本文采用ARM+FPGA双核架构,在ARM上运行嵌入式Linux系统,能在嵌入式系统上直接实现图像重构算法,并通过LCD触摸屏实现人机交互功能。
1 系统设计
1.1 系统硬件设计
本文提出的便携式电阻抗成像系统框架如图1所示,主要由4个模块组成:ARM+FPGA最小系统、信号激励电路、末端传感器连接电路和信号采集电路。本系统首先由FPGA读取存储在ROM中的离散正弦数据,并通过DDS信号发生模块传输到高速DAC芯片,接着通过采样电阻将DAC输出的电流信号转化为电压信号。该电压信号经过增益可调的运放放大后,可以选择两种不同的激励方式。电流激励是将该电压信号作为电压控制恒流源的输入,输出的电流信号通过模拟多路复用电路传输到16电极传感器阵列,注入到场域中。电压激励则直接作用。采集测得的信号先经过电压跟随器进行缓冲,再经过抗混叠滤波器滤除高频噪声以减少信号混叠,接着通过ADC驱动电路的ADC芯片进行高速采集,完成模数转换。采集到的离散信号经快速傅里叶变换[9](fast fourier transformation, FFT),获取幅值数据,通过SPI串行通信协议传入ARM中的Linux系统进行图像重构,实现一体化的EIT成像系统。
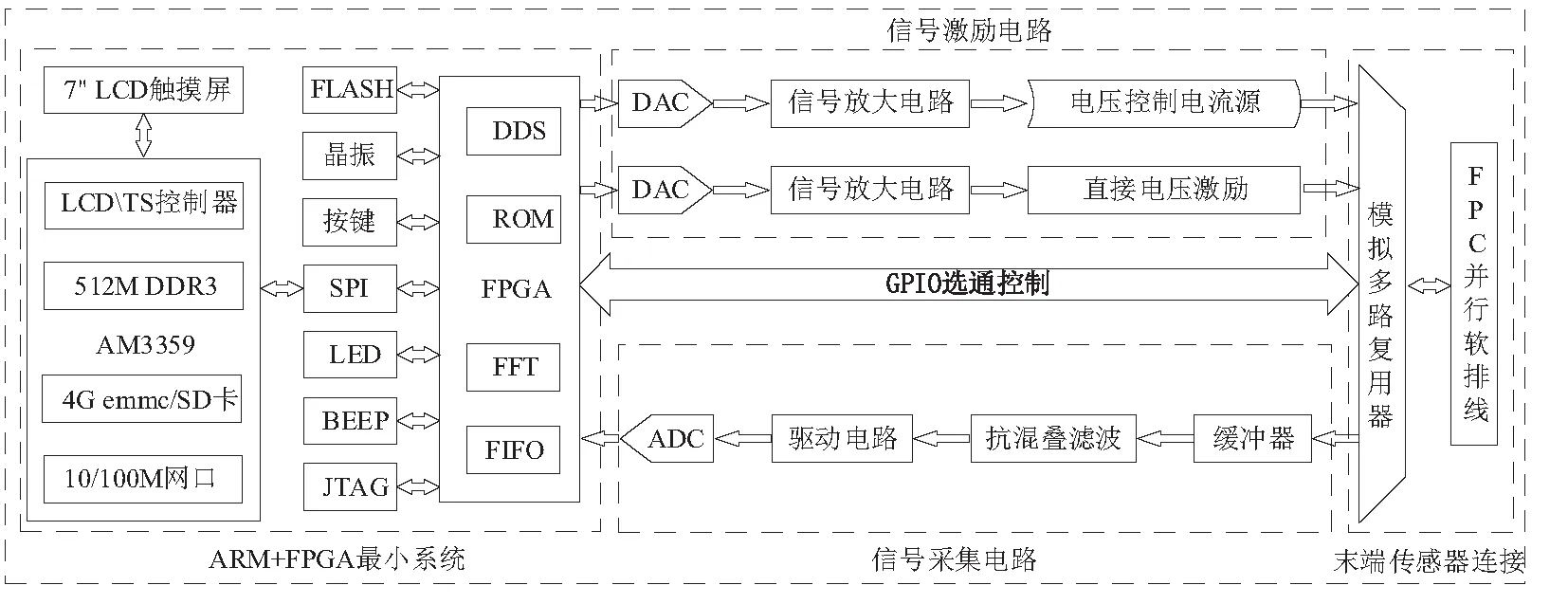
图1 EIT系统硬件框架
1.2 系统软件设计
本文提出的便携式电阻抗成像系统的软件设计基于FPGA和ARM双核进行,主要可分为两大部分。其中,FPGA驱动程序主要实现对底层外围器件的逻辑控制和部分数据处理;ARM端则主要实现系统通信接口设计和界面程序设计,侧重于脱离PC平台的人机交互。软件模块的整体框架如图2所示。
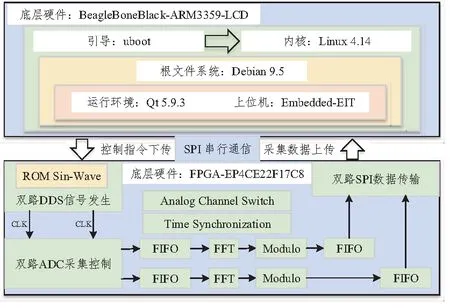
图2 EIT系统软件框架
1.3 图像重构算法
本文采用的图像重构算法是Tikhonov-Noser组合正则化(NR Tikhonov-Noser)算法[10]。该组合正则化方程如式(1)所示。
(1)
式中:J是正问题求解得到的雅可比矩阵;I是单位矩阵;λN是Noser算法的正则化参数;λT是Tikhonov算法的正则化参数;p是根据测量电压计算得到的投影向量。该非迭代的图像重构算法具有准确的计算结果、优越的抗噪声能力和较小的计算量,适合应用在本文设计的电阻抗成像系统中。
2 实验分析
本文开发的便携式电阻抗成像系统实物图如图3所示。该系统在空间上可分为三层,顶层为LCD触摸屏,中间层为基于FPGA的外围电路,底层为插接的Beagle Bone Black最小系统板。本节主要针对该系统进行性能分析和图像重建实验。

图3 便携式电阻抗成像系统实验平台
2.1 性能分析
1)通道一致性测试
采用图4所示标定板进行通道一致性测试。该标定板使用电阻网络来模拟场域内的阻抗分布,电阻均采用0.1%精度的低温漂电阻。
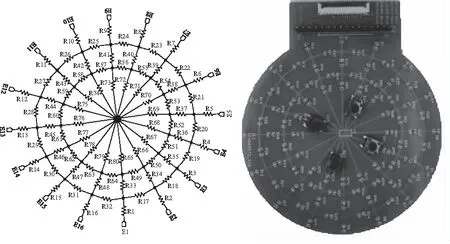
图4 系统标定板电路原理图及PCB板
将该标定板通过FPC软排线接入到EIT系统中。实验过程控制电压为2 Vpp,频率为100 kHz,重复测量20次,得到的U型图如图5(a)所示。
每次测量的208个数据所组成的16个U型曲线基本保持一致,说明该系统的通道一致性较好。
2)重复性和信噪比测试
为量化系统的重复性,引入相对标准差(RSD)表征系统的重复性,按式(2)给出的方法计算[11]。
(2)
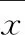
信噪比(SNR)是系统中信号功率与噪声功率的比值,也是EIT系统的常用性能指标,按式(3)计算。
(3)
计算结果如图5(c)所示。可以看出:不同通道的信噪比存在一定差异,整体的信噪比集中在60 dB附近,最小值也>45 dB,最大值接近70 dB。
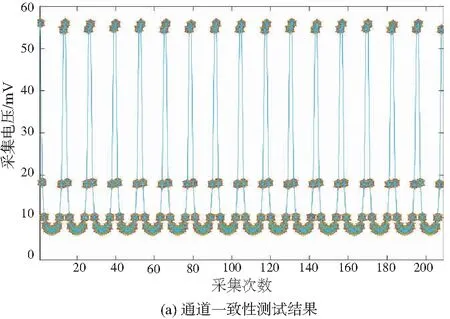
图5 系统性能分析结果图
2.2 实验测试
1)水槽成像实验
采用直径为100 mm的圆形水槽和直径为25 mm的橡胶棒进行水槽成像实验。为了模拟生物组织,采用香蕉泥作为背景电介质。实验过程中正弦激励电流的控制电压为2 Vpp,选取在频率为1 kHz、10 kHz、100 kHz、500 kHz、1 MHz和1.5 MHz的条件下进行实验。首先在仅放香蕉泥时收集参考数据,然后再放入橡胶棒分别进行单目标和双目标实验。使用TK组合正则化算法进行成像,选取传统TK的惩罚项kt值为0.000 01,Noser项系数kn值为90,结果如图6所示(0:电导率低;1:电导率高)。单目标实验的成像结果在最低频率时有非常理想的效果,而随着频率的增大,橡胶棒开始逐渐变形,在1 MHz以上时橡胶棒已经趋向于椭圆形。同时随着频率的升高,背景香蕉泥的电导率逐渐变大,颜色变为深红色。双目标实验在1 kHz~500 kHz之间成像结果差异不大,在1 MHz以上时,橡胶棒同样出现变形。
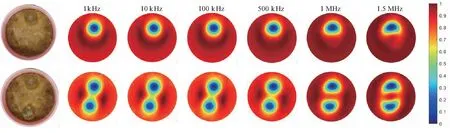
图6 不同频率下单目标和双目标水槽实验成像图
为了量化EIT图像重构的质量,更好地反映成像质量好坏,引入图像误差IME和图像相关系数ICC进行评价[12],如式(4)和式(5)所示。
(4)
(5)
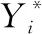
分别计算不同频率下的单目标和双目标水槽实验成像图对应的图像误差和图像相关系数,结果如表1所示。单目标实验IME最小为1.10,ICC最大为0.86。双目标实验IME最小为1.00,ICC最大为0.84。整体上在带宽范围内,所有目标物均能达到较好的成像效果。
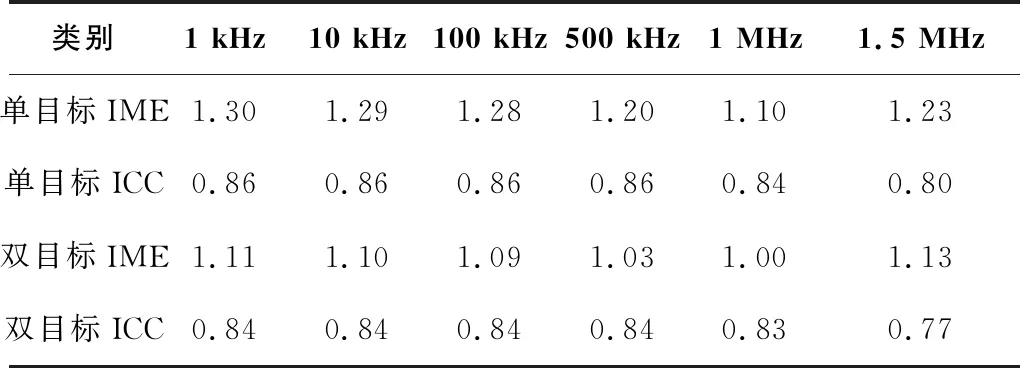
表1 图像误差和图像相关系数结果
2)人体肺呼吸成像实验
对22岁健康男性志愿者进行人体肺呼吸成像实验。使用16电极柔性带作为实验末端传感器,如图7所示。将长40 mm、宽20 mm的矩形扣式医用电极片通过按扣固定在柔性带上,保证16电极之间间距均匀。顺时针沿着保持坐姿的待测志愿者的第4-第5肋骨间水平粘贴预先处理好的柔性带。粘贴之前需要使用医用酒精擦拭皮肤与电极接触位置,并在每个电极上均匀涂抹导电膏,以提高接触性,保证信号采集质量。

图7 柔性带示意图和实验图
实验过程中采用幅值为1 mA、频率为100 kHz的正弦激励电流进行相邻激励、相邻测量,选择呼气末状态作为参考,测量连续呼吸过程。使用TK组合正则化算法进行成像实验,结果如图8所示(0:电导率低;1:电导率高)。该图反映了一个完整的呼吸过程,先吸气后呼气,吸气时肺部轮廓范围内的颜色逐渐加深,而呼气时颜色又重新变浅。这说明该EIT系统能够实时清晰地监测到人体呼吸过程肺部面积从小到大再变小的过程,也反映出呼吸过程中肺部阻抗的动态变化,如图9所示。吸气时,随着肺部吸入气体的增加,肺部阻抗值增大;而呼气时,随着肺部气体的减少,肺部阻抗值又重新减小(本刊黑白印刷,相关疑问可咨询作者)。
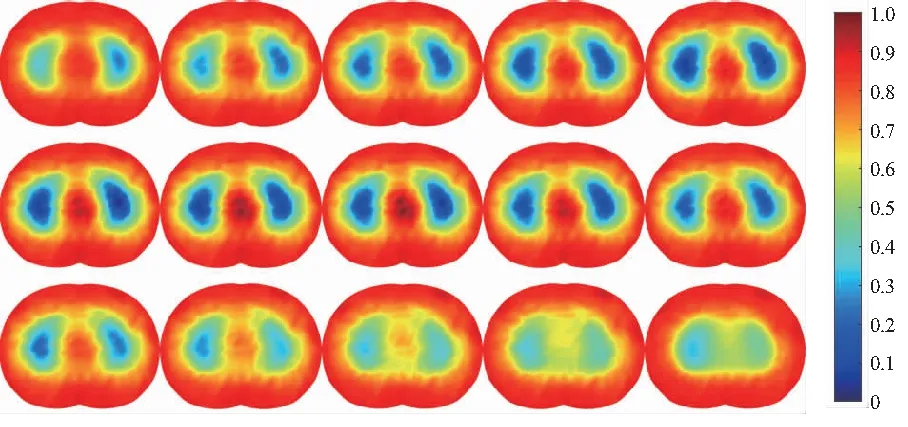
图8 呼吸过程肺成像结果图
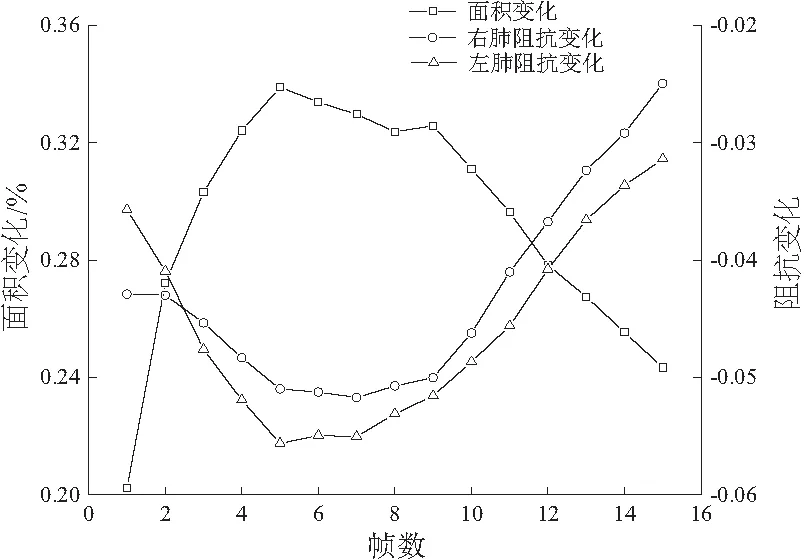
图9 肺部面积与阻抗对应关系图
3 结语
本文设计了一款面向肺功能检测的便携式电阻抗成像系统,摆脱了PC平台的限制,采用ARM和FPGA双核架构进行设计,能够在LCD触摸屏动态显示成像结果,并进行人机交互。对系统硬件和软件部分进行设计。使用标定板进行性能分析,证明该系统的通道一致性和重复性较好,整体的信噪比在60 dB左右。在水槽中分别进行单目标与多目标成像实验,计算得到图像误差最小分别为1.10和1.00,图像相关系数最大分别为0.86和0.84;人体肺呼吸成像实验的结果表明:该系统能够实时监测到人体呼吸过程肺部面积的变化,实现动态成像。

