包块型剖宫产瘢痕妊娠的临床特点分析
张红霞 张 坤
(北京大学第三医院妇产科,北京 100191)
剖宫产瘢痕妊娠(cesarean scar pregnancy,CSP)指受精卵着床于剖宫产切口瘢痕处,是少见的异位妊娠。包块型CSP是Ⅲ型CSP的一种特殊类型,声像图特点是子宫下段瘢痕处可见混合回声包块,多为CSP流产后瘢痕处妊娠物残留并出血所致[1]。CSP残留妊娠组织长期反复出血、组织机化,与子宫峡部肌层分界不清,且剖宫产瘢痕部位肌层薄弱,再次手术难度增加。关于包块型CSP诊治的报道较少。本文回顾性分析我院2010年1月~2020年12月28例包块型CSP的临床资料,探讨包块型CSP的临床特点及治疗方法,为临床处理提供参考。
1 临床资料与方法
1.1 一般资料
本组28例,年龄22~45岁,(33.1±5.3)岁。孕次2~7次,(3.9±1.7)次;流产次数1~3次,(2.3±1.2)次。剖宫产1次22例,2次5例,3次1例;距离上次剖宫产时间7个月~17年,中位数5年,其中哺乳期3例。
初次诊治情况:停经35~84 d,中位数46 d。术前诊断宫内早孕17例,外院人流或清宫14例,药流3例,均诉见绒毛;术前诊断CSP行清宫11例(我院5例),均见绒毛。
本次就诊情况:流产或清宫术后因阴道出血多于月经量就诊9例(其中3例失血性休克,血红蛋白最低50 g/L),反复少量阴道出血12例,术后血hCG下降缓慢或下降后又升高7例。急诊就诊6例,平诊22例。入院时距上次手术时间1~120 d,中位数21 d,其中<2周6例。
28例均行经阴道妇科超声检查;除2例因阴道出血多行急诊手术外,其余26例行盆腔MRI。超声及MRI诊断包块型CSP[1,2],包块直径14~66 mm,(35.3±14.7)mm,其中18例(64.3%)>30 mm;包块与膀胱之间子宫肌层厚度(以盆腔MRI测量为准,未做MRI者根据超声测量)1~5 mm,(1.7±1.0)mm,其中17例(60.7%)<2 mm。彩色多普勒超声提示包块周围血流信号丰富14例(4例伴血窦,其中1例伴子宫动静脉瘘),较丰富8例,不丰富4例,无血流信号2例。
血β-hCG 0.47~150 930 mIU/ml(正常值<3.1 mIU/ml),中位数3290 mIU/ml,其中2例正常,18例>1000 mIU/ml。贫血12例,其中轻度9例,中度2例,重度1例。血常规白细胞升高7例,其中1例发热,最高体温38.2 ℃,余患者白细胞及体温正常。
1.2 方法
包块型CSP诊断依据2016年中华医学会妇产科学分会计划生育学组制定的《剖宫产术后子宫瘢痕妊娠诊治专家共识》[1],治疗方案选择参考CSP治疗及术者经验。本组均手术治疗,依据病情采用联合治疗,方案如下。
1.2.1 手术方法 ①宫腔镜检查+CSP病灶电切术10例,为包块小(约30 mm以下)、包块与膀胱间子宫肌层厚的患者(本组包块直径18~49 mm,平均28.1 mm,包块与膀胱间肌层1~5 mm,平均2.4 mm)。其中1例(包块直径49 mm,包块与膀胱间子宫肌层1 mm)术前1.5 h采用明胶海绵颗粒行双侧子宫动脉栓塞术预处理;3例手术结束时宫腔镜下见创面少许渗血,予宫腔留置球囊压迫止血,球囊注入生理盐水10~15 ml,分别于术后4 h、12 h、19 h取出。②宫、腹腔镜检查+CSP病灶清除9例,为包块大(约30 mm以上)、包块与膀胱间子宫肌层菲薄的患者(本组包块直径14~64.7 mm,平均36.9 mm,包块与膀胱间子宫肌层1~3 mm,平均1.4 mm)。其中1例甲氨蝶呤预处理期间因阴道出血多采用明胶海绵颗粒行双侧子宫动脉栓塞术,2.5 h行宫、腹腔镜手术。3例因病灶周围血流信号丰富(其中2例伴血窦)术中双极电凝双侧子宫动脉上行支行子宫动脉上行支阻断,5例术中探查见瘢痕部位局部肌层菲薄、几乎穿透浆膜层,同时行子宫下段瘢痕修补术,切开局部薄弱区域,修剪上下切缘去除薄弱肌层,用可吸收线连续全层缝合一层,外包埋缝合一层。③腹腔镜检查+CSP病灶清除+瘢痕修补术4例,为包块外突明显者(包块直径15~49.6 mm,平均33.2 mm,2例包块与膀胱间子宫肌层连续性中断,1例仅剩浆膜层,1例浆膜层显示不清)。其中1例因包块内探及血窦术中行双侧动脉上行阻断术,考虑宫腔镜手术子宫穿孔机率高,故直接行腹腔镜下病灶清除+瘢痕修补术。④开腹探查+CSP病灶清除+瘢痕修补4例,为包块大且包块外突明显的患者(包块直径34.5~66 mm,平均50 mm,包块与膀胱间子宫肌层厚度1~1.5 mm,平均1.1 mm),包括3例失血性休克者。⑤腹腔镜全子宫双侧输卵管切除术1例,患者44岁,半年前剖宫产,1周前因CSP宫腔镜手术治疗,短期内多次宫腔操作史,且患者无生育要求,故行此手术。
手术具体操作方法见我院妇科团队既往发表文章[3]。
1.2.2 联合药物治疗 3例因血β-hCG高(2186、4438、15 067 mIU/ml)术前3 d使用甲氨蝶呤预处理,根据50 mg/m2体表面积计算,分别取75 mg、80 mg、80 mg单次肌内注射;1例考虑术后有少许组织残留可能,术后当日予甲氨蝶呤80 mg单次肌内注射,同时口服米非司酮50 mg一天2次,共3天辅助治疗。
2 结果
28例手术均顺利完成,术中、术后无并发症发生,手术指标见表1。5例输悬浮红细胞,术中3例,术后2例,输血量均为400 ml。术后病理除1例提示可疑胎盘结节,余均见退变或坏死的绒毛组织。
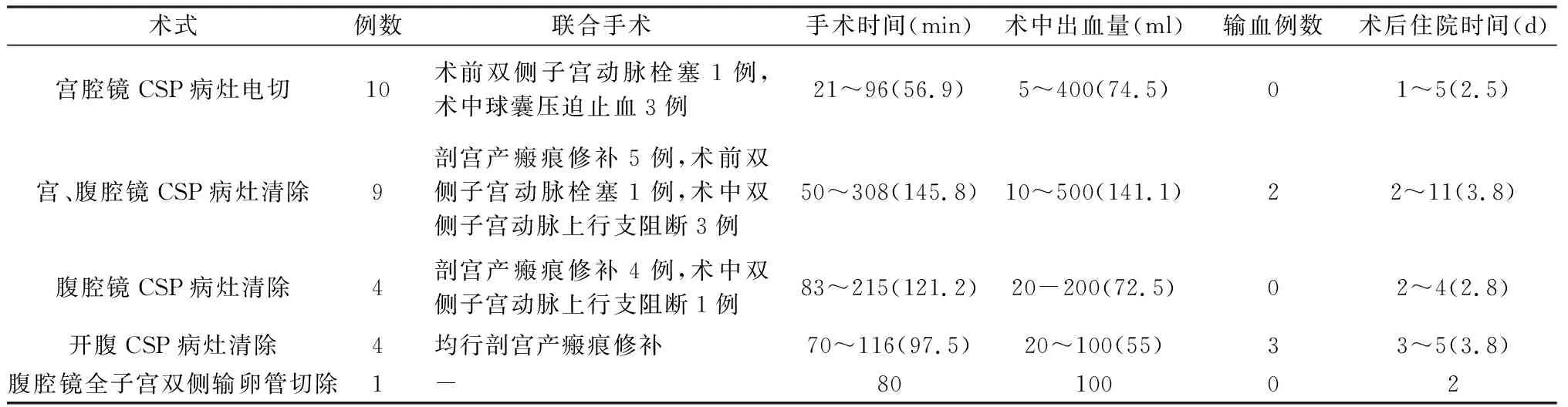
表1 28例包块型剖宫产瘢痕妊娠(CSP)的术式和手术指标
26例术前血β-hCG升高者术后每周复查,术后18~52 d(中位数26 d)降至正常范围。除全子宫切除术患者外,余27例术后21~54 d月经复潮;22例无再生育要求,5例有再生育计划,工具避孕中(均已超过术后建议避孕3~12个月),其中1例术后2年意外妊娠,宫内早孕行人工流产。
3 讨论
随着剖宫产率居高不下及全面二孩政策的开放,近年来CSP的发生率明显升高。包块型CSP是CSP流产或手术后妊娠组织物残留,2016年中国《剖宫产术后子宫瘢痕妊娠诊治专家共识》将其归为Ⅲ型的一个特殊类型,既有CSP妊娠部位特殊这一特点,又有妊娠组织物残留的临床及病理生理特点,应当引起临床医生的高度重视。
本组60.7%(17/28)患者第一次治疗错误诊断为宫内早孕。CSP位于剖宫产切口憩室处,非直视下手术易发生组织残留。Xiao等[4]报道103例CSP,手术组(包括清宫、宫腔镜、腹腔镜)妊娠组织残留发生率高达21.4%(9/42),而甲氨蝶呤+手术组为0(0/26),子宫动脉栓塞+手术组为2.9%(1/35),因此建议对于既往有剖宫产史者,再次妊娠时应首先排除CSP的可能,若诊断为CSP,应选择合适的治疗方式,避免妊娠组织残留发生。
本组主要临床症状是阴道出血,且出血时间长,贫血发生率高达42.9%(12/28),其中3例发生失血性休克,此3例均于外院误诊宫内早孕行药物流产,药流失败行清宫术,因为未诊断CSP,非超声监测或宫腔镜直视下清宫,导致CSP组织残留。第一次治疗后3例均持续少量出血,最长者持续30 d,未及时行影像学检查确诊,从而导致病情进展。阴道出血量增多具有突发性和不可预测性,即使第一次治疗后β-hCG下降至较低水平(其中1例226 mIU/ml)仍有发生失血性休克可能,因此建议人流或CSP治疗后出现阴道异常出血者,无论β-hCG下降是否满意,均应积极行超声检查,除外CSP组织残留,争取早发现、早治疗。
因为该病缺乏典型及特异的临床表现,因此辅助检查是诊断的关键。经阴道彩超是诊断的首选方法[1,5]。本组阴道超声特征是残留组织呈不均质中等回声,64.3%(18/28)包块直径>30 mm,最大者达66 mm。妊娠终止后,残留的绒毛组织表现为多血管化及血管管壁纤维化加重,超声表现为局部高回声团块或高血流信号。妊娠残留组织侵及子宫肌层,可使子宫肌层血管重建,表现为肌层血流信号增强,残留组织与肌层界限不清或消失,因此血流信号是妊娠组织残留超声诊断的要点,且血流信号越丰富,需要手术治疗的机率越高[6]。Kamaya等[7]观察到超声下残留组织物的血管分级程度与其病理所见绒毛血管形成程度成正比。包块型CSP亦存在类似情况,本组78.6%(22/28)彩色多普勒超声提示残留组织血流信号丰富或较丰富,其中4例伴血窦(包括1例伴子宫动静脉瘘),提示术中出血风险极高,因此4例中1例术前行双侧子宫动脉栓塞,2例行腹腔镜下双侧子宫动脉上行支阻断,1例因包块小(20 mm),术前血β-hCG低(88.32 mIU/ml),宫腔镜下完成手术,术前做好应对出血多的充足准备,如随时输血及中转腹腔镜等,4例术中出血20~100 ml。
包块型CSP的治疗包括药物治疗和手术治疗。单纯药物保守治疗,治疗时间长,有治疗失败的可能[8,9],且治疗期间随时可能发生严重的子宫出血,因此单纯药物治疗不作为CSP的首选方案[10]。本组1例甲氨蝶呤预处理过程中发生阴道大出血行紧急子宫动脉栓塞及手术治疗。因此,我们亦不推荐单纯药物治疗包块型CSP。药物联合手术治疗不仅能提高成功率,而且能降低并发症发生率[11]。Pan等[12]建议当妊娠囊与膀胱肌层之间肌层厚度>3 mm时,宫腔镜下妊娠组织清除作为首选治疗方案。本组10例虽然包块与膀胱之间子宫肌层平均厚度2.4 mm(其中2例1 mm,4例2 mm),但均宫腔镜下成功完成病灶清除。我们认为,除关注包块与膀胱之间子宫肌层厚度外,还需结合包块的大小,虽然子宫前壁肌层薄,但包块较小时,也可尝试行宫腔镜下病灶清除。此外,宫腔镜术中技巧亦需关注。我们在宫腔镜定位病灶后,利用电切环推刮妊娠组织,清除CSP残留病灶,避免电切导致的热损伤;若病灶向膀胱方向生长并浸润至肌层,再采用电切环电切;出血点根据子宫瘢痕处肌层的厚度选择宫腔镜下电凝止血或Folly尿管水囊注入生理盐水压迫止血,亦避免热损伤导致的并发症。对于生命体征平稳、病灶未穿透子宫浆膜层的CSP,我们[3]建议采用腹腔镜子宫动脉阻断联合宫腔镜妊娠病灶清除术,腹腔镜直视下阻断子宫动脉,宫腔镜环状电极钝性清除病灶,避免盲目刮宫引起的局部组织损伤,对于出血进行电凝止血,一旦发生子宫穿孔,可及时在腹腔镜下进行缝合修补。此方案亦适用于包块型CSP,但若高度怀疑病灶侵及浆膜层或穿透浆膜层,宫腔镜下病灶清除穿孔率高,可直接腹腔镜下病灶清除,并同行进行瘢痕修补。对于生命体征不稳定者,开腹探查便于及时止血。本组4例经腹手术中,3例有失血性休克,另1例因包块与膀胱之间肌层仅剩浆膜层,包块大(44 mm)且向右外方凸出。
总之,包块型CSP病情复杂,我们主要根据残留组织与膀胱之间的肌层厚度和残留组织大小选择治疗方案。因本组残留组织与膀胱之间的肌层厚度薄(平均1.7 mm),且包块大(平均直径35.3 mm),故治疗方案多选用联合方案,如药物或者子宫动脉栓塞、子宫动脉上行支阻断联合手术,或者宫、腹腔镜联合手术等,均手术顺利,未发生手术并发症。

