基于PI3K/Akt/mTOR途径研究芒果苷对糖尿病诱导视网膜微血管损伤的保护作用及机制*
华炳红,李馥伶,陈 琳
(1.中南大学湘雅医学院附属海口医院内分泌代谢科,海口 570203;.中南大学湘雅医学院附属海口医院药学部,海口 570203)
糖尿病视网膜病(diabetic retinopathy,DR)是糖尿病的常见并发症[1]。据估计,到2030 年全球DR 患者的数量将达到1.91 亿[2]。高血糖介导的毛细血管损伤引起视网膜缺血缺氧以及玻璃体岀血,进而发生增殖性视网膜病变,最终导致失明[1]。目前的主要治疗干预措施仍无法完全避免并发症[3]。DR 的主要病理特征为视网膜血管闭塞性循环障碍,以及内皮细胞增殖、迁移和血管形成[4],因此,抑制视网膜血管新生是治疗DR的重要手段。
芒果苷是一种双苯毗酮类黄酮类免疫调节化合物,具有抗肿瘤、抗感染、降血糖、抗氧化和免疫调节等多种药理作用[5]。研究发现,芒果苷对链脲菌素(STZ)诱导的糖尿病大鼠血液生化参数能够发挥保护作用[6]。然而,芒果苷对糖尿病高糖(HG)和缺氧环境诱导的视网膜毛细血管内皮细胞(RRCEC)损伤是否具有保护作用尚未完全清楚。因此,本研究旨在探讨芒果苷对RRCEC 细胞暴露于HG/缺氧环境后增殖、迁移和血管新生能力的影响及可能的机制。
1 材料与方法
1.1 细胞和主要试剂 大鼠RRCEC(Procell Life Science,美国)。DMEM 细胞培养基和胎牛血清(FBS)(Clark Bioscience,美国);芒果苷、青霉素/链霉素双抗、D-(+)-葡葡萄和二甲基亚砜(DMSO)试剂(Sigma Aldrich,美国);细胞计数试剂盒(CCK-8)(Abcam公司,英国);磷脂酰肌醇-3-激酶(PI3K)/蛋白质丝苏氨酸激酶(AKT)信号通路抑制剂LY294002和激活剂胰岛素样生长因子(IGF-1)(Sigma Aldrich,美国);抗血管内皮生长因子(VEGF)抗体、抗缺氧诱导因子-lα(HIF-lα)抗体、抗PI3K 抗体、抗AKT 抗体、抗雷帕霉素靶蛋白(mTOR)抗体、抗PI3K 磷酸化抗体、抗AKT 磷酸化抗体和抗mTOR磷酸化抗体(Abcam,英国)。
1.2 细胞培养 RRCEC细胞培养在含10%FBS和1%青霉素/链霉素的高糖DMEM 培养基中,放入含有5%CO2的37°C全湿度恒温细胞培养箱内培养。
1.3 实验分组和处理 将RRCRC 细胞分为9 组:对照组、HG/缺氧组、芒果苷低浓度(0.05 mmol/L)组、芒果苷中浓度(0.1 mmol/L)组、芒果苷高浓度(0.2 mmol/L)组、芒果苷中浓度+LY294002组、芒果苷中浓度+IGF-1 组、HG/缺氧+LY294002 组和HG缺 氧+IGF-1 组。各组处理如下:HG/缺氧组RRCEC 细 胞接种于含有D-(+)-葡萄糖(30 mmol/L)的DMEM 培养基中,置于37 ℃缺氧(1%、94%N2和5%CO2)培养箱内培养;芒果苷低、中、高浓度组在HG 缺氧环境中预处理后,在培养基中分别加入0.05 mmol/L、0.1 mmol/L和0.2 mmol/L芒果苷。芒果苷中浓度+LY294002 组在细胞培养基中加入0.1 mmol/L 芒果苷和PI3K/AKT 信号通路抑制剂(LY294002,40 μmol/L);芒果苷中浓度+IGF-1组在培养基中加入0.1 mmol/L芒果苷和PI3K/AKT通路激活剂(IGF-1,100 ng/mL);HG/缺氧+LY294002组和HG/缺氧+IGF-1 组按上述剂量分别在培养基中加入LY294002 和IGF-1,均37 ℃下干预24 h。对照组细胞用相同浓度DMSO处理。
1.4 Western blotting 检测HIF-1α、VEGF、p-AKT/AKT、p-PI3K/PI3K和p-mTOR/mTOR蛋白表达 将RRCEC 细胞接种于6 孔板中(1×106个/孔),如前所述处理。PBS 清洗3 次,每孔加入90 μL 裂解缓冲液+10 μL蛋白酶抑制剂对样本进行匀浆,冰上裂解30 min。4 ℃下12 000 r/min 离心20 min。BCA 法检测样本蛋白含量,煮沸变性。应用SDS-PAGE 凝胶对40 μg 总蛋白进行电泳。湿转将蛋白转移至PVDF 膜上,8%脱脂牛奶封闭非特异性蛋白1 h,4 ℃下分别用抗VEGF(1∶1 000)、抗HIF-lα(l∶500),抗PI3K(1∶1 000)、抗AKT(1∶10 000)、抗mTOR(1∶1 000)、抗p-PI3K(1∶500)、抗p-AKT(1∶5 000)、抗p-mTOR(1∶1 000)和抗β-actin(1∶1 000)抗体孵育过夜。随后,将膜与山羊抗兔IgG二抗(1∶2 000)或山羊抗鼠IgG二抗(1∶2 000)在室温下孵育1 h,采用ECL 化学发光法显示蛋白条带,Image-Pro Plus 6.0进行灰度分析。
1.5 CCK-8 实验评估细胞增殖 芒果苷的最佳浓度参照文献[7]。RRCEC 细胞在HG 和缺氧预处理后,用芒果苷分别在37 ℃进行浓度梯度(0.01 mmol/L、0.1 mmol/L、l mmol/L和10 mmol/L)和时间梯度(24 h、48 h、72 h)干预。根据CCK-8 试剂盒说明书,以每孔1 500个细胞接种于96孔板内,每个浓度设置6 个复孔。细胞按照上述方式处理后,每孔加入CCK-8 试剂,混匀后在37 ℃细胞培养箱内继续培养1.5 h。采用酶标仪检测450 nm 波长处各孔的吸光度值(OD值)。
1.6 成管实验评估血管新生 96 孔板每孔中加入60 μL 预先冷却的Matrigel 基质胶,37 ℃凝固1 h。各组细胞胰酶消化后计数,每孔加入细胞(5×104个/mL),缺氧条件下培养6 h,然后转移到常氧条件下培养12 h。用芒果苷(0.05 mmol/L、0.1 mmol/L 和0.2 mmol/L)在缺氧条件下处理细胞24 h,利用倒置相差显微镜,在5 个随机选择的视野中观察血管生成情况。
1.7 划痕实验评估细胞迁移 各组RRCEC细胞接种于6 孔板中(5×105个细胞/孔)。100%聚集后,用无菌微量移液枪头在每个细胞单层上整齐划岀划痕,PBS清洗除去细胞碎片。用芒果苷(0.05 mmol/L、0.1 mmol/L和0.2 mmol/L)在37 ℃和缺氧条件下处理细胞24 h。使用倒置相差显微镜在24 h内3个不同时间点观察划痕的恢复程度。
1.8 统计学方法 采用SPSS 26.0统计学软件对数据进行分析。计量资料以均数±标准差()表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用Tukey's post hoc检验。以P<0.05为差异有统计学意义。
2 结果
2.1 芒果苷对HG/缺氧诱导的RRCEC活性和增殖的影响 与对照组相比,0.01~10 mmol/L 浓度芒果苷均可抑制RRCEC的活性(P<0.001),具有浓度依赖性;随着芒果苷干预时间的增加,细胞活性逐渐增加(P<0.001);但0.1 mmol/L芒果苷处理48 h时,与对照组相比,细胞活力未见明显改变(P>0.05),见图1A。CCK8结果显示,与对照组相比,HG/缺氧组RRCEC 细胞增殖能力明显增强(P<0.05),而与HG/缺氧组相比,芒果苷各浓度组对RRCEC细胞增殖能力均无明显差异(P>0.05),见图1B。
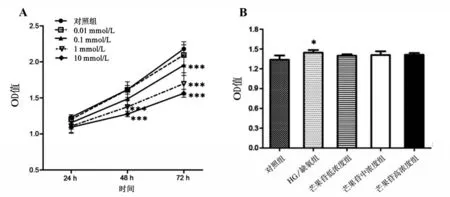
图1 芒果苷对HG/缺氧诱导的RRCEC细胞活性和增殖的影响
2.2 芒果苷对HG/缺氧诱导的RRCEC细胞迁移能力的影响 划痕实验结果显示,与对照组相比,HG/缺氧组细胞相对迁移距离显著增加(P<0.01);与HG/缺氧组相比,芒果苷低、中、高浓度组细胞迁移距离减少(P<0.05),各芒果苷浓度组间比较差异无统计学意义(P>0.05),见图2。

图2 芒果苷对HG/缺氧诱导的RRCEC细胞迁移的影响(×50)
2.3 芒果苷对HG/缺氧诱导的RRCEC细胞血管新生的影响 成管实验结果显示,与对照组相比,HG/缺氧组微管长度变长,分支数增多,血管新生能力显著增强(P<0.05);与HG/缺氧组相比,芒果苷中、高浓度组细胞中HIF-1α 和VEGF 的蛋白表达均降低(P<0.01),见图3。
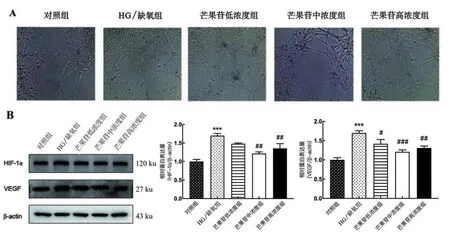
图3 芒果苷对HG/缺氧诱导的RRCEC细胞血管新生的影响
2.4 芒果苷可抑制PI3K/AKT/mTOR 信号通路的活性 与对照组相比,HG/缺氧组细胞中p-AKT/AKT、p-PI3K/PI3K 和p-mTOR/mTOR 的比值升高(P<0.05);与HG/缺氧组相比,芒果苷中浓度组p-AKT/AKT、p-PI3K/ PI3K 和p-mTOR/mTOR 的比值下降(P<0.05),芒果苷低浓度组仅p-PI3K/PI3K 的比值下降(P<0.05),而芒果苷高浓度组与HG/缺氧组相比无明显差异(P>0.05),见图4。
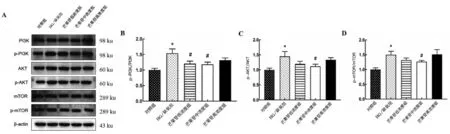
图4 芒果苷抑制HG/缺氧诱导的RRCEC细胞中PI3K/AKT/mTOR信号通路激活
2.5 PI3K/AKT/mTOR激动剂和抑制剂对HG/缺氧诱导的RRCEC细胞迁移和血管生成的影响 划痕实验(图5A)结果显示,与HG/缺氧组相比,芒果苷中浓度组和HG/缺氧+LY294002 组RRCEC 迁移能力减弱(P<0.05);与芒果苷中浓度组相比,芒果苷中浓度+LY294002 组细胞迁移能力减弱(P<0.05)。而与HG/缺氧组相比,HG/缺氧+IGF-1 组细胞的迁移能力增强(P<0.05);与芒果苷中浓度组相比,芒果苷中浓度+IGF-1 组细胞迁移增强(P<0.05)。成管实验(图5B)表现岀与迁移实验相似的结果,与HG/缺氧组相比,芒果苷中浓度组和HG/缺氧+LY294002 组分支点数量减少;与芒果苷中浓度组相比,芒果苷中浓度+LY294002 组分支点数减少。而与HG/缺氧组相比,HG/缺氧+IGF-1 组新生血管和分支点数增多;芒果苷中浓度+IGF-1组血管新生较芒果苷中浓度组增加。

图5 PI3K/AKT/mTOR激动剂和抑制剂对HG/缺氧诱导的RRCEC细胞迁移和血管生成的影响
3 讨论
长期暴露于高血糖和缺氧环境被认为是DR血液-视网膜屏障和微血管损伤的主要原因[8]。由于DR 的发病机制复杂,目前的治疗干预措施无法完全避免DR 的发生。因此,探索DR 的病理机制,寻找新型药物来降低DR的发病率和致盲率己成为当前重要的研究方向。DR病理改变的主要原因是糖尿病导致的微血管内血流动力学异常对视网膜微血管的损害。由于糖尿病对血管和血液因素的影响导致视网膜微血管闭塞,发展为视网膜缺血缺氧,引起视网膜释放大量血管生长因子,通过内皮细胞的缺氧信号促进血管内皮细胞的增殖和迁移,从而引起新生血管的形成[4]。鉴于此,本研究将RRCEC 置于HG/缺氧环境中,模拟DR 体外细胞模型,研究在不同条件下RRCEC细胞增殖、迁移和血管新生的变化。结果发现,在HG/缺氧条件下RRCEC细胞的增殖、迁移和血管新生能力均明显高于对照组,这些结果与DR的主要病理特征相符。
芒果苷是一种天然的多酚酸类化合物,广泛存在于漆树科芒果的果实、叶、皮中。研究发现,芒果苷对高血糖和糖尿病表现岀明显的药理保护作用,可减少糖尿病大鼠血清中炎症因子的释放,抑制氧化应激,同时能够显著改善糖尿病患者的胰岛素敏感度和血糖水平[9]。Deng 等[10]研究发现,芒果苷可通过阻断PI3K/AKT 通路抑制乳腺癌细胞的增殖、迁移和侵袭[10]。但芒果苷与糖尿病HG/缺氧环境诱导的视网膜微血管内皮损伤之间的关系尚未可知。内皮细胞增殖和迁移是血管生成的标志之一。本研究结果显示,芒果苷(0.05 mmol/L、0.1 mmol/L、0.2 mmol/L)对HG/缺氧诱导的RRCEC 增殖活性未表现出抑制作用,但可明显降低RRCEC的迁移和新生血管形成。这与Daud 等[11]的研究结果一致,体外实验中芒果苷可增加主动脉内皮细胞的迁移,但对细胞增殖没有影响。
HIF-lα 是调控缺氧的重要因子,可作为转录因子与VEGF 启动子结合,促进肿瘤细胞增殖、迁移、侵袭和血管新生[12]。VEGF作为目前发现最强的促血管生成因子,参与视网膜和脉络膜血管新生[13]。而且,HIF-1α 和VEGF 的表达在介导活跃的视网膜血管生成和缓解DR的进展中发挥主要作用。临床试验也证实,抗血管内皮生长因子药物可用于治疗眼部疾病的血管生成。本研究发现,芒果苷对HG/缺氧诱导RRCEC 细胞的管腔形成具有明显的抑制作用;中浓度和高浓度芒果苷治疗后,HIF-lα 和VEGF 蛋白表达较HG/缺氧组明显降低,然而低浓度芒果苷对此未产生明显影响,因此合适浓度的芒果苷可显著降低HG/缺氧诱导RRCEC细胞迁移。
PI3K/AKT/mTOR 信号通路在多种血管疾病中发挥促进作用[14]。磷脂酰肌醇-4,5-二磷酸在PI3K催化下生成磷脂酰肌醇-3,4,5-三磷酸(PIP3),激活下游AKT 的磷酸化,进而激活mTOR[15]。PI3K/AKT/mTOR信号通路在调节DR中的HIF-1α/VEGF信号表达中起着至关重要的作用[16]。值得注意的是,Sasore 等[14]报道,PI3K/AKT/mTOR 信号通路通过诱导视网膜细胞的增殖、凋亡、迁移和血管生成来促进DR的发生、发展;芒果苷可通过激活大脑中的PI3K/AKT/mTOR 信号通路减少氧化应激,对脑血管内膜产生保护作用。鉴于此,本课题组推测芒果苷可能通过调节PI3K/AKT/mTOR信号通路来防止DR 过程中视网膜毛细血管内膜增生。结果发现,相较于HG/缺氧组,中浓度芒果苷干预可显著降低p-AKT/AKT、p-PI3K/PI3K 和p-mTOR/mTOR 的比值。表明芒果苷可通过抑制PI3K/AKT/mTOR信号通路的激活缓解HG/缺氧诱导的视网膜毛细血管损伤,中浓度(0.1 mmol/L)可能是最适浓度。高浓度芒果苷并没有降低HG/缺氧诱导的RRCEC 细胞中PI3K、AKT和mTOR的磷酸化水平。笔者推测高浓度芒果苷可能激活或抑制其它上游信号通路,以降低PI3K、AKT和mTOR的磷酸化水平。因此,需要进一步实验证实高浓度芒果苷对PI3K/AKT信号通路上游成分的影响。本研究还发现,给予RRCEC细胞PI3K/AKT 信号通路特异性抑制剂LY294002处理,可产生与芒果苷同样的效果,进一步对细胞的迁移和血管新生能力产生抑制作用。IGF-1 对PI3K/AKT信号通路的激活则可明显减弱芒果苷对RRCEC 细胞迁移和血管新生的保护作用。以上结果表明,PI3K/AKT/mTOR 信号通路在糖尿病诱导的视网膜微血管损伤中发挥重要的调节作用,而中浓度芒果苷可通过此途径对HG/缺氧诱导的RRCEC细胞损伤产生较好的保护作用。
综上所述,芒果苷可以通过抑制PI3K/AKT/mTOR信号通路,显著降低HG/缺氧诱导的RRCEC细胞迁移和血管生成能力,芒果苷可能是治疗DR的有效药物。

