山东地区蛋鸡源大肠杆菌blaCTX-M型超广谱β-内酰胺酶耐药基因的流行传播研究
刘文双,魏秀丽,赵云亭,刘宝涛,邹明
(1.青岛农业大学动物医学院,山东 青岛 266109;2.山东省饲料兽医质量检验中心,山东 济南 250022;3.莱州市文昌路畜牧兽医站,山东 莱州 261400)
大肠杆菌病(Colibacillosis)作为畜禽养殖中的常见疾病,随着耐药性致病菌株的扩散和感染,给兽医临床抗感染治疗带来严峻挑战[1]。随着人们生活水平的不断提高,鸡蛋作为高蛋白营养的供应来源之一,越来越成为生活中必不可少的食品,随着需求的不断增加,我国蛋鸡养殖行业迅速发展,经营规模也不断扩大,大肠杆菌感染情况频发,一方面易造成蛋鸡出现急性败血症和腹腔腹膜炎,严重降低蛋鸡的健康状态和产蛋性能[2],另一方面抗生素的滥用造成大量耐药大肠杆菌在生物系统中通过食物链广泛传播,不仅给动物生产造成损失,还大大提高了人体感染细菌疾病的治疗难度。
近年研究表明,携带blaCTX-M型超广谱β-内酰胺酶(ESBLs)耐药基因的大肠杆菌的耐药程度不断提高,多药耐药情况也较为严重。blaCTX-M是最为常见的可以通过质粒或者克隆传播并对人类造成危害的基因型。近年来,不断有研究报道从动物及人源中分离出携带blaCTX-M耐药基因的大肠杆菌的情况。张立伟等[3]对河北省56株鸡源大肠杆菌的blaCTX-M耐药基因进行研究,结果表明blaCTX-M-9占48.78%、blaCTX-M-1占43.90%,并呈现多重耐药性。孙文萱等[4]选取69株2014—2016年从医院细菌室分离的大肠杆菌,其中36株blaCTX-M型基因,占52.2%;赵东霞[5]研究表明,92株人源大肠杆菌中86株为blaCTX-M阳性菌株,占93.5%。可见,blaCTX-M型基因的流行传播情况非常严峻。blaCTX-M基因由质粒携带进行水平传播,通过食物链在全球范围内迅速扩散[6]。目前报道中很少有专门针对蛋鸡源大肠杆菌的研究,因此,本试验对山东地区蛋鸡源携带blaCTX-M型超广谱β-内酰胺耐药基因的大肠杆菌耐药情况及水平转移现象进行调查,以期为指导合理用药提供理论依据。
1 材料与方法
1.1 样品采集
2019年从山东省济南市(60份)、青岛市(75份)、日照市(49份)、德州市(60份)、潍坊市(76份)5个蛋鸡养殖场采集粪便样本,共计320份。
1.2 主要试验材料
麦康凯琼脂培养基、MH琼脂培养基、MH肉汤、LB肉汤、细菌生化微量鉴定管,购于青岛海博生物技术有限公司;PCR Buffer、dNTP、Taq酶、DNA Marker,购于北京全式金生物技术有限公司。
药敏试验原药:头孢噻肟(cefotaxime sodium,CTX)、阿米卡星(amikacin,AMK)、安普霉素(apramycin,APR)、大 观 霉 素(spectinomycin,SPE)、阿莫西林(amoxicillin,AMX)、头孢他啶(ceftazidime,CAZ),购自索莱宝生物科技有限公司;头孢噻呋(ceftiofur,CTF)、氨苄西林(ampicillin,AMP)、链霉素(streptomycin,STR)、多粘菌素(colistin,COL)、环 丙 沙 星(ciprofloxacin,CIP),购自上海麦克林生化科技有限公司;恩诺沙星(enrofloxacin,ENR)、庆大霉素(gentamicin,GEN)、卡那霉素(kanamycin,KAN)、萘啶酸(nalidixic acid,NAL)、四环素(tetracycline,TET),购自中国兽医药品监察所;磷霉素(fosfomycin,FOS),购自上海瑞永生物科技有限公司;氟苯尼考(florfenicol,FFL),购自中国药品生物制品检定所。
1.3 大肠杆菌的分离鉴定
从采样管中吸取1 mL粪便样品加入5 mL LB肉汤中,恒温摇床中培养18 h,接种于麦康凯培养基培养18~20 h后挑选边缘整齐圆润的粉红色单菌落,每个样本挑选一株,采用细菌微量生化反应管进行鉴定。采用引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′[7]扩增16S rDNA,预计扩增长度为1 465 bp。引物由北京擎科生物科技有限公司青岛分公司合成。随机挑选几株生化鉴定后的大肠杆菌,PCR扩增后测序,比对验证结果。
1.4 药敏试验
选择大肠杆菌ATCC 25922作为质控菌,采用琼脂稀释法(CLSI,2015,M100-S25)检测大肠杆菌对COL、KAN、GEN、AMK、APR、CTX、CTF、AMP、FFL、NAL、CIP、ENR、CAZ、AMX、TET、SPE、STR、FOS共18种抗菌药的敏感性。
(1)菌株准备:将标准菌株ATCC 25922和试验菌株接种于MH琼脂培养基上,37℃培养18~20 h后挑取单菌落接种于MH肉汤。(2)药物稀释:在一次性培养皿上标注好药物名称及稀释浓度,梯度稀释药物至相应浓度并使终体积为1 mL。(3)含药培养基的制备:19 mL MH琼脂加入含药培养皿(磷霉素含药培养皿每毫升琼脂中加入25 μL 6-磷酸葡萄糖),轻轻晃匀后放置凝固晾干;以不含药琼脂板作为空白对照。(4)菌液的接种:吸取50 μL菌液加入5 mL MH肉汤中,37℃摇床振荡培养4 h。96孔板中每孔加入247.5 μL MH肉汤和2.5 μL菌液(ATCC 25922为对照)。用灭菌印章蘸取菌液至含药琼脂板上,静置,待菌液完全吸收后,37℃培养18 h左右。(5)结果判读:统计各药物的MIC值,根据CLSI标准进行结果判读。
1.5 blaCTX-M耐药基因的检测
采取 水 煮 法 提 取DNA。合 成blaCTX-M、blaCTX-M-1G、blaCTX-M-9G耐药基因引物序列参考Liu[8]、Briñas[9]等。反应体系(15 μL):ddH2O 10.55 μL,10×PCR Buffer 1.5 μL,dNTP 1.2 μL,上下游引物各0.3 μL,Taq酶0.15 μL,模板DNA 1μL。PCR扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸30 s,30个循环;72℃延伸5 min。扩增产物采用1%琼脂糖凝胶电泳进行鉴定,凝胶成像仪观察并保存。
1.6 携带blaCTX-M基因大肠杆菌的接合试验
(1)供体菌(blaCTX-M阳性大肠杆菌)和受体菌(C600)分别于LB液体培养基进行活化,37℃摇床振荡培养4~6 h。(2)取100 μL受体菌和供体菌分别加到3 mL LB肉汤中,受体菌37℃摇床振荡培养4~4.5 h,供体菌培养3~3.5 h,供受体菌1∶4混合,恒温培养箱静置培养6 h左右。(3)混合菌液5 000 r/min离心4 min,弃上清,每管加0.5 mL高压灭菌生理盐水。(4)吸取100 μL菌液于 联 合 药 板(CTX:2 μg/mL,STR:1 000μg/mL)上,均匀涂布至干涩,静置30 min至1 h,37℃培养20 h左右。(5)疑似接合子纯化后,PCR鉴定,挑取blaCTX-M阳性接合子。(6)药敏试验进一步确认是否接合成功。30%甘油肉汤保菌,置于-80℃冰箱保存备用。
1.7 接合子复制子分型
参考Carattoli[10]、Chen[11]、Johnson[12]等的方法进行质粒分型,具体引物序列及片段大小见表1。

表1 质粒复制子分型的引物序列
1.8 数据统计与分析
采用Microsoft Excel进行数据处理和作图。
2 结果与分析
2.1 蛋鸡源大肠杆菌的分离与鉴定
本研究采集样本数为320份,为探究同一样本分离的不同菌株是否存在同一克隆,济南、德州地区每份样品分离两株大肠杆菌,经麦康凯培养基筛选及细菌微量生化鉴定,共获得440株大肠杆菌,样本分离率为100%。分离得到142株携带blaCTX-M基因的大肠杆菌,检出率为32.3%。其中含blaCTX-M-9G基 因 的 有89株(20.2%),含blaCTX-M-1G基因的有62株(14.1%,表2)。

表2 耐药基因型携带情况
2.2 不同地区携带blaCTX-M基因大肠杆菌的分型情况
如图1所示,青岛、潍坊、日照、德州样品中blaCTX-M-9G的检出率分别为13.40%、5.63%、2.11%、22.50%,blaCTX-M-1G的 检 出 率 分 别 为7.75%、13.40%、1.41%、39.40%。德州样品中blaCTX-M-9G、blaCTX-M-1G的检出率均最高。济南样品中均未检测出blaCTX-M-1G和blaCTX-M-9G。本试验并未检测出其他blaCTX-M型ESBLs编码基因。

图1 各地区blaCTX-M基因型检出情况
2.3 药敏试验结果
试验结果(表3)表明,β-内酰胺耐药基因blaCTX-M耐药菌株对氨苄西林(AMP)、阿莫西林(AMX)、四环素(TET)耐药率较高,达90%以上;对头孢菌素类药物[头孢噻呋(CTF)和头孢噻肟(CTX)]的耐药率分别为86.6%、85.9%;对喹诺酮类药物[萘啶酸(NAL)、恩诺沙星(ENR)、环丙沙星(CIP)]的耐药率分别为86.6%、83.1%、73.2%;对氨基糖苷类药物[卡那霉素(KAN)、庆大霉素(GEN)、大观霉素(SPE)、安普霉素(APR)]的耐药率分别为68.3%、59.9%、55.6%、52.1%;对氟苯尼考(FFL)的耐药率达82.4%;对多粘菌素(COL,30.3%)、头孢他啶(CAZ,31.7%)、磷霉素(FOS,50.7%)均表现出较高耐药性;对阿米卡星(AMK)的耐药率最低,仅为2.8%。
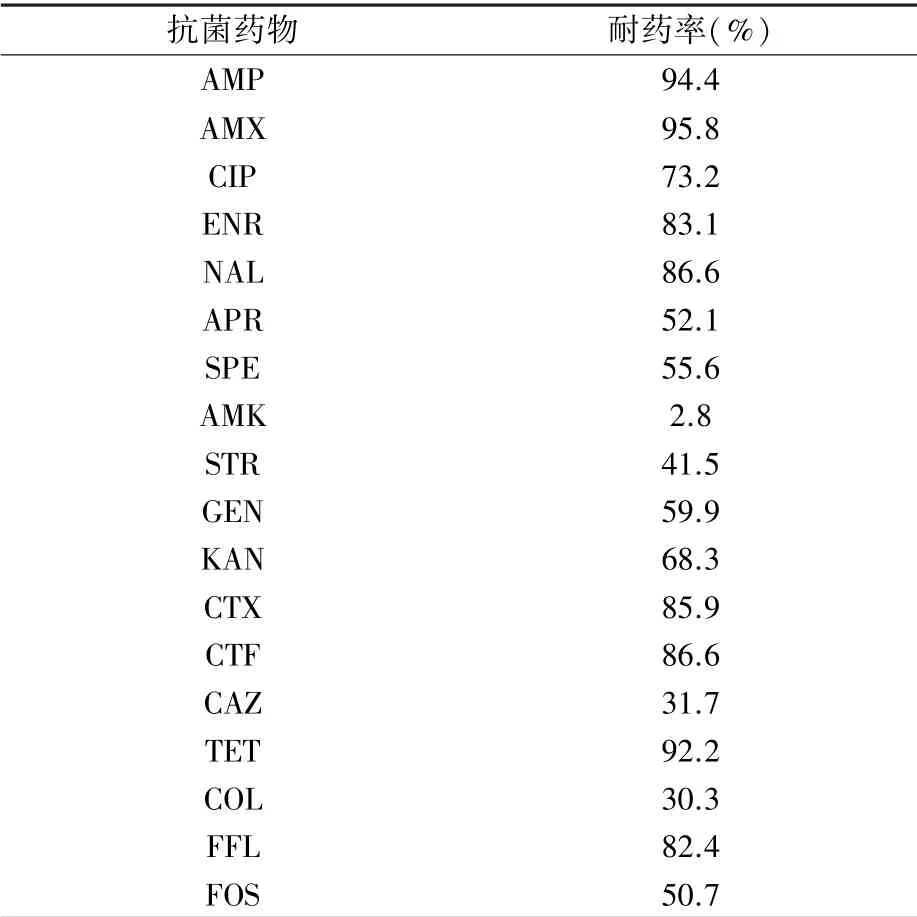
表3 142株blaCTX-M阳性大肠杆菌对18种常用抗菌药的耐药率
2.4 接合试验结果
通过PCR鉴定,条带为540 bp可初步判定接合转移成功(图2)。142株携带blaCTX-M基因的菌株中,有139株接合成功,接合率为97.9%。
图2 blaCTX-M基因型接合子PCR鉴定
2.5 blaCTX-M接合子药敏试验结果
由表4可知,blaCTX-M阳性大肠杆菌接合子对头孢菌素类[头孢噻呋(CTF)、头孢噻肟(CTX)、链霉素(STR)]全部耐药;对氨基糖苷类[庆大霉素(GEN)、卡那霉素(KAN)、安普霉素(APR)、大观霉素(SPE)]、喹诺酮类[萘啶酸(NAL)、恩诺沙星(ENR)]、青霉素类[阿莫西林(AMX)、氨苄西林(AMP)]、多粘菌素(COL)、四环素(TET)、磷霉素(FOS)、氟苯尼考(FFL)的耐药率介于0.72%~15.11%之间;对阿米卡星(AMK)、头孢他啶(CAZ)、环丙沙星(CIP)不耐药。接合子耐药率较供体菌菌株显著降低。

表4 139株携带blaCTX-M基因接合子的耐药情况
2.6 blaCTX-M接合子复制子分型结果
为追踪具有耐药性的质粒在流行病学上的重要性,对肠杆菌科主要质粒不亲和性组的复制子进行PCR扩增,分别识别FIA、FIB、FIC、HI1、HI2、I1、L/M、N、P、W、T、A/C、K、B/O、X、Y、F、FIIA、IncI2、IncX3和IncX4型,来追踪特异性耐药质粒在不同环境下的扩散。试验结果如表5所示,在blaCTX-M阳性接合子复制子分型中,F型质粒占比最高,为82.0%。仅个别菌株质粒型为HI2、I1、B/O、N、FIA、FIB型。因此,F型为携带blaCTX-M基因大肠杆菌的优势质粒类型,可以促进耐药基因的水平传播。

表5 blaCTX-M阳性接合子复制子分型
3 讨论与结论
大肠杆菌(Escherichia coli)又名大肠埃希氏菌,20世纪50年代被发现表现出病原性,大肠杆菌中一些特殊血清型的菌株会致使人和动物患严重腹泻甚至败血症。目前,大肠杆菌感染通常使用抗菌素治疗,临床治疗对抗生素的依赖性以及抗生素使用的不规范性,导致耐药情况日趋严峻,加大了疾病防控难度[13]。本试验对山东地区5个蛋鸡养殖场的粪便样品进行分离鉴定,获得了440株蛋鸡源大肠杆菌,样品分离率达100%。本试验结果高于张召兴等[14]2018—2019年对河北地区蛋鸡源病料组织的分离率(69.4%);与李贵萧等[15]对山东聊城活禽市场鸡粪源大肠杆菌的分离率(100%)一致。
我国产ESBLs大肠杆菌中流行的主要基因型是blaCTX-M[16]。本研究中,山东地区blaCTX-M基因型携带率为32.3%。杨承霖等[17]在对四川省食品动物源大肠杆菌的研究中,blaCTX-M基因检出率为27.7%,可见不同地区、不同时间blaCTX-M基因的携带情况存在一定差异。杨守深等[6]研究表明,闽南地区大肠杆菌blaCTX-M-9G基因型的携带率为19.4%,与本试验结果(20.2%)相差不大。
抗生素大量广泛的使用使大肠杆菌总体耐药情况较为严重。其中氨苄西林、四环素耐药率达90%以上,与傅学聪[18]得出的禽蛋表面耐药菌对四环素的耐药率(98.7%~99.6%)相近;邵志勇等[19]研究结果表明氨苄西林耐药率达100%。本研究中阿莫西林耐药率为95.8%,与李蕴玉等[20]报道的阿莫西林耐药率相近。本研究中对头孢菌素类药物耐药率为31.7%~86.6%,宋立等[21]2005年报道的头孢菌素类药物耐药率仅为0~19.5%;李赫[22]2013年报道的辽宁省盘锦地区动物源大肠杆菌对头孢菌素类药物耐药率已经升高到37%~52%;王慧真等[23]2018年报道的河北地区鸡源大肠杆菌对头孢菌素类药物耐药率为41%~70%。从2005年开始头孢菌素类药物耐药性急剧上升,与我国从2005开始产ESBLs分离株检出率升高的情况相对应。综合来看,blaCTX-M基因型的存在与头孢菌素类药物耐药情况密切相关。
质粒能够增加细菌的遗传多样性,并可以通过接合在细菌群体之间进行水平交换[24]。质粒同时可能携带控制抗菌耐药性必需的基因或其他附属基因[25]。质粒分型有助于了解基因在菌株间水平转移过程,这对于掌握质粒在菌株间的传播路径具有重要价值。本研究通过21对复制子引物的PCR扩增,对139株blaCTX-M阳性接合子进行复制子分型。其中,blaCTX-M阳性菌株接合子复制子分型主要为F型,占82.0%,与赵世玉[26]对多重耐药大肠杆菌blaCTX-M基因扩散机制研究结果一致。Sunde等[27]的研究发现所有分离株都含有F型质粒,大多数菌株都含有可自我移动的质粒。山东地区蛋鸡源blaCTX-M基因阳性大肠杆菌通过质粒水平传播,造成blaCTX-M基因的携带率不断提高,促使耐药大肠杆菌的流行率进一步升高。
山东地区携带blaCTX-M基因的蛋鸡源大肠杆菌检出率较高,耐药情况较为严重,耐药基因可通过水平转移在细菌之间传播,造成多药耐药,也可通过食物链传播给人类或其他动物,为医疗和公共卫生带来严峻挑战。对此我们需更加严密的监控携带blaCTX-M基因的大肠杆菌的流行情况。本研究可对蛋鸡源耐药大肠杆菌的流行情况、传播机制以及抗生素的合理应用提供一定的参考。

