喜旱莲子草在遮光环境下的生理生态参数响应模式和遮光防治阈值
黄 旬,王 玲,FAISAL Hayat,郭佳琦,黄佳乐,陈俊辰,李兆华,2
(1. 湖北大学资源与环境学院, 湖北 武汉 430062;2. 区域开发与环境响应湖北省重点实验室, 湖北 武汉 430062;3. 中国科学院重庆绿色智能技术研究院, 重庆 400714)
喜旱莲子草(Alternanthera philoxeroides)是一种水陆双生的外来入侵恶性杂草,在我国适生面积占国土面积的22.2%[1]。强大的克隆繁殖能力,使其相比本地物种拥有更高的资源利用率和生长速率,只需少量的陆生型喜旱莲子草片段,经过一个生长季就能长成1~3 m 宽的植株斑块[2];水生型喜旱莲子草越冬后,70%以上的茎都可在一周内萌芽,从3 月到8 月中旬可生长5.08 m,形成的漂浮垫层可从海岸线蔓延4.6 m[3]。喜旱莲子草不仅对我国生物多样性和生态系统造成了极大的威胁,还会造成农作物大量减产[4-6]。Mehmood 等[7]经过两年的田间试验发现喜旱莲子草不仅造成水稻(Oryza sativa)产量和直链淀粉的损失,还会影响稻米蛋白质含量。
光照是影响植物生长发育的重要环境因子之一。自然界中的光环境会随着时间和空间发生变化,导致植物接收到的光照强度、光照时间和光谱成分等发生改变,从而影响植物的生长。对于遮光产生的光照强度变化,植物可以通过表型可塑性改变生物量分配和形态来适应,以维持正常的生长状态[8]。表型可塑性也被认为是外来植物成功入侵的重要机制之一,具有确定的遗传基础[9]。
关于不同光照强度下喜旱莲子草的表型可塑性研究也有一些报道。陈中义等[10]发现在不同的光照强度下喜旱莲子草通过表型可塑性维持了相对稳定的空间生长格局,是其成功入侵的一个重要机制。许建平等[11]发现光照影响喜旱莲子草主茎和叶片的表型可塑性,使植株在不同光环境下通过生长权衡来占据有利生境。班芷桦和王琼[12]在林下和林缘生境中观察到喜旱莲子草的优势种地位会逐渐被其他草本植物取代,并采用盆栽试验证明了接骨草(Sambucus chinensis)可以作为中度遮阴的陆生生境下喜旱莲子草生物替代的控制材料。这表明:1)不同遮光率可能会影响喜旱莲子草的生长、形态;2)低光照可能会抑制喜旱莲子草的生长和表型可塑性带来的抗逆作用,即存在遮光防控阈值。但喜旱莲子草对不同遮光率的生理生态参数响应模式尚不明确,因此,本研究以陆生型喜旱莲子草为研究对象,通过设置不同的遮光梯度,重点监测不同遮光率下喜旱莲子草生理生态参数的响应模式,为探索该入侵物种的遮光防治阈值提供参考依据。
1 材料与方法
1.1 试验地点与材料
试验在湖北省武汉市湖北大学资源环境学院的试验园(30°34′27′′ N, 114°19′45′′ E)中进行。
取中国农业科学院油料研究所试验田的土壤,自然风干(土壤含水量为1.48%,有机质含量为1.41%),过0.15 mm 筛后,与沙子1 ∶ 1 混合后作为培养基质。
喜旱莲子草是一种多年生宿根草本,幼嫩时整株全绿,成熟后茎部呈红褐色,其茎上有茎节,茎节处萌发嫩芽或分枝,叶片于茎节处对生,靠近地面的茎节上生根。全光照时匍匐生长在池塘、沟渠、河流、水田、旱田、草坪、果园等环境中,遮阴明显的地方更倾向于直立生长[13-15]。2020 年10 月16 日在武汉市外沙湖界标(30°34′31′′ N, 114°19′46′′ E)周围采集生长状况良好、长势一致的陆生型喜旱莲子草。剪取含5 个茎节、长25~28 cm、健康、生长一致且带完整顶梢的主茎。选取的主茎最下部茎节均生有细小不定根。
购买市售的9 种具有不同孔隙密度的遮光网,2020 年9 月29 日至10 月9 日,每天09:00、12:00 和15:00 在试验地点用手持照度计(TA 8123)测量全光照和9 种遮光网遮光后的光照强度,并计算遮光率。从中挑选出5 种遮光率有明显差异的遮光网,设 置 遮 光 率 为 不 遮 光(CK)、51.0% ± 2.9% (L1)、64.3% ± 2.4% (L2)、69.7% ± 2.6% (L3)、81.8% ± 2.5%(L4)和88.3% ± 1.4% (L5)的6 组遮光环境。
1.2 试验方法
2020 年10 月16 日将喜旱莲子草垂直插扦入花盆中,插扦深度5~8 cm,每盆2 株,共25 盆,用遮光率为L1 的遮光网覆盖后进行预培养,及时替换长势较差的植株。
2020 年11 月11 日,待植株生长稳定后,挑选长势较均一的18 盆植株进行遮光处理。用选定的5 种遮光网制作遮光棚,每棚下放3 盆,另有不遮光的3 盆作对照组(CK)。
试验期间,环境温度控制在(28 ± 2) ℃,相对湿度 > 65%。每3 d 浇一次水,并用绿陇三合一土壤检测仪测定土壤湿度,将湿度值控制在6~8。每周根据茎叶生长状况调整植株摆放位置,保证每盆植株都能完整遮光。
2021 年1 月13 日收获,记录喜旱莲子草的分枝数、 > 10 cm 的长分枝数、叶片数。选取顶端向下第3 节的叶片测量叶面积、叶厚、相对叶绿素含量。用ImageJ 测定叶面积,用CD-S15c 数显卡尺测量叶片最宽处横断面厚度,用CCM-200 plus 叶绿素仪测定相对叶绿素含量。将洗净后的根、茎、叶分开,放入80 ℃烘箱中烘干72 h 后,分别测定根生物量、茎生物量和叶生物量。地上生物量 = 茎生物量 + 叶生物量,根冠比 = 地下生物量/地上生物量。各参数可塑性指数的计算采用Valladares 等[16]的方法,即各参数的最大值减去其最小值之差与其最大值之比。
1.3 数据处理
所有试验数据均用Excel 2016 软件计算平均值和标准误。使用SPSS 26.0 软件对数据进行单因素方差分析及差异显著性检验,用Excel 2016 对生物量和分枝数数据进行线性拟合。用Origin 2021 进行绘图。
2 结果与分析
2.1 不同遮光率处理下植株生物量
遮光对喜旱莲子草的地上生物量、地下生物量、根冠比有极显著影响(P< 0.01) (表1)。为探究不同遮光率对喜旱莲子草生物量影响的程度,对不同遮光率与其地上、地下生物量、根冠比进行了回归分析。遮光率对喜旱莲子草的地上、地下生物量均呈线性影响(R2> 0.95),随遮光率的增加生物量逐渐下降。相关关系公式分别为y= -0.829 4x+ 1.170 5和y= -1.055 9x+ 1.115 0,相关系数分别为0.829 4 和1.055 9。喜旱莲子草的根冠比也随遮光率增加呈反对数式下降模式(R2> 0.98),其相关关系公式为y= -1.125 2x2+ 0.325x+ 0.945 4。
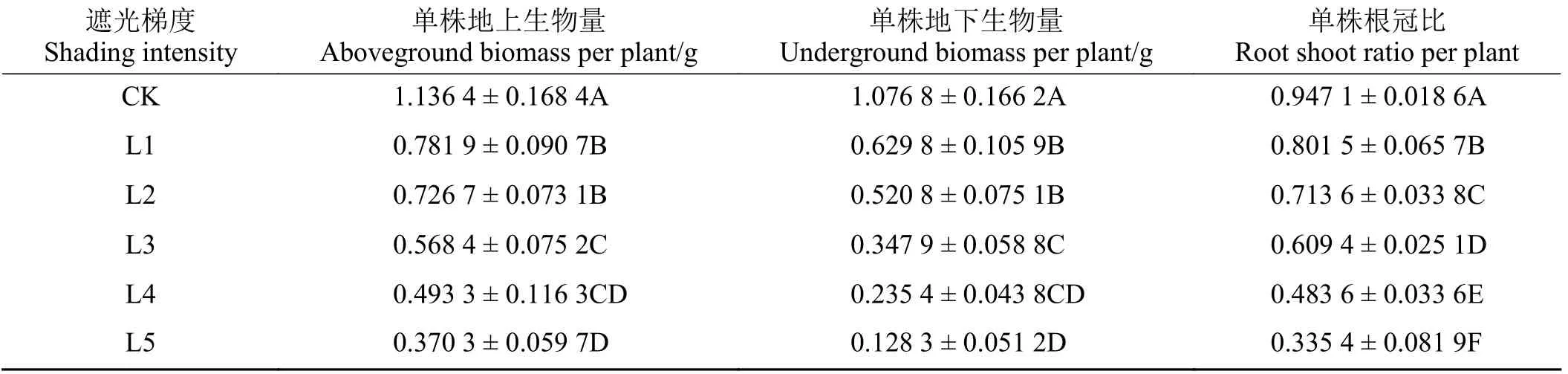
表1 不同遮光率处理下喜旱莲子草的生物量变化Table 1 Effects of different shading rates on the biomass of A. philoxeroides
2.2 不同遮光率处理下植株形态
喜旱莲子草的各形态参数对遮光的平均可塑性指数达到0.66,且分枝数、长枝占比、叶片数的可塑性指数皆在0.80 左右(表2)。遮光对喜旱莲子草的分枝在数量和长短枝分配上的影响极显著(P<0.01) (图1)。随着遮光程度的增加,喜旱莲子草的单株分枝数呈线性下降模式(y= -20.114x+ 24.103)(R2= 0.944 5)。而单株长枝占比则与之相反,呈持续上升趋势。经统计,当遮光率达到L2 时,其平均分枝数下降了56.84%,而平均长枝占比则增加了100%。

表2 喜旱莲子草形态参数对遮光的可塑性指数Table 2 Effects of plasticity index of morphological parameters on the shading of A. philoxeroides
叶片作为喜旱莲子草的临时储能器官,其数量、面积、厚度受遮光率的影响极显著(P< 0.01)。喜旱莲子草叶片的数量和厚度均随着遮光率的增加而下降,且叶片厚度在L2 和L5 处出现了明显的下降(图1)。而喜旱莲子草叶面积则随遮光程度的增加呈先增后降的趋势,在L2 处达到最大值。

图1 不同遮光率对喜旱莲子草形态的影响Figure 1 Effects of different shading rates on the shape of A. philoxeroides
2.3 不同遮光率处理下植株相对叶绿素含量
遮光对喜旱莲子草的相对叶绿素含量(relative chlorophyll content, SPAD)影响极显著(P< 0.01)。喜旱莲子草的SPAD 随遮光率增加呈先升后降的趋势(图2)。在L2 处达到最高值,为CK 的1.64 倍;之后再快速降低,L5 处,平均SPAD 已低于不遮光状态,只有CK 的84.42%。以上喜旱莲子草的SPAD变化表明,一定程度的遮光促进了叶片中叶绿素的合成,而当遮光率达到L2 以后,这种促进作用则会随着遮光率的进一步增加而减弱,直至完全消失,进而抑制叶绿素的合成。
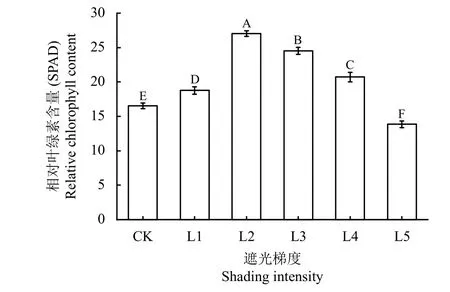
图2 不同遮光率对喜旱莲子草相对叶绿素含量的影响Figure 2 Effects of different shading rates on the relative chlorophyll content of A. philoxeroides
3 讨论
喜旱莲子草专化的劳动分工能力,表现为地下部分专化吸收地下资源,与其他植物争夺水分、营养和地面生态位;而地上部分则专化地上扩繁,占据空间生态位和抢夺光资源,再通过克隆整合进行物质传输与共享,生境中养分越高这种分工能力就越强[17-18]。当喜旱莲子草遭遇遮阴逆境时,会导致地上部分通过光合作用获取的能量减少,致使其地上部分的生物量下降。植株的地下部分会通过克隆整合对地上部分进行资源支持来缓解逆境压力,进而使地下生物量也随着遮光率的增加呈下降趋势[19]。从喜旱莲子草的生物量变化规律可以看出,植株的生物量随遮光率增加而持续降低,且地下生物量的降低幅度更大。当遮光率达到L2 (61.9%~66.7%)时,就可将地下生物量降低一半以上。而喜旱莲子草的地下根茎才是主要决定其繁殖分配和地上部分生长的部位[20]。这对拥有发达的地下根茎和更强的昆虫采食防御能力的陆生型喜旱莲子草的防治具有重要意义[21]。
在本研究中,喜旱莲子草的形态对遮光率变化表现出了极高的表型可塑性。结合分枝数、长枝占比和叶片数等指标的单株变化量来看,发现表型可塑型指数越高,遮光对该形态指标的降低效果越明显。这说明喜旱莲子草可能主要通过形态可塑性来适应不同的光环境。
强大的分枝发生能力是其能发展成为优势种群的重要原因之一[11]。本研究中,随遮光率不断增加,喜旱莲子草的分枝发生能力持续降低,转而将茎生物量更多地投入到分枝的伸长上,以逃离遮光环境,大幅度降低了喜旱莲子草的生存和繁衍能力。同时,遮光会使喜旱莲子草通过降低叶片数量和叶片厚度来减少在叶部的资源分配,使得叶部作为临时存储器官延缓干扰对幼嫩分株片段影响的能力减弱[22]。一定程度的遮光还会促使喜旱莲子草通过表型可塑性来增大叶面积,以最大化的获取光资源,但当遮光率增加到L2 (61.9%~66.7%)后,随遮光率增加这种促进作用会被抑制。
叶绿素的生物合成量对光合作用至关重要,在实际检测中可以用SPAD 指标基本反映出其含量水平[23-25]。光照是影响叶绿素合成、分解过程动态平衡的主要外部因素。形成叶绿素所需要的光照强度较低,而在强光下形成的单线态氧会损伤叶绿体,造成光损伤使叶绿素含量降低,因此,在本研究中出现遮光后叶绿素含量升高的现象。与石栎(Lithocarpus fohaiensis)幼苗、海芋(Alocasia macrorrhiza)等随光照强度减弱叶绿素含量增加的结果是一致的[26-27]。当遮光率高于L2 (61.9%~66.7%)后SPAD 值开始下降,主要是因为弱光环境下,植物体内与叶绿素合成有关的基因表达减弱,而与其分解有关的基因表达则会增加[28-29],进而导致叶绿素合成受阻,影响其光合作用。因此,只有当遮光率高于L2 (61.9%~66.7%)后,才能有效降低喜旱莲子草的光合作用能力。
4 结论
本研究表明,遮光率增加显著降低了喜旱莲子草的生物量,改变了其生长资源的分配模式,使其将更多的资源用于向外扩张以逃离遮光环境,从而降低了其生存繁殖能力。喜旱莲子草强大的表型可塑性虽能缓解遮光逆境带来的不利影响,但当遮光率在61.9%~66.7%,这种由表型可塑性带来的抗逆作用会被抑制。因此,可在实际工作中将61.9%~66.7%作为喜旱莲子草的遮光防治阈值,来减缓其定殖扩张速度,让本地耐阴物种有更多的生长机会并发展成为优势物种,从而进一步抑制喜旱莲子草的生长。

