基于网络药理学和分子对接技术探讨升陷汤治疗冠心病的作用机制
张子浩,郗瑞席,徐 浩,3
冠状动脉粥样硬化性心脏病(CHD)简称冠心病,作为我国十大慢性病之一,尽管西医标准化治疗贯穿始终,但仍然有阿司匹林抵抗、介入治疗后再狭窄等药物和支架等不能解决的问题,中医药在其中发挥了重要作用[1]。冠心病病人联合服用中药,可有效缓解症状,减少药物副作用,延缓疾病进展[2],但其作用机制尚不明确,也成为近年来研究的热点。
冠心病属中医学“胸痹”范畴,证属本虚标实,本虚以气虚为主,标实以血瘀为主[3]。升陷汤出自《医学衷中参西录》,由生黄芪、知母、柴胡、升麻、桔梗5味药组成,主治胸中大气下陷证。胸中大气即宗气,张锡纯谓其“不但为诸气之纲领,并可为周身血脉之纲领”[4],宗气亏虚则气血运行不畅,日久导致血液瘀滞,发为胸痹。升陷汤益气升陷,可使气血运行归于正常,临床广泛用于治疗冠心病等心血管疾病。大量临床研究显示,以升陷汤为基础方治疗冠心病的疗效显著[5]。现代药理学研究表明,升陷汤可以通过抑制细胞凋亡、降低细胞内活性氧(ROS)以及Ca2+的浓度等机制减轻缺血缺氧对心肌细胞的损伤[6]。
网络药理学通过大数据搜索,构建并分析生物分子网络,探索药物对于疾病的影响。本研究利用中药复方网络药理学探讨升陷汤治疗冠心病可能的网络靶标与作用机制,为后续研究提供思路。
1 资料与方法
1.1 升陷汤活性成分的筛选和靶点预测 利用中药系统药理学数据库与分析平台(TCMSP)(https://old.tcmsp-e.com/tcmsp.php)[7],分别以黄芪、知母、柴胡、升麻、桔梗为关键词,设置口服生物利用度(OB)≥30%、类药性(DL)≥0.18,检索升陷汤的活性成分,并根据已发表文献进行补充,通过TCMSP预测各成分的作用靶点。
1.2 疾病靶点获取 在疾病基因数据库Genecards(https://www.genecards.org)[8]、TTD(https://db.idrblab.net/ttd)[9]、DrugBank(https://go.drugbank.com)[10]中以“coronary heart disease”为检索词进行检索,将结果合并去重后,导入UniPort数据库(https://www.uniprot.org)标准化靶点名称,得到冠心病靶点。
1.3 药物和疾病共同靶点的筛选 将疾病靶点与药物靶点导入Excel表格进行比对,筛选两者交集基因,获得升陷汤治疗冠心病的作用靶点,并通过微生信平台(http://www.bioinformatics.com.cn)在线绘制Venn图。
1.4 “成分-靶点”网络构建 将活性成分与作用靶点导入Cytoscape 3.8.2构建“成分-靶点”网络,使用Network Analyzer进行拓扑分析,计算连接度(degree)预测关键成分。
1.5 蛋白质互作(PPI)网络构建 将交集靶基因导入STRING(https://string-db.org)数据库,种族选择Homo sapiens,将置信度设置为0.9,去除游离靶基因,得到PPI网络,并用Cytoscape 3.8.2进行优化,通过节点连接度筛选核心靶点。
1.6 富集分析 利用Metascape平台(https://metascape.org/gp/index.html)对交集靶点进行基因本体(GO)富集分析和京都基因和基因组百科全书(KEGG)富集分析,结果通过微生信平台在线进行可视化。
1.7 分子对接 选择连接度排名前5位的化合物及靶点进行分子对接。在TCMSP平台中搜索化合物结构,保存为mol2文件。将关键靶点导入PDB数据库(http://www.rcsb.org/),通过放射度(R值)筛选得到对应的靶点蛋白,保存蛋白结构为pdb文件。将mol2及pdb文件导入CB-Dock平台(http://cao.labshare.cn/cb-dock/)在线对接和可视化,通过对接分数值来评价其结合活性。
2 结 果
2.1 升陷汤活性成分及其靶点获取 利用TCMSP平台及文献[11-14]共筛选到46种活性成分(黄芪12种,柴胡10种,知母9种,桔梗4种,升麻6种,5种共有成分)和263个靶点,活性成分见表1。

表1 升陷汤活性成分
2.2 冠心病相关靶点检索 通过GeneCards、DrugBank、TTD分别得到7 100个(选取score值前1/4的靶点为1 777)、68个、2个冠心病靶点,合并去重后得到1 797个靶点。
2.3 药物和疾病共同靶点的获取 使用Excel表格筛选得到158个药物和疾病交集靶点,将药物作用靶点和冠心病相关靶点导入微生信平台,绘制Venn图,见图1。
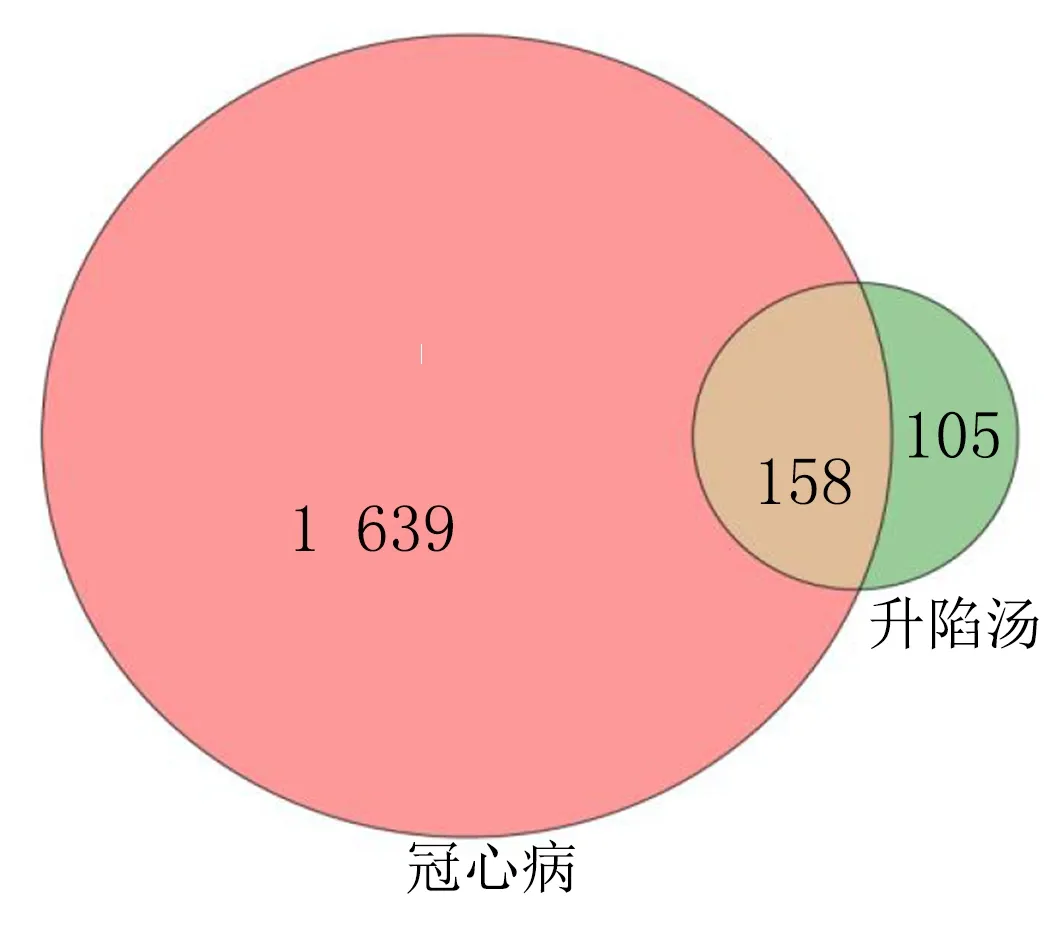
图1 药物靶点和疾病靶点分布图
2.4 “成分-靶点”网络构建 网络共包含210个节点(158个靶点、46个活性成分、5个中药、1个代表冠心病)与1 039条边,见图2。degree代表网络中与该节点相互作用的节点数量,度值越高提示该节点在网络中作用越关键。网络中,槲皮素、山奈酚等活性成分度值较高,可能是升陷汤治疗冠心病的关键成分。详见表2。
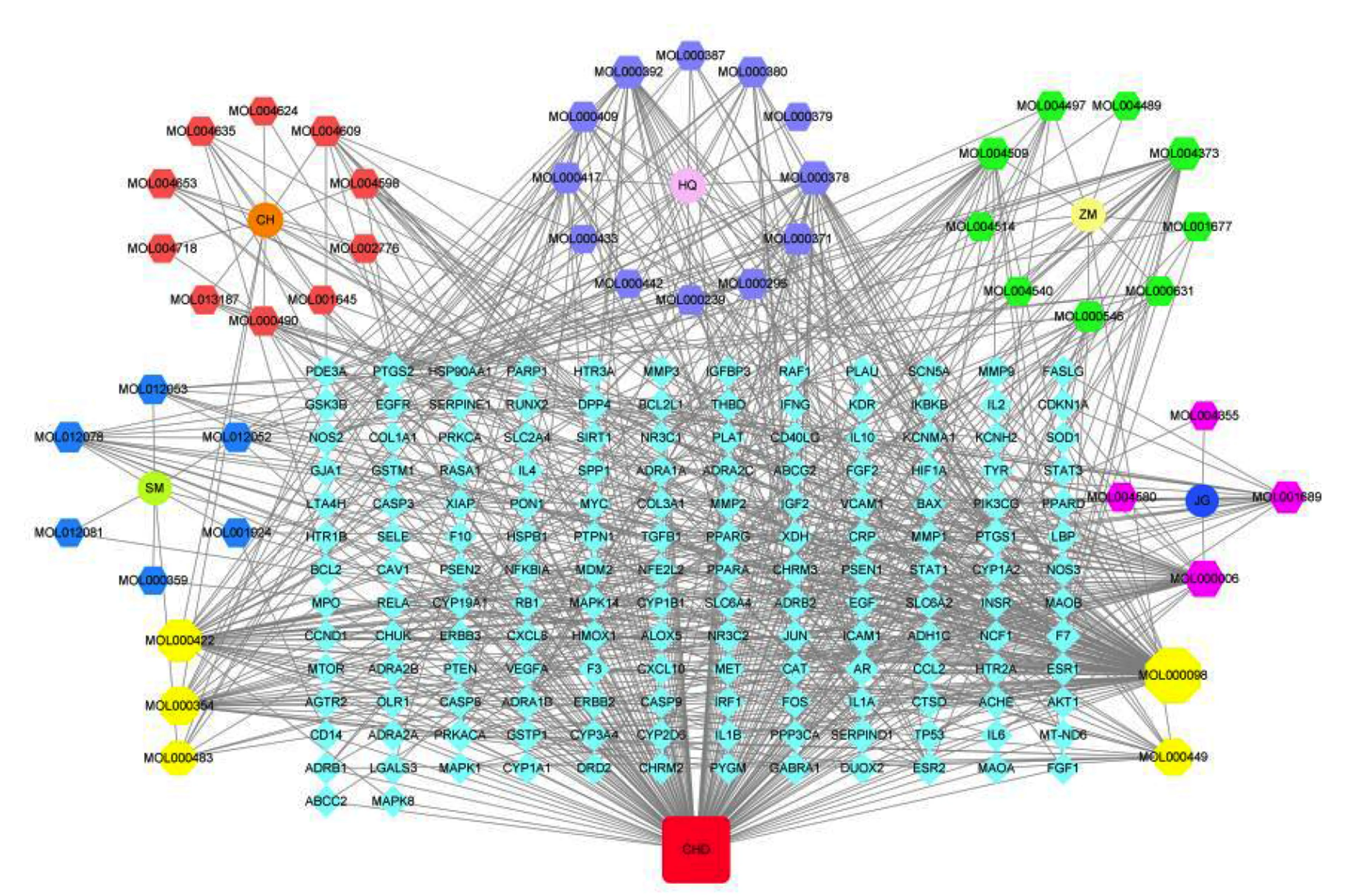
图2 成分-靶点网络图

表2 关键活性成分
2.5 PPI网络构建 利用STRING数据库对158个交集基因进行PPI分析,设置阈值>0.9,隐藏游离基因,结果导入Cytoscape 3.8.2绘制PPI网络图(见图3)。该网络包含137个节点、646条边,度值较高的基因有信号转导和转录激活因子3(STAT3)、蛋白激酶(AKT)1、JUN原癌基因(JUN)、丝裂原活化蛋白激酶(MAPK)1、肿瘤蛋白P53(TP53)等。
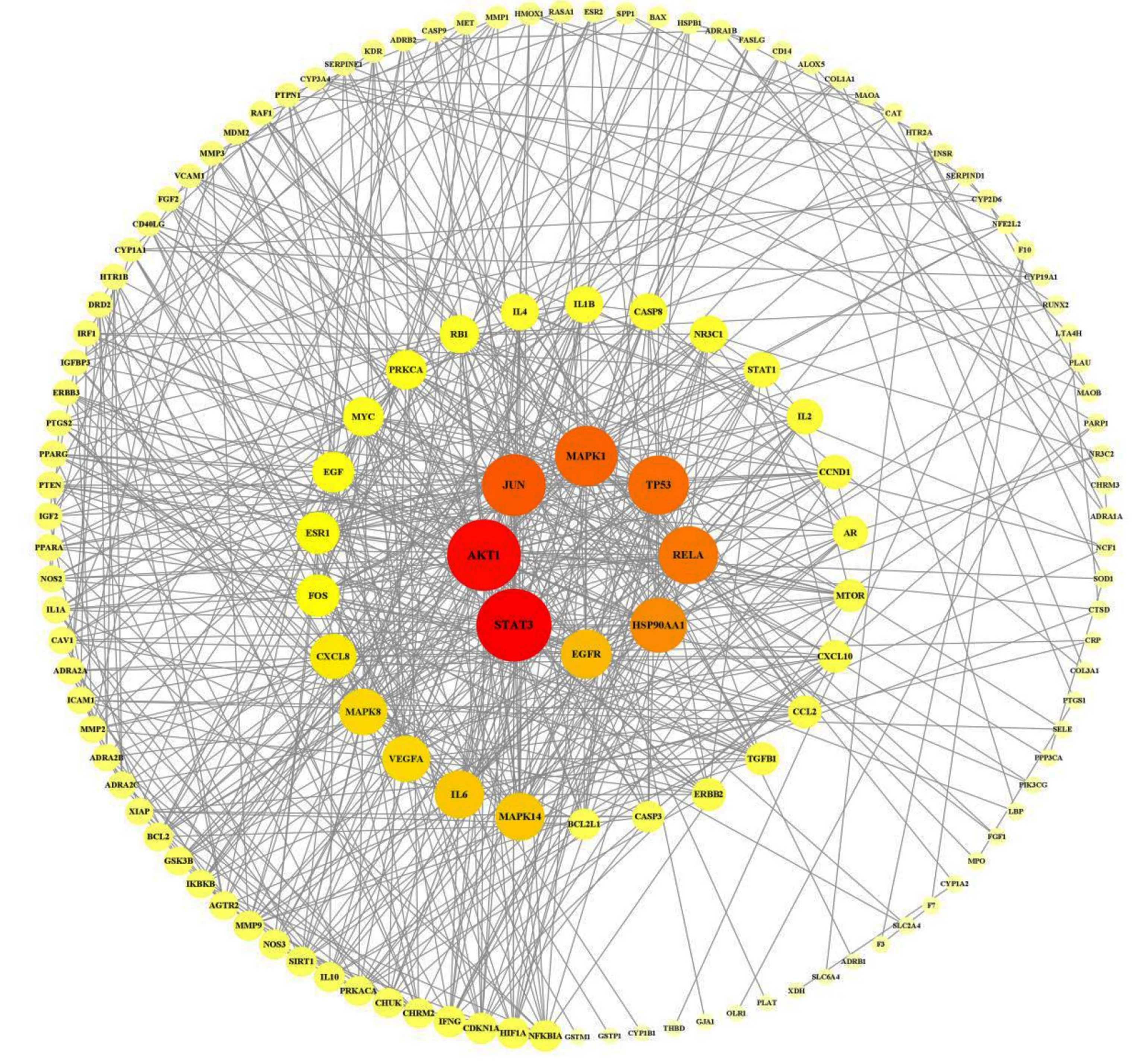
图3 PPI网络图
2.6 GO生物过程及KEGG通路富集分析 利用Metascape平台对158个作用靶点进行GO和KEGG富集分析,选取P值前20位的结果绘制气泡图(见图4~图7)。GO富集结果显示,交集基因与对毒性物质反应、应对受伤、对无机物质的反应等生物学过程,膜筏、膜微结构域、膜区域等细胞组分,蛋白质结构域特异性结合、蛋白激酶绑定、激酶绑定等分子功能关系密切。KEGG富集结果显示,升陷汤治疗冠心病主要涉及晚期糖基化终产物-晚期糖基化终产物受体(AGE-RAGE)、磷脂酰肌醇3-激酶(PI3K)-AKT等几个关键通路。
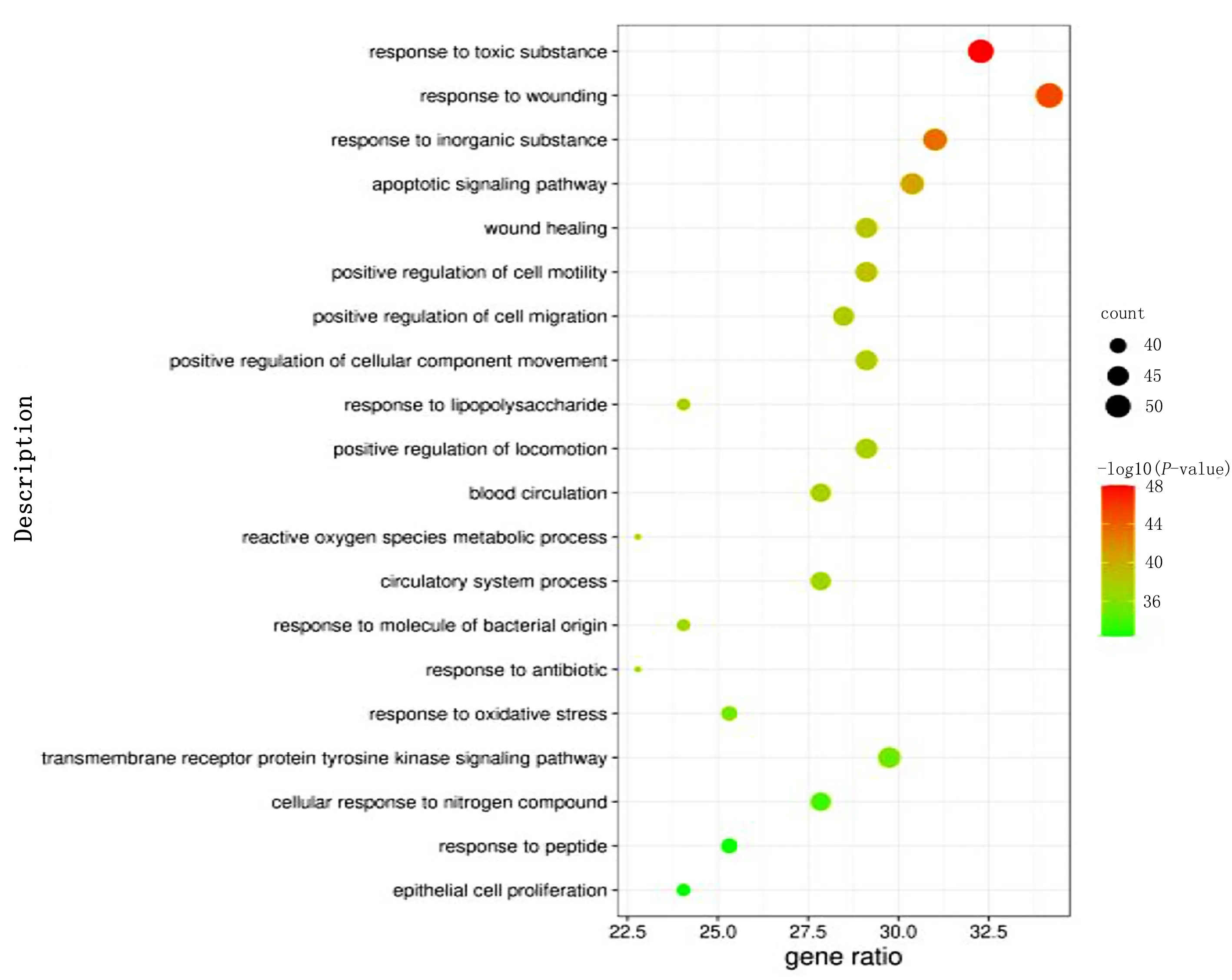
图4 GO 生物过程(BP)分析
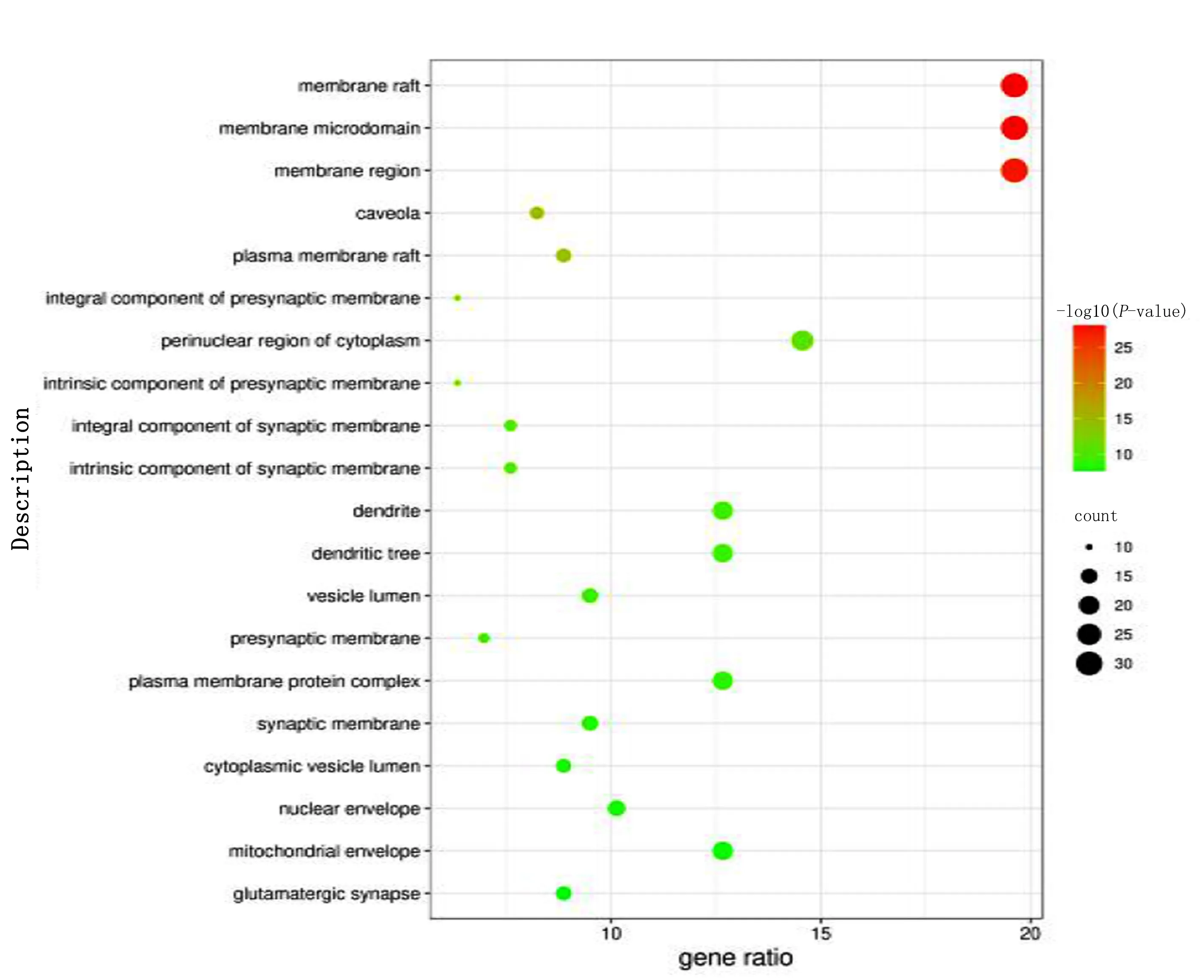
图5 GO细胞组分(CC)分析
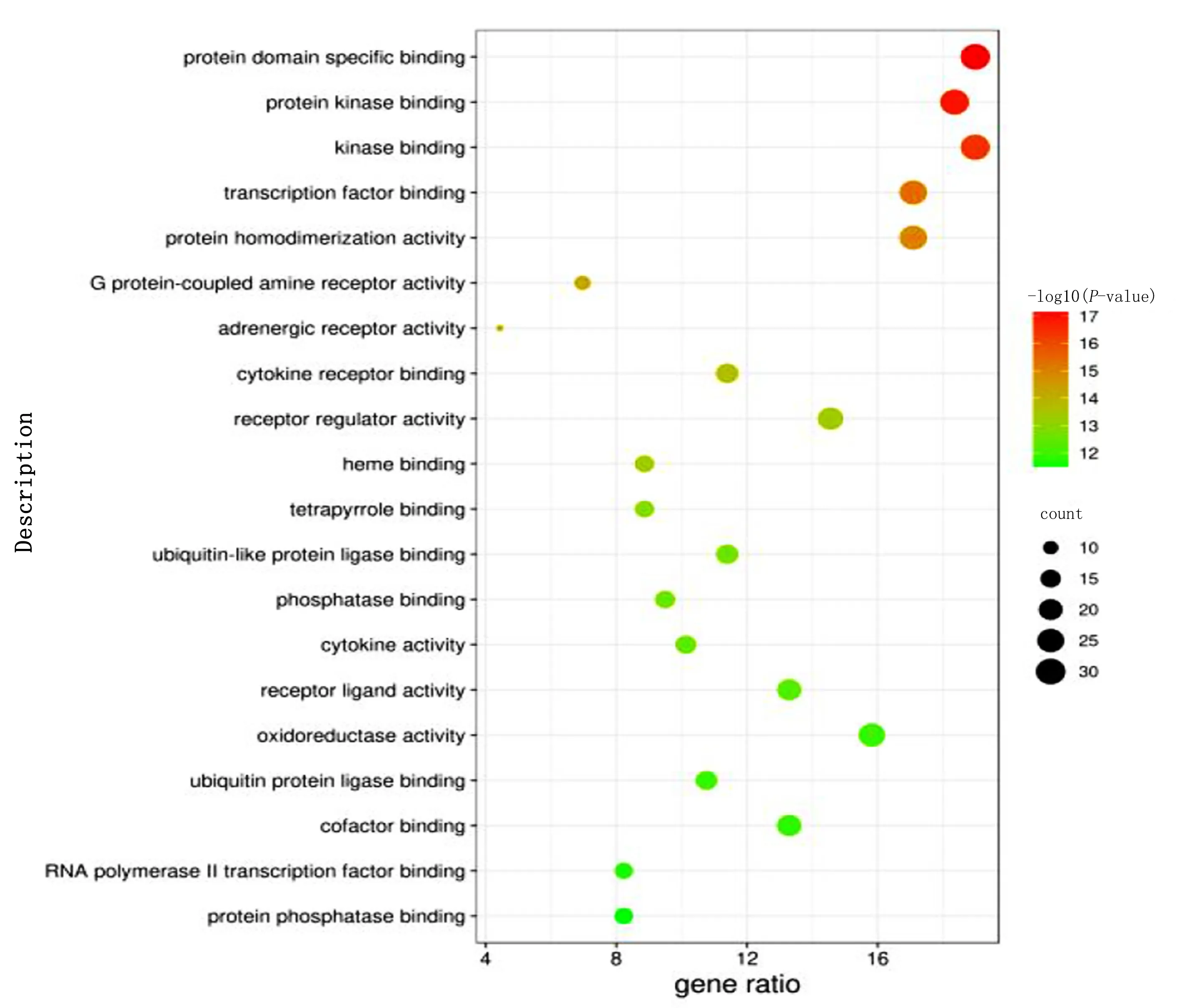
图6 GO分子功能(MF)分析
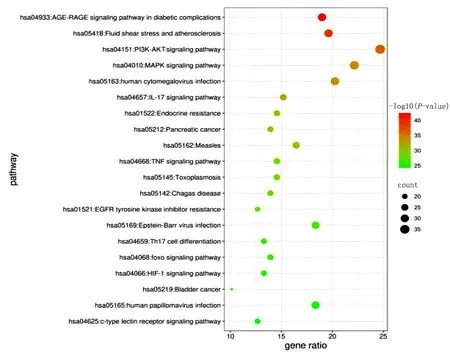
图7 KEGG分析
2.7 分子对接验证 分别选取degree排名前5位的关键活性成分和核心靶点进行分子对接验证。结果显示:关键药效物质与核心靶点的最低结合能均小于-5.0 kcal/mol(-20.9 kJ/mol),25组中19组结合能小于-7.0 kcal/mol(-29.3 kJ/mol),说明二者之间能够稳定的结合[15],详见表3。结合能排在前10位的成分与靶点进行可视化分析,详见图8。
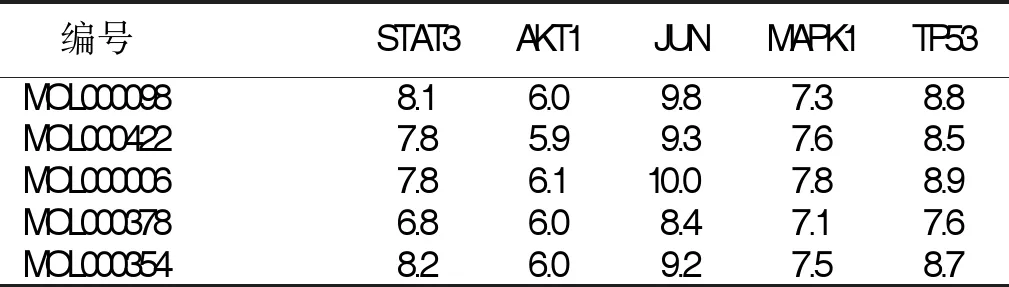
表3 关键药效物质与核心靶点对接的Vina分数 单位:kcal/mol
3 讨 论
升陷汤治疗冠心病的临床疗效显著,机制不甚明确,本研究利用网络药理学方法对其进行探索,结果显示:从46个活性成分中筛选出槲皮素、山奈酚等5个关键活性成分,其中4个为黄酮类化合物;从158个交集靶点中筛选出STAT3、AKT1等5个关键靶点;通过KEGG富集分析筛选出AGE-RAGE等4个关键通路。升陷汤可能通过抗氧化应激、抗炎症反应、抗细胞凋亡等多个机制发挥治疗冠心病的作用。
3.1 关键活性成分分析 升陷汤治疗冠心病的主要成分可能为槲皮素、山奈酚、木犀草素、7-O-甲基异丁香酚、异鼠李素等。其中,槲皮素、山奈酚、木犀草素、异鼠李素均为黄酮类化合物。槲皮素可以抑制低密度脂蛋白(LDL)氧化、抗血小板凝集、保护血管内皮,从而抑制冠状动脉粥样硬化斑块的形成和发展[16];槲皮素还有非内皮依赖性舒张血管的作用,可以改善心肌缺血[17]。山奈酚能够通过沉默调节因子1(SIRT1)介导的线粒体途径,减轻缺氧/复氧对心肌细胞的损伤[18];同时,山奈酚能减弱胶原蛋白诱导的血小板聚集和血小板依赖性血栓形成[19]。木犀草素通过Sp1上调肌浆网/内质网Ca2+-ATP酶-2a(SERCA2a),以减轻小鼠的心肌缺血/再灌注损伤[20]。异鼠李素有抑制巨噬细胞凋亡以减缓动脉粥样硬化斑块发展的作用,其机制与PI3K-AKT通路的激活有关[21]。
3.2 关键靶点结果分析 根据degree值筛选出排名前5位的核心靶点:STAT3、AKT1、JUN、MAPK1、TP53。STAT3参与调控细胞生长、凋亡等进程,抑制其转录活性可减少内皮细胞的增殖、迁移和血管形成,从而延缓易损斑块的进展[22]。AKT1参与调节细胞增殖和炎症反应等过程,有研究表明,AKT1的激活可以抑制缺血缺氧导致的心肌细胞坏死[23];同时,AKT1可以通过调节一氧化氮的生成,发挥舒张血管、保护心肌细胞的作用[24]。JUN转录因子通过调节染色质的可及性改变,激活基因表达程序,从而促进心肌细胞的去分化,增殖和突出进入受损区域,是心肌细胞应对损伤的重要调节因素[25]。MAPK1又称ERK2基因,可促进血管内皮细胞增殖和内皮型一氧化氮合酶(eNOS)的表达,对于维持血管内皮的正常性和完整性有重要作用[26];另有研究表明,ERK2可能通过抑制胰岛素和肿瘤坏死因子-α(TNF-α)诱导的血管细胞黏附分子-1(VCAM-1)的表达,降低糖尿病动脉粥样硬化的风险[27]。TP53作为一种转录因子,可以调节心肌素的表达,抑制TP53介导的心肌素表达从而抑制心肌细胞自噬,减轻心肌缺血/再灌注损伤[28]。
3.3 通路与生物进程分析 GO富集分析结果表明,升陷汤的作用靶点分布于多种细胞结构,以细胞膜上的结构最为显著,这些结构与细胞内外物质转运,特别是胆固醇的转运相关。其中,膜脂质筏与胞内胆固醇流出细胞关系密切,有针对性地调节其功能有潜在的治疗冠心病的效果[29]。升陷汤成分在蛋白质结构域特异性结合、蛋白激酶结合等分子层面发挥作用,并参与多个生物学过程,与机体应激、修复损伤以及细胞凋亡均有关,这与冠心病发病机制中的血管内皮细胞损伤、心肌细胞凋亡等病理、生理特点相契合。
KEGG富集结果显示,升陷汤治疗冠心病主要涉及以下几个信号通路:AGE-RAGE信号通路、流体剪切应力和动脉粥样硬化、PI3K-AKT信号通路、MAPK信号通路。AGEs可通过与其受体RAGE结合,引发氧化应激,并可通过激活核因子-κB(NF-κB)诱导炎症反应和平滑肌增殖,从而造成血管内皮损伤和加速动脉粥样硬化的发展[30]。P13K-AKT是调节细胞增殖的重要通路,激活P13K/AKT/eNOS信号传导保护离体大鼠心脏免受再灌注损伤[31]。MAPK信号通路包括4个级联反应,即p38丝裂原活化蛋白激酶(p38-MAPK)、JNK、ERK1/2和ERK5,主要通过调控细胞生长凋亡、调节氧化应激、炎症反应等途径影响动脉粥样硬化的发展[32]。
3.4 升陷汤治疗冠心病潜在机制分析 根据研究结果推测升陷汤可能通过以下3个机制治疗冠心病。①抗炎症反应:炎性因子的大量分泌是动脉粥样硬化发生发展及斑块破裂的重要机制。木犀草素可以通过抑制p38 MAPK途径减少炎性因子的分泌,也可以通过抑制AKT磷酸化和降低JUN活性发挥抗炎作用。②抗氧化应激:氧化应激产生的ROS可以氧化脂质、蛋白质等大分子物质,并作为第二信使介导细胞信号的传导,有多方面的致动脉粥样硬化的作用。槲皮素、异鼠李素等黄酮类化合物是天然的抗氧化剂,可以清除体内的ROS,并抑制MAPK等介导氧化应激的通路,从而发挥抑制LDL氧化、抗血管内皮损伤、抗平滑肌增殖等作用,抑制动脉粥样硬化斑块发展。③抑制细胞凋亡:异鼠李素可以通过激活PI3K-AKT信号通路,抑制巨噬细胞凋亡,减缓动脉粥样硬化斑块的发展。
综上所述,升陷汤可能主要通过黄酮类活性成分发挥抗冠心病的疗效。升陷汤作用于冠心病发病的各个环节,可发挥抑制动脉粥样硬化斑块进展、抗血小板聚集、舒张血管、保护心肌细胞等多种功能。升陷汤可能主要通过抗氧化应激、抗炎症反应、抑制细胞凋亡等途径达到治疗冠心病的作用。由于忽略了药物剂量和煎服方式等因素对活性成分的影响,且数据库对于成分和靶点预测存在不全面性,故网络药理学存在一定的局限性。本研究结果尚需进一步验证,但无疑为进一步研究该方作用机制提供了线索和依据。

