淫羊藿有效成分治疗乳腺癌作用机制的研究进展
华辞怡,史有阳,谢 颖,刘 胜
淫羊藿有效成分治疗乳腺癌作用机制的研究进展
华辞怡1, 2,史有阳1, 2,谢 颖2,刘 胜1*
1. 上海中医药大学附属龙华医院,上海 200032 2. 上海中医药大学 中医外科研究所,上海 200032
乳腺癌是女性最常见的恶性肿瘤,在我国与发达国家的5年生存率相较仍有差距。淫羊藿作为补肾中药具有悠久的用药历史,现代研究表明淫羊藿及其有效成分(淫羊藿素、淫羊藿苷、淫羊藿次苷II等)具有多途径、多靶点的抗肿瘤特性,是具有研究价值的治疗乳腺癌药物。对淫羊藿及其有效成分抗乳腺癌作用的分子机制进行梳理,从抑制乳腺癌细胞增殖、促进乳腺癌细胞凋亡、抑制乳腺癌侵袭转移、改善乳腺癌免疫微环境、减少耐药抵抗并协同增效以及抑制乳腺癌干细胞增殖等机制角度对淫羊藿的抗乳腺癌作用进行阐述,为淫羊藿有效成分与化学药协同抗乳腺癌交叉机制的深入研究与临床药物制剂的开发应用提供依据。
乳腺癌;淫羊藿;淫羊藿素;淫羊藿苷;淫羊藿次苷II;机制;协同增效
乳腺癌是女性最常见的恶性肿瘤。世界卫生组织国际癌症研究中心数据显示,2020年乳腺癌全球新增人数达226万人。国家癌症中心2022年发布的癌症报告中:乳腺癌依然是国内女性发病率最高的恶性肿瘤,5年生存率为82.0%,与美国等发达国家生存率的90.9%相比仍存在差距[1]。中医药具有多靶点、多途径的整体治疗特点,现代研究已证明其良好的抗肿瘤作用,被广泛应用于临床治疗及基础研究,是突破乳腺癌治疗瓶颈的手段之一。
淫羊藿Maxim.又名仙灵脾,为小檗科(Berberidaceae)淫羊藿属Linn.多年生草本植物。最初记载于《神农本草经》,其味辛、甘,性温,归肾、肝经,具有补肾阳、强筋骨、祛风湿的作用,是常用补肾中药。《本草纲目》记载:“味甘气香,性温不寒,能益精气。真阳不足者宜之”。现代药理研究证明,淫羊藿及其有效成分具有强心[2],调节免疫[3]、骨代谢[4]与内分泌[5],抗抑郁[6]以及抗肿瘤[7]等作用,且能多靶点、多途径作用于多种癌症,尤其是肝癌、乳腺癌的治疗等。本文对淫羊藿有效成分抗乳腺癌的分子机制进行综述,为深入淫羊藿有效成分治疗乳腺癌的基础研究,特别是与现代医疗手段结合协同抗肿瘤的研究,与临床药物制剂的开发及给药方式提供依据。
1 有效成分
淫羊藿含有多种有效成分包括黄酮、多糖、生物碱等,其中黄酮类化合物包含淫羊藿苷、淫羊藿素、淫羊藿次苷II等,均具有相同的黄酮母核,仅有糖基连接位置、糖基种类、糖基数目的差异[8],为目前文献报道淫羊藿中具有显著抗乳腺癌作用的有效成分。
淫羊藿苷是从淫羊藿中提取的主要活性单体成分,口服吸收率低,生物利用度只有12%[9],极易水解生成淫羊藿次苷I、淫羊藿次苷II和淫羊藿素等脱糖产物,其效应主要通过代谢成淫羊藿素后发挥。淫羊藿素亦有文献称为脱水淫羊藿素(anhydroicaritin,AHI),是一种8-异戊烯黄酮类化合物,易与β-anhydroicaritin混淆,二者分子式相同,化学结构不同,实验研究以淫羊藿素为主,本文后续讨论的AHI即为淫羊藿素。淫羊藿素由淫羊藿苷经纤维素酶水解而成,是淫羊藿经消化吸收后的主要代谢产物[10]。淫羊藿素(阿可拉定)软胶囊已完成临床III期实验(NCT02496949、NCT01972672、NCT03236636),获得国家药品监督管理局批准,作为我国原创中药一类新药,用于肝癌治疗,于2022年上市,乳腺癌相关研究正在进行。淫羊藿次苷II又称为宝藿苷I,是由淫羊藿苷水解的次级糖苷化合物,具有抗乳腺癌作用。以上主要活性成分相关信息见表1,化学结构见图1。
表1 淫羊藿中具有抗乳腺癌作用的主要黄酮类化合物
Table 1 Information of main flavonoids in Epimedii Foliumwith anti-breast cancer effects
化合物名称分子式相对分子质量CAS号 淫羊藿苷C33H40O15676.70489-32-7 淫羊藿素C21H20O6368.38118525-40-9 β-anhydroicaritinC21H20O6368.3838226-86-7 淫羊藿次苷IIC27H30O10514.53113558-15-9
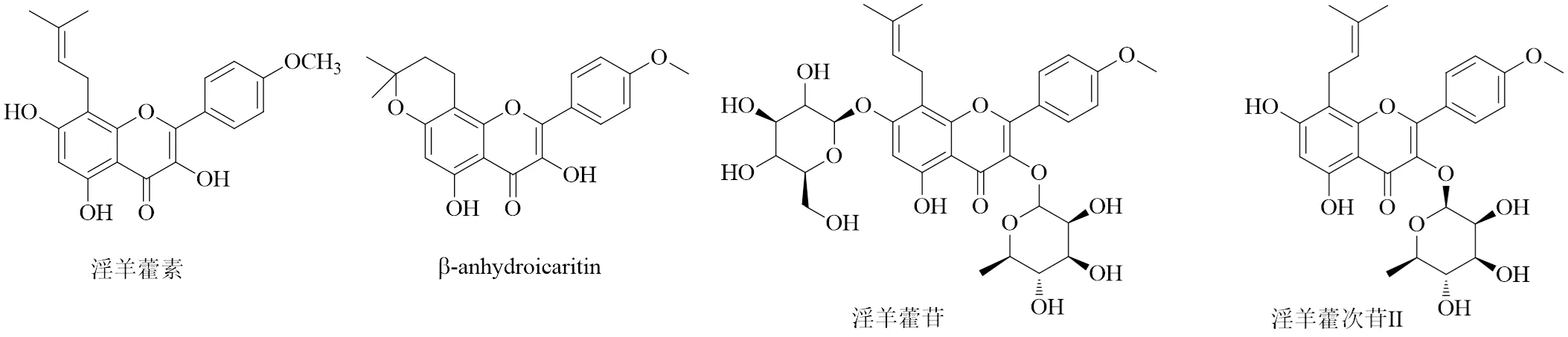
图1 淫羊藿中具有抗乳腺癌作用主要黄酮类化合物的化学结构
2 作用机制
2.1 抑制乳腺癌细胞增殖
肿瘤细胞具有无限增殖特性,抑制乳腺癌细胞增殖是治疗策略之一。淫羊藿苷、淫羊藿素的结构与雌二醇(estradiol,E2)相似,能产生雌激素受体(estrogen receptor,ER)样及抗ER的双重作用,具有一定的选择性雌激素受体调节剂特性,对ER阳性乳腺癌MCF-7细胞有明显增殖抑制作用,同时可拮抗雌激素对其的增殖[11-12],且此双重作用与剂量相关。1 nmol/L~1 μmol/L淫羊藿素通过增加乳腺癌T47D细胞及MCF-7细胞内ERα、ERβ蛋白而促进其增殖[7,13]。当淫羊藿素浓度高于1 μmol/L时,则抑制基因的表达而抑制雌激素诱导的MCF-7细胞增长[14-15];2~5 μmol/L淫羊藿素通过诱导细胞外信号调节激酶的持续活化,下调G2/M周期相关调节蛋白细胞周期蛋白B(cyclin B)、细胞分裂周期蛋白(cell division cycle,cdc)2和cdc25的表达使MCF-7细胞停滞在G2/M期以抑制其增殖[14]。三阴性乳腺癌(triple negative breast cancer,TNBC)是乳腺癌的一种亚型,因缺乏ER、孕激素和人表皮生长因子受体2(epidermal growth factor receptor 2,EGFR2)的表达,治疗手段局限,且复发率更高、总生存期更短[16-17]。淫羊藿素能诱导TNBC MDA-MB-453细胞凋亡并抑制增殖[14],提示除依赖ER通路,淫羊藿素能通过多种机制交互发挥抗乳腺癌作用。
2.2 促进乳腺癌细胞凋亡
细胞凋亡是由基因调控的自发死亡过程,对抑制肿瘤发展具有重要作用,淫羊藿有效成分主要通过多种途径促进乳腺癌细胞凋亡。淫羊藿素在不同分子分型的乳腺癌细胞中诱导不同的细胞死亡模式:淫羊藿素处理TNBC细胞后使膜联蛋白V阳性的细胞增加,诱导MDA-MB-435细胞凋亡;而ER阳性乳腺癌细胞经淫羊藿素处理后因膜联蛋白V阴性/PI阳性的细胞增加而被诱导坏死[14]。淫羊藿苷通过升高MDA-MB-231细胞中促凋亡蛋白B淋巴细胞瘤-2基因(B-cell lymphoma-2,Bcl-2)相关X蛋白(Bcl-2-associated X protein,Bax)的表达和降低抗凋亡蛋白Bcl-2与DNA修复酶聚腺苷二磷酸核糖聚合酶(poly ADP-ribose polymerase,PARP)的表达促进TNBC细胞凋亡[18]。淫羊藿苷还可靶向线粒体途径促进活性氧的产生诱导凋亡,且对正常乳腺细胞无明显毒性[19]。淫羊藿素能激活半胱氨酸蛋白酶-3(cysteinyl aspartate specific proteinase-3,Caspase-3)诱导MDA-MB-231细胞凋亡[20]。淫羊藿次苷II增强由Fas/Fas相关死亡域蛋白(Fas/Fas-associated with death domain protein,Fas/FADD)通路介导的内源性途径和由线粒体膜间隙蛋白细胞色素C和细胞凋亡诱导因子释放介导的外源性通路诱导凋亡[21]。ERα36与EGFR形成正调节环,促进TNBC细胞的恶性生长[22]。Wang等[23]研究表明,淫羊藿素通过降低ERα36和EGFR蛋白的表达,诱导TNBC细胞凋亡,体外研究发现淫羊藿素能抑制ERα36介导的丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)/细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路和雌激素对cyclin D1的诱导,减弱cyclin D1的表达。脂质代谢是肿瘤靶向治疗的研究重点,硬脂酰辅酶A去饱和酶-1(stearyl coenzyme A dehydrogenase-1,SCD-1)对乳腺癌细胞的生长增殖具有重要作用。金忆媛[24]基于计算机模拟将淫羊藿素合成为一种新型SCD-1抑制剂IC2,通过抑制SCD-1的表达以及酶活性,降低细胞内单不饱和脂肪酸的含量发挥抗乳腺癌作用,并通过激活AMP依赖的蛋白激酶(AMP-activated protein kinase,AMPK)诱导细胞自噬,靶向线粒体途径启动MAPK介导的细胞凋亡而抑制MCF-7细胞、乳腺癌SK-BR-3细胞和MDA-MB-231细胞的增殖。AMPK参与调节自噬和凋亡之间的相互作用,MAPK家族介导的信号通路诱导细胞发生凋亡。
2.3 抑制乳腺癌细胞侵袭转移
肿瘤转移是乳腺癌治疗失败的原因之一。上皮间-充质转化(epithelial-mesenchymal transition,EMT)是肿瘤恶性表型转化的启动过程,为乳腺癌发生转移的重要机制。淫羊藿苷通过下调磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB/Akt)信号通路抑制表皮生长因子所诱导的EMT过程[25]。淫羊藿苷还可靶向沉默调节蛋白6(Sirtuin 6,SIRT6)/核因子-κB(nuclear factor-κB,NF-κB)/EMT通路抑制MDA-MB-231细胞的迁移和侵袭[19]。淫羊藿素能显着上调乳腺癌中谷胱甘肽过氧化酶1(glutathione peroxidase 1,GPX1)的表达,有效抑制EMT进展从而发挥抗乳腺癌作用[26]。淫羊藿素抑制EMT的机制可能与增强GPX1、上皮型钙黏附蛋白(E-cadherin,E-cad)和剪切型Caspase-3的表达,抑制神经型钙黏附蛋白(N-cadherin,N-cad)、波形蛋白和Ki-67的表达有关[26]。GPX1在乳腺癌中的表达低于在正常乳腺组织中的表达[27]。乳腺癌中GPX1表达水平低的患者比GPX1表达水平高的患者具有更长的总生存期和无病生存期。趋化因子(C-X-C 基元)受体4[chemokine (C-X-C motif) receptor 4,CXCR4]是趋化因子(C-X-C基元)配体12[chemokine (C-X-C motif) ligand 12,CXCL12]/基质细胞衍生因子1α(stromal cell derived factor 1α,SDF1α)的Gi蛋白偶联受体,已知在各种肿瘤中均有表达。CXCL12/CXCR4轴已成为肿瘤转移的关键介质。淫羊藿次苷II作为CXCR4表达的调节剂,通过下调CXCR4表达水平与抑制CXCL12诱导的乳腺癌细胞侵袭而发挥抗转移作用[28]。
2.4 改善肿瘤免疫微环境
肿瘤免疫微环境与乳腺癌的进展密切联系,动态调控乳腺癌的发生、发展及转移。肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)起到促进癌细胞转移和侵袭的重要作用,分为M1和M2 2种极化表型即抗肿瘤M1样和促肿瘤M2样极化TAMs[29]。健康组织中巨噬细胞的M1和M2表型处于平衡状态,癌组织中则向M2型极化。淫羊藿苷在体内和体外通过下调血管内皮生长因子(vascular endothelial growth factor,VEGF)和上调E-cad以及促进M2细胞向M1极化表型转变以抑制MDA-MB-231细胞的血管拟态形成和转移,其作用机制可能是通过抑制M2细胞中PI3K、Akt、mTOR蛋白的磷酸化实现的[18]。骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)是一组骨髓细胞,由造血祖细胞、巨噬细胞、树突细胞和粒细胞的前体组成,介导肿瘤相关免疫抑制反应。Zhou等[30]发现淫羊藿苷和淫羊藿素能显著延缓4T1-Neu乳腺肿瘤荷瘤小鼠的肿瘤生长,降低小鼠体内MDSCs的百分比,并恢复脾脏中的CD8+T细胞功能。体外实验发现淫羊藿素下调MDSCs中的S100钙结合蛋白A8/9(S100 calcium-binding protein A8/9,S100A8/9)、信号转导因子和转录激活因子3(signal transducer and activator of transcription 3,STAT3)和Akt,导致MDSCs细胞分化为树突状细胞和巨噬细胞。同时淫羊藿苷显著增加肿瘤浸润CD4+和CD8+T细胞比例并下调肿瘤中MDSCs比例,以缓解肿瘤免疫抑制微环境,增强抗肿瘤作用[19]。程序性死亡受体-配体1(programmed death-ligand 1,PD-L1)/程序性死亡受体-1(programmed death 1,PD-1)通路是免疫治疗中最关键的免疫检查点[31]。转移性乳腺癌对靶向PD-L1和PD-1的人源化单克隆抗体的治疗有反应[32]。NF-κB激酶α(NF-κB kinaseα,IKKα)被确定为淫羊藿素的蛋白靶点,通过阻断IKKα/β复合物的形成,抑制NF-κB p65易位,下调肝肿瘤细胞和免疫抑制细胞中PD-L1的表达,从而增强免疫治疗的效果,淫羊藿素与PD-L1相关性研究在乳腺癌中尚未进行[33]。
2.5 协同增效及耐药抵抗作用
放化疗耐药是导致乳腺癌治疗效果不佳的主要因素之一,淫羊藿有效成分可抵抗耐药并与放化疗结合以协同增效。淫羊藿素能增强4T1细胞的放射敏感性[34]。自噬作为一种保护性反应使肿瘤细胞免受化疗药物诱导的细胞凋亡。Cheng等[35]建立MCF-7/他莫昔芬(tamoxifen,TAM)细胞株证明淫羊藿苷可以通过抑制自噬来逆转MCF-7细胞对TAM的耐药。淫羊藿素抗乳腺癌作用优于TAM,能抑制乳腺癌干细胞对TAM耐药,与TAM共处理时观察到显著的累加效应[14]。ERα36在ER阳性乳腺癌的抗雌激素药物耐药和ER阴性乳腺癌的化疗耐药中发挥作用[36]。ERα36介导的快速雌激素信号转导旁路激活Akt信号通路是TNBC细胞对EGFR靶向治疗产生耐药性的机制之一,淫羊藿素能下调ERα36的表达并抑制E2β刺激的Akt磷酸化,与EGFR抑制剂西妥昔单抗联合使用下更有效抑制TNBC细胞的增殖并促进凋亡[37]。顺铂耐药是TNBC化疗效果不佳的原因之一。淫羊藿素联合顺铂较单用顺铂对MDA-MB-231细胞及MDA-MB-231/顺铂耐药株的增殖、侵袭抑制作用和凋亡诱导作用更明显,且淫羊藿素的增敏作用可能与ERK1/2相关通路的抑制及p-p53蛋白的激活有关[38]。淫羊藿苷经脱糖、脂肪性环醚的引入等结构处理后合成10个不同结构的衍生物,进行MCF-7/阿霉素(adriamycin,ADR)耐药株及敏感株MCF-7体外逆转肿瘤多药耐药性测试发现淫羊藿苷衍生物在低、中、高剂量下均可以不同程度地提高MCF-7/ADR及MCF-7对ADR的敏感性,其机制与P-糖蛋白功能的抑制和多药耐药基因多药耐药基因的表达下调有关[39]。
2.6 抑制乳腺癌干细胞增殖
乳腺癌干细胞具有多向分化、高致瘤性和对放化疗耐药的特性,与乳腺癌的复发、转移密切相关。乙醛脱氢酶(aldehyde dehydrogenase class,ALDH)高的乳腺癌细胞表现出干细胞/祖细胞特性并显示出增加的转移潜能[40]。淫羊藿素可优先靶向抑制ALDH高表达乳腺癌干/祖细胞生长,并抑制ALDH低表达乳腺癌细胞生长[14]。通过网络药理学探寻淫羊藿干预乳腺癌干细胞的潜在靶点,发现淫羊藿有效成分能够协同作用于乳腺癌干细胞的目标差异表达基因,并通过下调转化生长因子-β(transforming growth factor -β,TGF-β)通路中关键分子TGF-β R1及下游信号Smad2蛋白的表达水平[41],为后续进一步实验研究提供基础。
淫羊藿有效成分主要通过以上几种机制发挥治疗乳腺癌的作用,其活性成分作用及机制见表2。
3 结语与展望
淫羊藿作为治疗乳腺癌的常用中药,具有温肾助阳、调摄冲任的功效,临床常以复方形式高频率入药。中医称乳腺癌为“乳岩”,最早见于《校注妇人良方》。“正气亏虚”是其发生发展的根本,《医宗必读·积聚》谓:“积之成者,正气不足,而后邪气踞之”。中医外科认为,乳腺癌发生主要由于内在正气长期不足,加之六淫内侵,肝脾气郁,冲任不和从而脏腑功能失调,导致气滞血瘀、痰凝、邪毒互结。结合现代社会背景,乳腺癌多属脾肾两虚,患者多年老肾气亏虚,脾胃功能下降,先天与后天的不足导致抵抗力下降,加以情志不舒及内分泌、免疫功能异常合而发病。尤其是ER阳性乳腺癌经长期内分泌治疗后多表现为潮热、盗汗、腰膝酸软等肾虚表现,淫羊藿“能益气力、强志”与此病机相互契合。目前,乳腺癌的治疗手段包括手术切除、化疗、放疗、靶向治疗、内分泌治疗以及免疫治疗等,患者接受以上治疗后依然存在复发和转移的风险,导致其生存率和预后情况不容乐观。淫羊藿作为补肾中药被证明具有多靶点、多途径的广谱抗肿瘤作用。现有研究表明,淫羊藿中的有效成分淫羊藿素、淫羊藿苷以及淫羊藿次苷II等可以通过多种机制直接抑制乳腺癌细胞增殖并诱导其凋亡,改善乳腺癌免疫微环境,减少耐药抵抗以及协同增效,尤其在抑制乳腺癌干细胞增殖与防止转移方面具有可探究性,同时作为补肾扶正类中药,通过补益正气改善机体抗肿瘤免疫功能,因此淫羊藿与西医结合可以起到协同抗乳腺癌的作用。
表2 淫羊藿有效成分治疗乳腺癌的作用及机制
Table 2 Effects and mechanisms of active components of Epimedii Folium in treatment of breast cancer
成分实验类型及剂量作用及机制文献 体外体内/(mg·kg−1) 淫羊藿苷T47D细胞:1×10−9~1×10−6 mol·L−1(1×10−7 mol·L−1)—上调ERα和ERβ的表达产生促细胞增殖;增加S期和G2/M细胞的比例,促进细胞增殖 7 MCF-7细胞:5~200 μg·mL−1—抑制细胞增殖并诱导凋亡;拮抗雌激素诱导下的细胞增殖11 MCF-7细胞:10~100 μmol·L−1—抑制细胞增殖;下调PI3K/Akt信号通路抑制EGF所诱导的EMT过程25 MCF-7/MCF-7+TAM细胞、T47D/T47D+TAM细胞:10~75μmol·L−1—抑制细胞增殖;抑制MCF-7/TAM耐药株对TAM耐药;诱导细胞周期G0/G1期阻滞和细胞凋亡,并抑制自噬;剪切型Caspase-3和PARP的表达水平升高,抗凋亡蛋白Bcl-2下调35 MDA-MB-231细胞:10~80μmol·L−1小鼠:40、80、160升高Bax的表达,降低Bcl-2与PARP的表达促进细胞的凋亡;下调VEGF和上调E-cad以抑制细胞的血管拟态形成;促进M2细胞向M1极化表型转变以抑制细胞的转移;抑制M2细胞中PI3K、Akt、mTOR蛋白的磷酸化18 MDA-MB-231细胞、MDA-MB-453/4T1细胞、MCF-10A细胞:0~20 μmol·L−1小鼠:20、40上调剪切型Caspase-3和Bax的表达水平,下调Bcl-2的表达水平,增加Bax/Bcl-2值,促进活性氧产生诱导凋亡;对正常乳腺癌细胞无明显毒性;通过SIRT6/NF-κB/EMT信号通路抑制细胞迁移;增加肿瘤浸润CD4+和CD8+T细胞比例;下调肿瘤中MDSCs比例19 —小鼠:100降低体内MDSCs的百分比;恢复脾脏中的CD8+T细胞功能30 淫羊藿素T47D细胞:1×10−9~1×10−7 mol·L−1(1×10−7 mol·L−1)—上调ERα和ERβ的表达产生促细胞增殖;增加S期和G2/M细胞的比例,促进细胞增殖 7 MCF-7细胞:0.01~10 μmol·L−1小鼠:10 μmol·kg−1靶向AhR的蛋白酶体降解,降解ERα蛋白,抑制乳腺癌细胞增殖13 MCF-7细胞:1×10−10~1×10−5 mol·L−1—单独作用促进细胞增殖;与雌激素联合抑制ERα基因表达与细胞增殖15 MCF-7细胞:1×10−10~1×10−4mol·L−1—抑制E2诱导的细胞增殖;激动AhR靶基因细胞色素P450 1A1的表达;具有ERα激动作用;与E2联用激活AhR介导蛋白酶体途径使ERα蛋白降解,抑制细胞增殖42 MCF-7细胞、MDA-MB-453细胞:0~5 μmol·L−1—诱导细胞周期停滞在G2/M期,下调G2/M调节蛋白(cyclin B、cdc2和cdc25C)的表达水平;下调PARP和Bcl-2表达,诱导凋亡细胞死亡;诱导ERK的持续磷酸化;抑制乳腺癌干/祖细胞生长;抑制乳腺癌干细胞对TAM耐药14 MCF-7细胞:0~50 μmol·L−1、MDA-MB-231细胞:0~20 μmol·L−1—抑制细胞的增殖和迁移;诱导细胞周期停滞;激活Caspase-3诱导细胞凋亡20
续表2

成分实验类型及剂量作用及机制文献 体外体内/(mg·kg−1) 淫羊藿素MCF-7/4T1细胞、MDA-MB-231细胞:0~25 µmol·L−1—抑制细胞增殖;抑制电离辐射诱导的ERK1/2和Akt的激活;诱导G2/M细胞周期阻滞,增强IR杀伤效果;与IR协同增强细胞凋亡34 MDA-MB-231细胞、MDA-MB-453细胞:0~20 μmol·L−1—降低ERα36和EGFR蛋白的表达,诱导细胞凋亡;抑制ERα36介导的MAPK/ERK通路和雌激素对cyclin D1的诱导,减弱周期蛋白D1的表达,抑制细胞增殖23 MDA-MB-231细胞、MDA-MB-436细胞:1~100 μg·mL−1小鼠:50下调ERα36的表达并抑制E2β刺激的Akt磷酸化;与EGFR抑制剂西妥昔单抗联合使用抑制细胞增殖并促进凋亡36 MDA-MB-231细胞、MDA-MB-231细胞+顺铂:1.5~5 µmol·L−1—抑制细胞增殖;抑制MDA-MB-231/顺铂耐药细胞增殖;与顺铂联用后抑制细胞侵袭并诱导凋亡更显著;与顺铂联用后p-ERK1/2蛋白表达降低、p-p53蛋白表达升高更显著38 —小鼠:100降低体内MDSCs的百分比;恢复脾脏中的CD8+T细胞功能;下调MDSCs中的S100A8/9、STAT3和Akt;使MDSCs细胞分化为树突状细胞和巨噬细胞30 4T1/MDA-MB-231细胞:0~160 μmol·L−1小鼠:20增强GPX1、E-cad和剪切型Caspase-3的表达,抑制N-cad、波形蛋白和Ki-67的表达而抑制EMT过程26 淫羊藿次苷IIMCF-7/MDA-MB-231细胞:25~75 μmol·L−1—增强Fas/FADD通路介导的内源性途径和线粒体膜间隙蛋白细胞色素C和细胞凋亡诱导因子释放介导的外源性通路诱导细胞凋亡21 MDA-MB-231细胞:0~25 μmol·L−1—下调CXCR4表达水平与抑制CXCL12诱导的侵袭28 IC2MCF-7/SK-BR-3/MDA-MB-231细胞:0~20 μmol·L−1—抑制SCD-1的表达以及酶活性,降低细胞内单不饱和脂肪酸的含量;激活AMPK诱导细胞自噬,靶向线粒体途径启动MAPK介导的细胞凋亡;抑制细胞增殖24
尽管对淫羊藿及其有效成分在抗乳腺癌机制的研究中不断深入,并与临床疗效相符合,但仍有不足:(1)淫羊藿有效成分复杂。中药成分的复杂性以及炮制煎煮后的化学结构改变对抗乳腺癌有不同程度的作用改变,通过网络药理及生物信息学对其活性成分进行挖掘与联结,确定有效成分及目标靶点是未来选择方向的途径之一。(2)对已有靶点和成分的抗乳腺癌研究较少且研究对象较为局限。在细胞系与动物模型实验的基础上,运用类器官以及悬浮培养方式动态观察其抗乳腺癌作用以及肿瘤微环境的时效性改变。(3)淫羊藿能多途径治疗乳腺癌,且具有逆转耐药或增敏作用,尝试探索与化学药联用的协同增效是深入研究的方向。ER阳性乳腺癌与雌激素有密切关系,部分ER阳性的乳腺癌能最终发展为激素治疗抵抗性肿瘤,淫羊藿的雌激素双重调节作用类似于TAM,对乳腺癌的治疗具有重要意义。淫羊藿素作为芳香烃受体(arylhydrocarbon receptor,AhR)的激动剂能激活AhR介导的蛋白酶体途径使ERα蛋白降解以降低雌激素的反应活性,从而抑制激素依赖性肿瘤[15,42-43],提示其多途径、多靶点交叉通路特性能与现有治疗手段相互交叉干预,是增加乳腺癌中西结合治疗途径之一。(4)新型药物制剂的开发及给药方式的优化使药效最大化。目前制剂主要形式为胶囊,经肠肝循环后生物利用度减弱,开发能直接作用于靶点的新型制剂发挥最大药效是必要途径。Wang等[44]将含水淫羊藿素制备成具有良好稳定性和高载药量的纳米棒,克服其不溶于水而难以在体内有效传递的问题,通过静脉给药增强通透性和滞留效应实现被动靶向,达到与紫杉醇注射相似的抗肿瘤效果。Liu等[45]合成靶向CD44、生物素和叶酸的两亲聚合物寡聚透明质酸-腙键-叶酸-生物素药物载体,将淫羊藿苷和姜黄素2种抗癌药物联合直接靶向乳腺癌细胞及其干细胞,促进凋亡并抑制其侵袭,降低耐药性。因此,淫羊藿及其有效成分对乳腺癌的抑制作用在防复发转移过程中与化学药联合的交叉通路机制值得深入研究,同时开发能使药效最大化的新制剂也是未来趋势,为临床淫羊藿与西药联合治疗乳腺癌的协同增效性提供新方向。
利益冲突 所有作者均声明不存在利益冲突
[1] Zheng R S, Zhang S W, Zeng H M,. Cancer incidence and mortality in China, 2016 [J]., 2022, 2(1): 1-9.
[2] 王英军, 孙英莲, 唐炜, 等. 淫羊藿总苷对实验动物心血管系统的影响 [J]. 中草药, 2007, 38(1): 97-99.
[3] 孙奕, 王景明, 骆永珍. 淫羊藿总黄酮促进免疫功能低下小鼠IL-2和NK活性的实验研究 [J]. 中草药, 2002, 33(7): 635-637.
[4] 蔡国雄, 曾意荣, 曾建春. 淫羊藿苷基于ERα-Wnt/β-catenin信号通路对骨质疏松大鼠成骨分化的影响及机制研究 [J]. 中医临床研究, 2018, 10(11): 1-4.
[5] 孟宪丽, 张艺, 李建亚, 等. 淫羊藿总黄酮对老年大鼠神经内分泌免疫调节作用的研究 [J]. 中药药理与临床, 1998, 14(4): 10-11.
[6] 钟海波, 潘颖, 孔令东. 淫羊藿提取物抗抑郁作用研究 [J]. 中草药, 2005, 36(10): 1506-1510.
[7] 王洁, 陈花, 买迪娜, 等. 淫羊藿苷和淫羊藿素对乳腺癌T47D细胞增殖的影响 [J]. 中草药, 2013, 44(11): 1470-1475.
[8] 欧阳慧子, 何俊. 淫羊藿化学成分分析及其药代动力学研究进展 [J]. 天津中医药大学学报, 2019, 38(3): 219-227.
[9] 赖丽娟, 谢佳丽, 黄志华. 淫羊藿素的抗肿瘤作用及机制研究进展 [J]. 中药药理与临床, 2016, 32(6): 235-238.
[10] Zhou M, Zheng W, Sun X G,. Comparative analysis of chemical components in different parts ofHerb [J]., 2021, 198: 113984.
[11] 郭莉, 张娴, 柴生颋, 等. 淫羊藿苷对人乳腺癌MCF-7细胞增殖、凋亡作用的实验研究 [J]. 辽宁中医杂志, 2015, 42(3): 643-645.
[12] 王晓稼. 植物雌激素与乳腺癌研究进展 [J]. 国外医学: 肿瘤学分册, 2004, 31(1): 57-60.
[13] Tiong C T, Chen C, Zhang S J,. A novel prenylflavone restricts breast cancer cell growth through AhR-mediated destabilization of ERα protein [J]., 2012, 33(5): 1089-1097.
[14] Guo Y M, Zhang X T, Meng J,. An anticancer agent icaritin induces sustained activation of the extracellular signal-regulated kinase (ERK) pathway and inhibits growth of breast cancer cells [J]., 2011, 658(2/3): 114-122.
[15] 胡蕾蕾, 段小群, 卢曦, 等. 淫羊藿素对雌激素依赖性乳腺癌MCF-7细胞作用的影响 [J]. 中国实验方剂学杂志, 2012, 18(14): 155-158.
[16] Sørlie T, Perou C M, Tibshirani R,. Gene expression patterns of breast carcinomas distinguish tumor subclasses with clinical implications [J]., 2001, 98(19): 10869-10874.
[17] Abramson V G, Lehmann B D, Ballinger T J,. Subtyping of triple-negative breast cancer: Implications for therapy [J]., 2015, 121(1): 8-16.
[18] 申培博. 淫羊藿苷对肿瘤微环境巨噬细胞极化表型的影响及抗乳腺癌转移作用研究 [D]. 济南: 山东大学, 2021.
[19] Song L J, Chen X, Mi L,. Icariin-induced inhibition of SIRT6/NF-κB triggers redox mediated apoptosis and enhances anti-tumor immunity in triple-negative breast cancer [J]., 2020, 111(11): 4242-4256.
[20] Tao C C, Wu Y, Gao X,. The antitumor effects of icaritin against breast cancer is related to estrogen receptors [J]., 2021, 21(1): 73-85.
[21] 黄朝情. 淫羊藿次苷Ⅱ抗乳腺癌机制研究[D]. 北京: 北京协和医学院, 2012.
[22] Zhang X T, Kang L G, Ding L,. A positive feedback loop of ER-α36/EGFR promotes malignant growth of ER-negative breast cancer cells [J]., 2011, 30(7): 770-780.
[23] Wang X, Zheng N, Dong J,. Estrogen receptor-α36 is involved in icaritin induced growth inhibition of triple-negative breast cancer cells [J]., 2017, 171: 318-327.
[24] 金忆媛. 淫羊藿素衍生物IC2通过抑制SCD-1诱导乳腺癌细胞自噬和凋亡 [D]. 无锡: 江南大学, 2021.
[25] 王梦欣, 万言, 梁至洁, 等. 淫羊藿苷对表皮生长因子诱导的乳腺癌细胞MCF-7上皮间质化调控过程的影响 [J]. 中华中医药杂志, 2021, 36(5): 2545-2549.
[26] Li F F, Shi Y Y, Yang X J,. Anhydroicaritin inhibits EMT in breast cancer by enhancing GPX1 expression: A research based on sequencing technologies and bioinformatics analysis [J]., 2021, 9: 764481.
[27] Król M B, Galicki M, Grešner P,. Theandgene expression level in human malignant and non-malignant breast tissues [J]., 2018, 65(1): 51-57.
[28] Kim B, Park B. Baohuoside I suppresses invasion of cervical and breast cancer cells through the downregulation of CXCR4 chemokine receptor expression [J]., 2014, 53(48): 7562-7569.
[29] Jayasingam S D, Citartan M, Thang T H,. Evaluating the polarization of tumor-associated macrophages into M1 and M2 phenotypes in human cancer tissue: Technicalities and challenges in routine clinical practice [J]., 2019, 9: 1512.
[30] Zhou J M, Wu J F, Chen X H,. Icariin and its derivative, ICT, exert anti-inflammatory, anti-tumor effects, and modulate myeloid derived suppressive cells (MDSCs) functions [J]., 2011, 11(7): 890-898.
[31] Constantinidou A, Alifieris C, Trafalis D T. Targeting programmed cell death-1 (PD-1) and ligand (PD-L1): A new era in cancer active immunotherapy [J]., 2019, 194: 84-106.
[32] Emens L A, Kok M, Ojalvo L S. Targeting the programmed cell death-1 pathway in breast and ovarian cancer [J]., 2016, 28(2): 142-147.
[33] Mo D L, Zhu H, Wang J,. Icaritin inhibits PD-L1 expression by targeting protein IκB kinase Α [J]., 2021, 51(4): 978-988.
[34] Hong J S, Zhang Z H, Lv W L,. Icaritin synergistically enhances the radiosensitivity of 4T1 breast cancer cells [J]., 2013, 8(8): e71347.
[35] Cheng X, Tan S R, Duan F F,. Icariin induces apoptosis by suppressing autophagy in tamoxifen-resistant breast cancer cell line MCF-7/TAM [J]., 2019, 26(6): 766-775.
[36] Wang Z Y, Yin L. Estrogen receptor alpha-36 (ER-α36): A new player in human breast cancer [J]., 2015, 418(Pt 3): 193-206.
[37] Yin L, Qi X W, Liu X Z,. Icaritin enhances the efficacy of cetuximab against triple-negative breast cancer cells [J]., 2020, 19(6): 3950-3958.
[38] 刘卫国, 何利芳, 顾玲, 等. 淫羊藿素对乳腺癌细胞化疗敏感的影响机制研究 [J]. 广西医科大学学报, 2022, 39(4): 666-671.
[39] 刘东芳. 淫羊藿苷及其衍生物的设计合成与逆转多药耐药性研究 [D]. 广州: 中山大学, 2009.
[40] Ginestier C, Hur M H, Charafe-Jauffret E,. ALDH1 is a marker of normal and malignant human mammary stem cells and a predictor of poor clinical outcome [J]., 2007, 1(5): 555-567.
[41] 赵丽君, 马艳苗, 梁凯, 等. 基于芯片分析联合网络药理学探寻淫羊藿干预乳腺癌干细胞的生物标志物及靶点机制 [J]. 中国实验方剂学杂志, 2021, 27(11): 195-204.
[42] 胡蕾蕾. 淫羊藿素 (ICT) 通过AhR与ER交互应答抑制乳腺癌的体外作用机制的研究 [D]. 桂林: 桂林医学院, 2012.
[43] Indran I R, Zhang S J, Zhang Z W,. Selective estrogen receptor modulator effects ofextracts on breast cancer and uterine growth in nude mice [J]., 2014, 80(1): 22-28.
[44] Wang Y A, Huang T T, Li H W,.icaritin nanorods with excellent stability improves theandactivity against breast cancer [J]., 2020, 27(1): 228-237.
[45] Liu M N, Wang B J, Guo C J,. Novel multifunctional triple folic acid, biotin and CD44 targeting pH-sensitive nano-actiniaes for breast cancer combinational therapy [J]., 2019, 26: 1002-1016.
Research progress on mechanisms of active constituents ofin treatment of breast cancer
HUA Ci-yi1, 2, SHI You-yang1, 2, XIE Ying2, LIU Sheng1
1. Longhua Hospital Affiliated to Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China 2. Institute of Traditional Chinese Medicine Surgery, Shanghai University of Traditional Chinese Medicine, Shanghai 200032, China
Breast cancer is the most common malignant tumor in women, and there is still a gap between the 5-year survival rate in China and that in developed countries. Yinyanghuo () is a traditional Chinese medicine with long history for its effects of kidney-tonifying. Researches have shown thatand its active constituents (icaritin, icariin and icariside Ⅱ) have synergistic anti-tumor effect of multiple pathways and multiple targets which means it has research value for breast cancer treatment. The molecular mechanisms of the anti-breast cancer effects ofand its active ingredients have been investigated, and the anti-breast cancer effects ofhave been described from the perspectives of inhibiting breast cancer cell proliferation, including inhibiting breast cancer cells proliferation, promoting breast cancer cells apoptosis, inhibiting breast cancer invasion and migration, improving breast cancer immune micro-environment, reducing drug resistance, synergizing with occidental medicine and inhibiting breast cancer stem cells proliferation were reviewed in this paper, which will provide basis for further research on cross-mechanisms of synergy action betweenand western medicine in treatment of breast cancer and development and application of clinical pharmaceutical preparations.
breast cancer;; icaritin; icariin; icariside Ⅱ; mechanism; synergy action
R282.710.5
A
0253 - 2670(2022)20 - 6593 - 08
10.7501/j.issn.0253-2670.2022.20.031
2022-07-19
国家自然科学基金面上项目(81774308)
华辞怡(1998—),女,硕士研究生,研究方向为中医药防治乳腺疾病。E-mail: yuzuzuhcy@163.com
刘 胜,博士,主任医师,教授,研究方向为中西医结合乳腺外科的临床及基础。E-mail: lshtcm@163.com
[责任编辑 崔艳丽]

