基于HPLC-Q-TOF-MS及化学模式识别方法对陈皮的化学成分快速鉴别及产地判别研究
黄 芳,周 熙,罗辉泰,谢淑桐,张春华,谢梦婷,邓 欣,吴惠勤
基于HPLC-Q-TOF-MS及化学模式识别方法对陈皮的化学成分快速鉴别及产地判别研究
黄 芳,周 熙,罗辉泰,谢淑桐,张春华,谢梦婷,邓 欣,吴惠勤*
广东省科学院测试分析研究所(中国广州分析测试中心),广东省化学测量与应急检测技术重点实验室,广东省中药质量安全工程技术研究中心,广东 广州 510070
研究不同产地陈皮化学成分的差异,结合化学模式识别方法对陈皮的产地进行判别分析。采用Agilent SB-C18(150 mm×3.0 mm,2.7 μm)色谱柱分离,以乙腈-0.1%甲酸水溶液进行梯度洗脱,质谱采用电喷雾离子源,在正离子模式下采集数据。对色谱图中各色谱峰进行精确质量数识别,利用二级质谱裂解规律、PCDL数据库及对照品对化学成分进行定性分析。结合主成分分析、聚类分析、判别分析等多元统计方法分析了新会陈皮与其他不同产地陈皮的差异成分,并利用这些分析方法鉴别了未知产地陈皮的来源。从不同产地陈皮中鉴定出了29个共有化学成分,主要为多甲氧基黄酮及黄酮苷类化合物。建立9个差异化学成分的判别模型,实现了新会陈皮的准确判别,准确率达94.4%。可作为陈皮产地鉴别和质量控制的有效方法,为道地药材新会陈皮的判别提供参考。
陈皮;高效液相色谱-高分辨质谱(HPLC-Q-TOF-MS);化学模式识别方法;主成分分析;产地鉴别;甜橙黄酮;辛弗林;羟基-四甲氧基黄酮;柚皮苷;枸橘苷;柠檬苦素;橘皮素;六甲氧基黄酮;羟基六甲氧基黄酮
陈皮为芸香科植物橘Blanco及其栽培变种的干燥成熟果皮。陈皮功效考证是以橘柚之名始载于《神农本草经》[1],又名橘皮、红皮、柑皮等。陈皮在广西、福建、贵州、湖南、江西、四川、重庆、云南都有生产[2]。有广泛的临床用途,具有调节胃肠平滑肌运动,控制消化液分泌、利胆保肝、祛痰平喘、松弛子宫平滑肌等多种药理作用[3],在《中国药典》2020年版收载的1606个成方药剂中,含陈皮的就有197个,可见其应用的重要和广泛。
陈皮药材中以“广陈皮”的质量为优,“广陈皮”中又以新会陈皮为道地药材[4],在临床应用与药效功能方面与其他陈皮有显著差别[5],其市场价格也远高于一般陈皮。但是产量有限,容易造成市场供不应求,因此有不少商家利用陈皮在外观上的相似性,以次充好、以假乱真,严重损害了消费者的利益。目前,对于陈皮产地的鉴别主要还是经验鉴别,是靠经验丰富的工作人员根据颜色、形状、气味等差异对不同陈皮进行鉴别,容易受主观条件及客观环境因素的影响,准确度很难把控。《中国药典》2020年版把陈皮药材分为“陈皮”和“广陈皮”,陈皮以橙皮苷作为质量评价指标,广陈皮以橙皮苷、川陈皮素和橘皮素3个成分作为质量评价指标,但其他产地的陈皮中川陈皮素和橘皮素的含量也不低[2],利用单一成分显然不能准确评价药材质量。
中药产地鉴别是道地药材质量研究的重要方向。多元统计分析方法的应用以及主成分分析与偏最小二乘法-判别分析的化学模式识别方法已被广泛应用于不同产地中药材特征化学成分的分析[6]。结合判别分析方法可对未知产地中药材进行产地判别[7-8]。胡继藤等[9]采用GC-MS结合化学计量学方法鉴别不同产地不同种源陈皮。然而,陈皮的主要化学成分为黄酮、柠檬苦素及生物碱等难挥发性化合物[10]。童超英等[11]采用在线提取-高效液相色谱-二极管阵列-四极杆飞行时间质谱法提取和分离鉴定陈皮中24种黄酮类化合物。张珂等[12]用UHPLC-IT-TOF-MS从陈皮提取物中初步鉴定了61个化学成分。因此,利用液相色谱-高分辨质谱技术结合多元统计分析方法能更好地实现陈皮产地的鉴别。
本研究采用高效液相色谱-高分辨质谱法鉴定了新会、广西和湖南不同产地陈皮中的难挥发性化学成分,并结合多元统计分析方法进行分析,找出新会陈皮与其他陈皮之间的差异成分。针对这些成分建立模型,对未知来源陈皮产地进行判别分析,推测其产地来源的真实性。本实验所建立的方法可用于判定陈皮的掺假现象,有效的保证陈皮产地的真实性。同时,为陈皮质量标准研究提供了支持。
1 材料与仪器
1.1 材料
所收集的36批次原产地药材中,产自新会的标记为XH1~12(编号S1~S12);产自广西的标识为GX1~12(编号S13~S24);产自湖南的标识为HN1~12(编号S25~S36)。另外18批来自民间收藏的宣称新会陈皮。以“XC”标记为XC1~18(编号S37~S54)。经广东药科大学肖雪教授鉴定为芸香科植物橘Blanco及其栽培变种的干燥成熟果皮。
橙皮苷(批号110721-201818,质量分数≥96.2%)、新橙皮苷(批号111829-201703,质量分数≥99.5%)、柠檬苦素(批号111699-200501,质量分数≥98.5%)、川陈皮素(批号110878-201602,质量分数≥99.7%)和橘皮素(批号110722-201106,质量分数≥99%),柚皮苷(批号110722-201105,质量分数≥99%),均购自中国食品药品检定研究院。辛弗林(批号JS90035,质量分数≥98%),购自上海金穗生物科技有限公司。水为二次蒸馏水,甲醇、乙醇、乙腈为色谱纯试剂(德国Merck公司),甲酸和乙酸铵(阿拉丁试剂)。
1.2 仪器
Agilent1290 HPLC-6540-Q-TOF-MS配有双喷射流电喷雾离子源(美国安捷伦公司)配置Aglient自带数据处理软件;KQ2200型台式机械超声波清洗器(东莞市超声波设备有限公司),赛多利斯TP-114电子天平(美国Sartorious公司)。
2 方法
2.1 供试品溶液的制备
陈皮样品经粉碎,过50目筛,取样1.0 g(精确至1.0 mg),置于25 mL具塞试管中,加入70%甲醇溶液25 mL,中间振摇3次,超声处理40 min,取出放冷至室温,定容至25 mL,过0.22 μm滤膜,待测。
2.2 对照品溶液的制备
分别精密称辛弗林、新橙皮苷、橙皮苷、柠檬苦素、柚皮苷、川陈皮素和桔皮素共7种对照品各5.0 mg,置于10 mL量瓶中,加甲醇溶解并定容至刻度,分别得到对照品储备液;用70%的甲醇溶液稀释得到10 mg/L的混合对照品溶液。
2.3 液相色谱条件
色谱柱:Aglient Poroshell 120 SB C18(150 mm×3.0 mm,2.7 μm),流动相:A为乙腈,B为0.1%甲酸水溶液,梯度洗脱:0~5 min,100% B;5~12 min,0~25% A;12~20 min,25%~35% A;20~30 min,35%~45% A;30~40 min,45%~55% A;40~45 min:55%~65% A;45~50 min,65%~100% A;50~52 min,100% A;53~60 min,100% B。体积流量0.3 mL/min;柱温为30 ℃,进样量为5 μL。
2.4 质谱条件
离子源为Agilent双喷Jet Stream源(Dual Jet Stream ESI),正离子模式采集,干燥气(N2)温度350 ℃,雾化气(N2)压力276 kPa,干燥气(N2)温度325 ℃,体积流量8 L/min,鞘气温度350 ℃,体积流量11 L/min,毛细管电压3000 V,毛细管出口电压(Fragmentor)110 V,锥孔电压(skimmer)65 V,八极杆电压750 V,采集模式为Auto MS/MS,扫描范围/70~1100;参比离子正离子为/121.050 9、922.009 8。
2.5 数据处理
样品经液相色谱-高分辨四级杆飞行时间质谱测定,正离子自动二级模式采集数据,得到一级及自动二级总离子流色谱图,根据图中每个峰的精确质量数及同位素分布推测分子式,结合二级质谱及文献资料鉴定出化学成分,并采用对照品进行验证。结合主成分分析(principal component analysis,PCA)、偏最小二乘法判别分析(orthogonal partial least-squares discrimination analysis,OPLS-DA)、聚类分析及判别分析,研究不同产地陈皮的分类及判别方法。
3 结果与分析
3.1 陈皮化学成分的鉴定
按“2.3”“2.4”项中的方法,分别在正、负离子模式下采集数据。结果显示在负离子模式得到的总离子流图色谱图峰数目很少,正离子模式下得到总离子色谱图峰数目多且丰度高,各峰分离理想。可见正离子模式得到的数据更有代表性,因此重点研究正离子模式下色谱峰的化学成分信息。将总离子流色谱图中各个峰(图1),推测其可能的分子式。再根据其二级质谱图,研究其可能的质谱裂解规律,结合参考文献及Chemspider、PubChem等数据库,推断化合物的可能结构式,鉴定其化学成分。最终鉴定出29个主要化学成分,结果见表1。
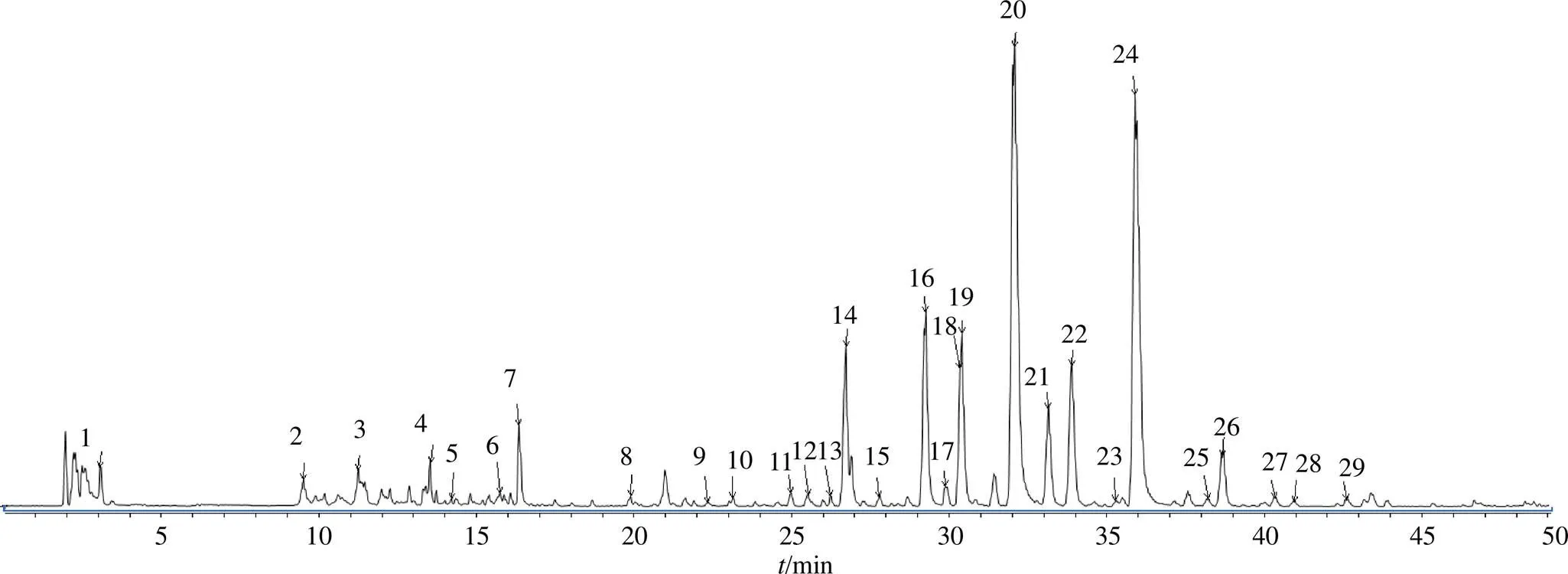
图1 新会陈皮的HPLC-Q-TOF-MS总离子流色谱图
从鉴定出的化学成分中发现,陈皮的主要成分为多甲氧基黄酮类,其主要裂解过程为其母核脱去甲氧基或中性丢失水分子的过程,以下20号峰为例,准分子离子峰[M+H]+的精确质量数为403.138 5,推断其分子式为C21H22O8,二级碎片离子(图2-A),主要有373.091 8、388.115 0、355.080 9、327.085 8等,质谱裂解规律为准分子离子峰403.138 5中性丢失1个甲氧基,形成373.091 8[M+H-OCH3]+碎片离子,再丢失1分子水,形成355.091 8 [M+H-OCH3-H2O]+碎片离子,该离子继续失去2个甲基,得到327.085 8 [M+H-OCH3-H2O-2CH3]+碎片离子;准分子离子峰403.138 5失去一个甲基,形成388.115 3 [M+H-CH3]+的碎片离子,结合文献报道,推断20号峰为川陈皮素或其同分异构体。通过对照品验证为川陈皮素。其质谱裂解机制如图2-B所示,从总离子流图中还可见另外2个15号和25号峰的精确质量数与此峰相同,其相同碎裂电压下的二级碎片离子相同丰度不同,可推测为川陈皮素的同分异构体,均属于六甲氧基黄酮。
表1 不同产地陈皮化学成分及相对含量
Table 1 Constituents and relative contents in Citri Reticulatae Pericarpium from different habitats
序号tR/min[M+H]+ (m/z)误差(×10-6)二级碎片离子 (m/z)分子式化合物名称相对含量/% 实验值理论值新会广西湖南 13.06168.101 3168.101 9−3.57135.068 4, 107.049 5, 91.054 8, 77.039 1C9H13NO2辛弗林2.642.782.70 29.49268.103 7268.104 0−1.12135.0597 , 119.033 3, 94.038 1C10H13N5O4腺苷1.450.220.29 311.23359.111 2359.112 5−1.39329.065 8, 301.070 0, 163.074 7, 138.997 5C19H18O7羟基-四甲氧基黄酮2.791.950.71 413.51625.175 6625.176 3−1.12571.146 5, 487.121 3, 409.180 9C28H32O16香叶木素-6,8-二-C-葡萄糖苷[金圣草(黄)素-6,8-二-C-葡萄糖苷]1.861.751.67 514.18611.196 1611.197 0−1.47303.085 7, 449.143 1, 345.096 1C28H34O15新橙皮苷0.260.320.24 615.71581.191 8581.186 5 9.12273.075 6, 419.133 4, 435.128 3, 401.122 2, 129.054 1, 315.085 9, 545.164 6C27H32O14柚皮苷0.391.261.24 716.39611.196 1611.197 0−1.47303.085 7, 449.143 1, 345.096 1C28H34O15橙皮苷2.252.812.65 819.87595.201 5595.202 1−1.01287.091 1, 433.148 3, 449.143 2, 415.137 3, 129.054 8C28H34O14枸橘苷0.331.731.21 922.23725.229 5725.228 7 1.10419.133 1, 389.085 5, 349.890 3C33H40O18柚皮黄素-3-O-(3-羟基-3-甲基戊二酸)-葡萄糖苷0.283.21 2.34 1023.15359.111 8359.112 5−1.95329.065 8, 301.070 0, 163.074 7, 138.997 5C19H18O7羟基-四甲氧基黄酮0.270.21 0.35 1124.96375.143 4375.143 8−1.07191.069 9, 357.131 9, 211.059 9, 150.031 3C20H22O75-羟基-2-(3-羟基-4,5-二甲氧基苯基)-7,8-二甲氧基-4H-1-苯并吡喃-4-酮0.230.22 0.23 1225.49389.122 3389.123 1−2.06374.100 5, 359.076 7, 341.065 7, 374.098 9C20H20O8羟基-五甲氧基黄酮0.390.23 0.31 1326.23359.111 6359.112 5−2.51329.066 7, 301.068 5, 255.063 8, 153.018 0C19H18O7羟基-四甲氧基黄酮0.290.26 0.22 1426.70373.128 2373.128 2 0.00343.081 1, 358.103 7, 315.085 3, 181.012 9C20H20O7异橙黄酮7.345.46 5.88 1527.77403.138 2403.138 7−1.24388.115 9, 373.093 2, 342.110 8, 327.088 4, 165.053 7C21H22O8六甲氧基黄酮0.281.03 0.97 1629.24373.128 7373.128 2 1.34373.128 1, 343.080 7, 312.098 6, 329.101 3, 357.096 4C20H20O7甜橙黄酮8.529.65 7.88 1729.91375.142 8375.107 4−2.67359.065 2, 211.059 7, 168.041 2, 150.031 4C20H22O75-羟基-2-(3-羟基-4,5-二甲氧基苯基)-7,8-二甲氧基- 4H-1-苯并吡喃-4-酮(异构体)0.510.23 0.67 1830.37471.200 2471.201 3−2.33425.194 0, 367.189 2, 161.059 1C26H30O8柠檬苦素 0.280.24 0.36 1930.38343.117 8343.117 6 0.58313.071 5, 285.076 2, 181.013 6, 153.018 6, 133.065 0C19H18O6四甲氧基黄酮 7.324.60 6.15 2032.05403.139 2403.138 7 1.24388.114 2, 373.093 1, 355.081 3, 327.088 5, 211.023 4C21H22O8川陈皮素23.2021.0721.06 2133.12343.117 1343.117 6−1.46327.086 5, 299.091 0, 282.088 4C19H18O6四甲氧基黄酮 4.64 6.14 5.14 2233.86433.149 2433.149 3−0.23403.101 1, 385.090 2, 418.124 3C22H24O9七甲氧基黄酮 6.3513.5712.45 2335.33419.133 4419.133 7−0.72404.110 0, 389.087 2, 361.091 2, 346.068 0, 328.057 0, 165.054 4C21H22O9羟基-六甲氧基黄酮(栀子黄素A) 0.43 2.92 1.94 2435.94373.128 5373.128 2 0.80358.104 7, 344.084 8, 343.081 2, 325.069 8, 297.074 9C20H20O7橘皮素(桔皮素)五甲氧基黄酮23.3014.2718.53 2538.21403.138 3403.138 7−0.99373.094 1, 330.074 4, 211.024 3, 183.029 1C21H22O8六甲氧基黄酮 0.29 0.73 0.83 2638.68389.120 3389.123 1−7.20359.077 5, 341.066 1, 197.008 3, 169.013 2C20H20O8羟基-五甲氧基黄酮 3.12 0.90 2.33 2740.35329.101 3329.102 0−2.13314.078 3, 268.072 5, 299.054 7, 136.015 1C18H16O6羟基-三甲氧基黄酮 0.41 0.26 0.31 2840.96419.133 4419.133 7−0.72404.110 0, 389.087 2, 371.075 2, 343.084 2, 311.054 3, 151.074 9C21H22O9羟基-六甲氧基黄酮(栀子黄素A或异构体) 0.25 1.69 1.09 2942.63359.111 7359.112 5−2.23329.066 2, 286.046 5, 211.023 3, 183.029 4C19H18O7羟基-四甲氧基黄酮 0.32 0.32 0.25
图3中9号峰准分子离子峰[M+H]+的精确质量数为725.228 7,推断其分子式为C33H40O18,二级碎片离子,主要有419.133 1、389.085 5、349.890 3,质谱裂解规律为准分子离子峰725.228 7失去一个葡萄糖基和3-羟基-3-甲基戊二酸基团,形成419.133 1[M+H-162-146]+的碎片离子,然后再进一步丢失2个甲基,形成389.085 5[M+H-162-146-30.0467]+的碎片离子,结合文献信息可推测该化合物为柚皮黄素-3--(3-羟基-3-甲基戊二酸)-葡萄糖苷。
陈皮大部分化学成分为多甲氧基黄酮类,其相对含量占95.8%(表1)。研究表明,多甲氧基黄酮具有多种生物活性,如抗炎、抗癌、抗动脉粥样硬化、调血脂、降血糖、保护记忆等[13],羟基化的多甲氧基黄酮具有比多甲氧基黄酮更好的溶解性和渗透性[14]。黄酮苷类化合物是陈皮中另一种主要的黄酮类化合物,如橙皮苷、新橙皮苷和柚皮苷等。其二级质谱中的碎片离子多体现为[M+H-162]+和[M+H-146]+,或[M+H-162-146]+,为分子离子分别脱去葡萄糖基或鼠李糖基的过程。目前,《中国药典》中陈皮以橙皮苷作为质量评价指标,广陈皮以橙皮苷、川陈皮素和桔皮素3个成分作为质量评价指标。然而,陈皮药效为其所有多甲氧基黄酮及黄酮苷共同发挥作用[15],仅以1~3个化合物作为评价指标不能真正反映药材质量。需要制定多个多甲氧基黄酮及黄酮苷共同定量分析的质量评价方法。

图2 20号峰(川陈皮素) 的二级质谱图(A) 及裂解机制图(B)
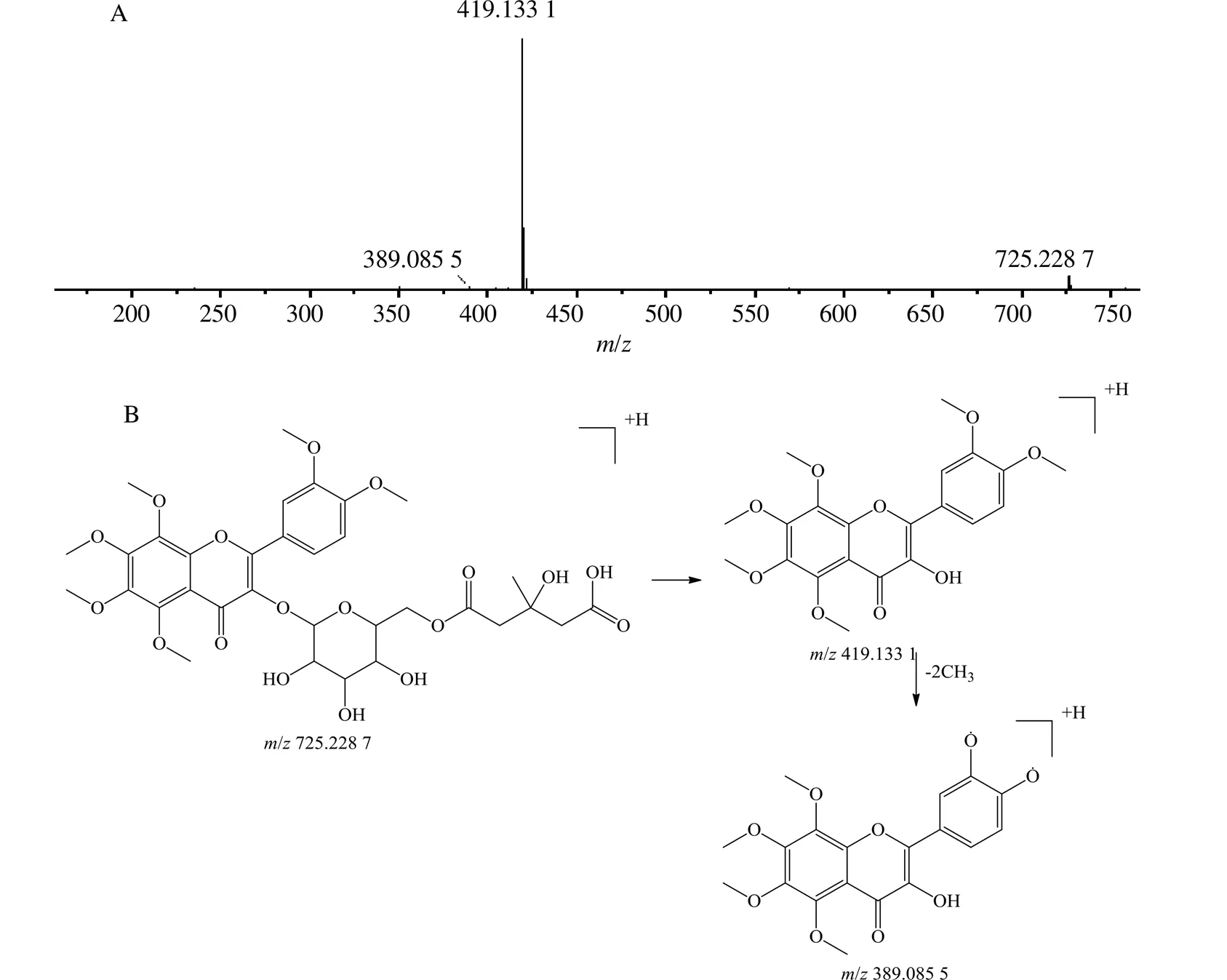
图3 9号峰的二级质谱(A)及裂解机制图(B)
3.2 不同产地陈皮差异成分分析
3.2.1 PCA PCA是一种无监督的降维数据处理方法,能够真实的反映原始数据的分组情况。本研究采用SIMCA 14.1软件,以采集的36批次陈皮样品数据为数据矩阵,对3个不同产地的陈皮数据进行主成分分析,结果见图4-A。质控样本较集中,表明采集方法稳定可靠;新会陈皮分布集中,聚为一类,与湖南、广西的陈皮区分明显;湖南陈皮和广西陈皮聚为一类,但湖南陈皮分布较集中,差异性较小;广西陈皮分散大,差异大。
3.2.2 OPLS-DA OPLS-DA表明新会陈皮可与湖南陈皮和广西陈皮明显区分,存在组间差异,为更好地观察组间差异,本研究采用有监督的OPLS-DA分析方法,筛选新会陈皮与湖南陈皮和广西陈皮的差异性化学成分。由OPLS-DA结果可知,新会陈皮可明显区分其他2产区的陈皮(图4-B),且2(cum)=0.821,2(cum)=0.984,2(cum)=0.963,表明模型的解释度和预测度良好。采用变量重要性投影值(VIP)大于1,且coefficients plot中置信区间不过原点,并结合检验(<0.05)结果,筛选新会陈皮与其他2个产地陈皮的化学成分。从中筛选出18个成分,见图4-C所示,并鉴定了其中9个差异成分,包括甜橙黄酮、辛弗林、羟基-四甲氧基黄酮、柚皮苷、枸橘苷、柠檬苦素、橘皮素、六甲氧基黄酮、羟基六甲氧基黄酮。这些成分在区分不同产地陈皮药材间起到重要作用,可作为陈皮道地药材的指标成分(图4-B)。

A-PCA score plot B-OPLS-DA score plot C-VIP value D-S-plot chart
3.2.3 聚类分析 以相对含量较高的川陈皮素为参照,各差异成分的色谱峰相对于参照峰的相对峰面积为变量,组成36×12阶原始数据矩阵。采用IBM SPSS 20.0软件进行聚类分析,聚类方法采用组间连接法,测区间为Euclidean距离,数据无标准化,得到样品平均链接(组间)的谱系图(图5)。结果表明,在欧式距离为10时,36批药材样品可聚为3类,XH1~XH12聚为一类,GX3、GX4和GX6 聚为一类,HN1~HN12、GX1、GX2、GX5、GX7~GX12聚为一类,可见采用聚类分析新会陈皮分类效果显著,而广西和湖南的分类不明显。这与PCA分析和OPLS-DA分析结果一致。
3.2.4 产地判别分析 以川陈皮素为参照,各差异峰相对于参照峰的相对峰面积为变量,采用IBM SPSS 20.0软件对上述原始数据矩阵进行判别分析。选择Fisher、未标准化为函数系数参数,先验概率选择根据组大小计算。36批陈皮样品典型判别函数1和典型判别函数2的得分作散点图如图6所示,图中显示湖南、广西和广东新会陈皮明显聚为3类。其中,新会陈皮与广西和湖南陈皮区别明显,与前面结果一致。采用判别分析验证3个产地判别的准确性,初始验证中36个陈皮样品全部被正确归类,总体正确率为100%;交叉验证中2个广西陈皮样品被归为新会,其他34个样品按产地被正确归类,交叉验证总体正确率为94.4%,方法的准确度较好。
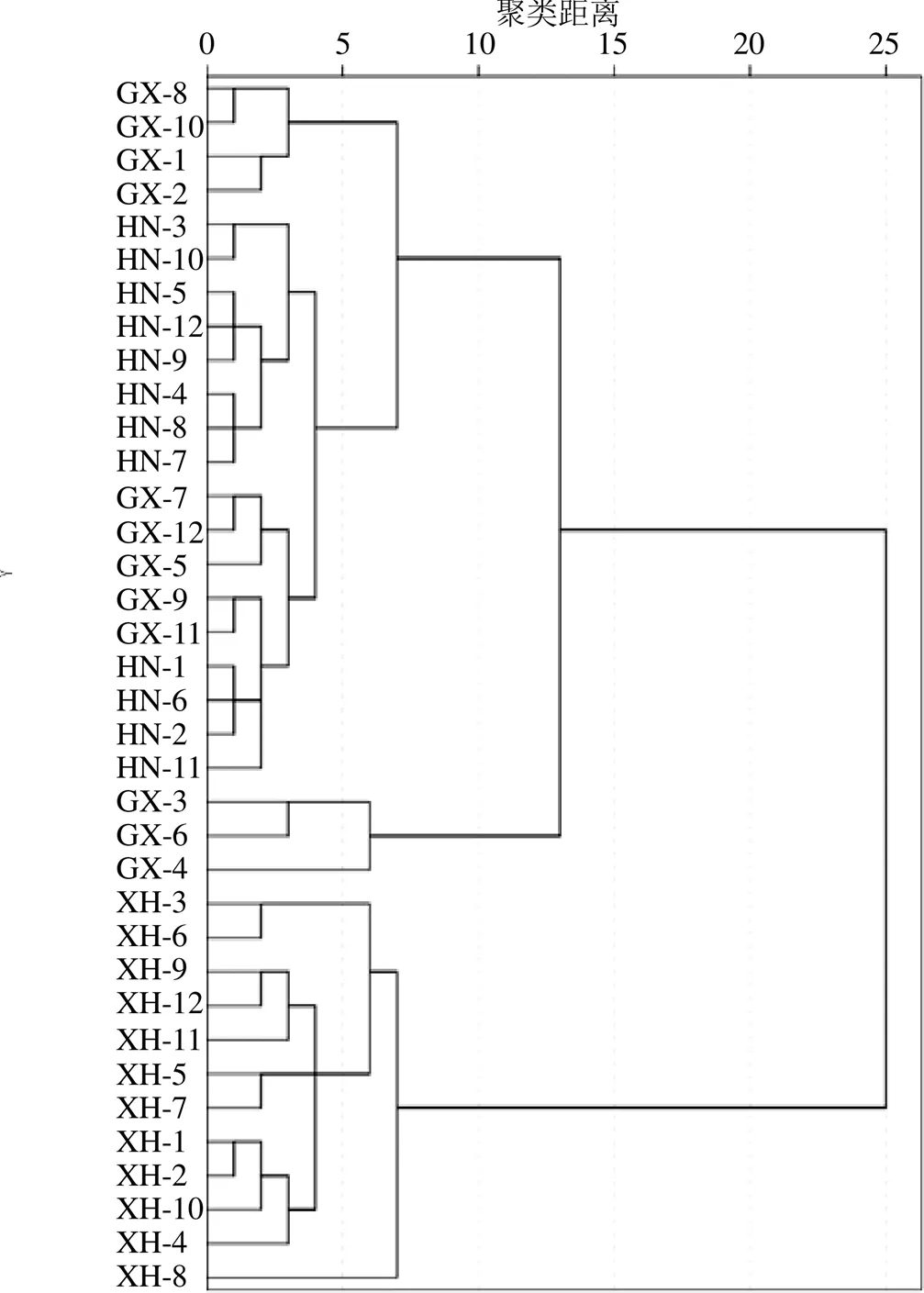
图5 不同产地陈皮样品聚类分析结果
3.2.5 陈皮产地鉴别方法适用性验证 采用“3.2.4”项建立的判别函数,对18个来自民间收藏的新会陈皮样品进行独立样本测试,结果如表2所示,18个样品中17个判定为新会陈皮,准确度为94.4%,其中一个判定为湖南陈皮。
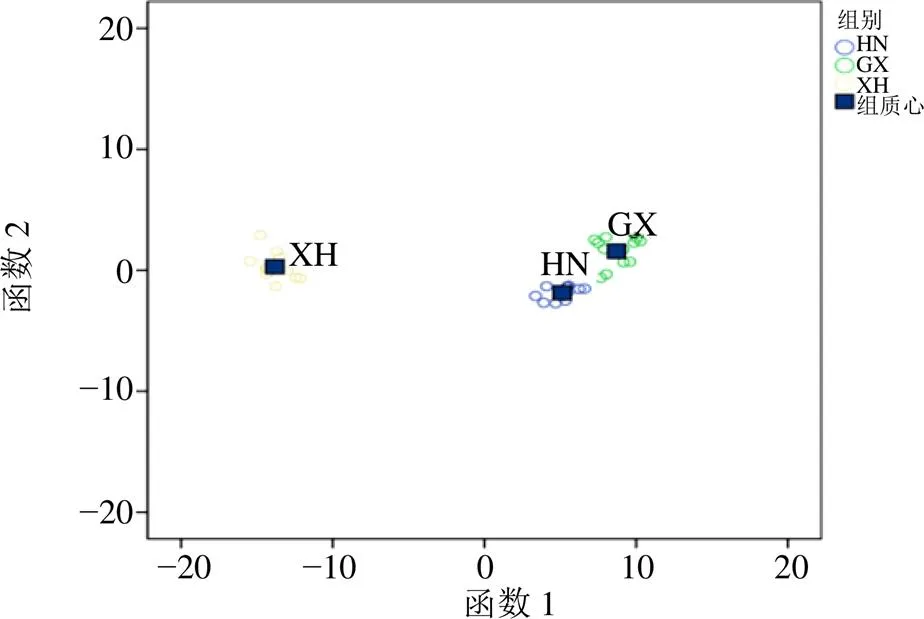
图6 不同产地陈皮样品判别分析散点图
表2 不同产地陈皮样品判别分析预测结果
Table 2 Discriminant analysis results of Citri Reticulatae Pericarpium from different habitats
分类产地样品个数准确预测个数准确度/% 训练集新会121294.4 广西1210 湖南1212 独立测试集新会181794.4
4 讨论
本研究考察了不同提取溶剂(50%甲醇、70%甲醇和纯甲醇)和不同超声提取时间(30、40、50 min)对陈皮提取成分的影响,结果显示,70%甲醇提取液总离子流图的色谱峰较多,基线噪音较低,不同超声时间无明显差异,因此选择70%甲醇超声提取40 min做为提取方法。
为了分离陈皮中所含的多种黄酮类物质及黄酮类同分异构体,研究对比了3种不同色谱柱(Agilent Poroshell 120 EC-C18(100 mm×3.0 mm,2.7 μm);Agilent Poroshell 120 PFP (100 mm×2.1 mm,2.7 μm);Aglient Poroshell 120 SB C18(150 mm×3.0 mm,2.7 μm),结果显示采用Aglient Poroshell 120 SB C18色谱柱分离理想,更有利于多羟基化合物的分离。
本研究采用HPLC-Q-TOF-MS分析了不同产地陈皮中的难挥发性化学成分,从中鉴定出了29个主要化学成分,主要包括多甲氧基黄酮及黄酮苷2类化合物。PCA、OPLS-DA分析与聚类分析结果表明,广西与湖南陈皮化学成分差异不明显,但与新会陈皮存在显著差异。甜橙黄酮、辛弗林、羟基-四甲氧基黄酮、柚皮苷、枸橘苷、柠檬苦素、橘皮素、六甲氧基黄酮、羟基六甲氧基黄酮等成分可作为新会陈皮的道地药材与其他产地的差异标志性成分。利用差异成分建立的新会陈皮产地鉴别模型可准确实现新会陈皮的鉴别,准确度大于94.4%。
利益冲突 所有作者均声明不存在利益冲突
[1] 金世元. 道地“橘”的药用品种与质量[J]. 首都医药, 2005, 12(4): 45-46.
[2] 念其滨. 陈皮不同炮制品中黄酮类成分的变化 [J]. 现代中西医结合杂志, 2009, 18(19): 2332-2333.
[3] 林林. 陈皮总黄酮、橙皮苷和挥发油的动态分析研究 [D]. 广州: 广东药学院, 2008.
[4] 魏裕涛, 魏佳娜, 庞玉思, 等. 浅谈道地广陈皮与普通陈皮之差别 [J]. 中国民间疗法, 2013, 21(9): 52-53.
[5] 胡云飞, 裴月梅, 吴虹, 等. 基于UPLC-Q-TOF-MS技术研究不同产地牡丹皮药材化学成分的差异 [J]. 中草药, 2016, 47(17): 2984-2992.
[6] 王哲, 张春华, 黄晓兰, 等. 基于元素指纹图谱的西洋参产地判别研究 [J]. 质谱学报, 2019, 40(6): 525-537.
[7] 张春华, 陈春桃, 陈亮, 等. 矿物元素指纹图谱的建立及在西洋参产地鉴别中的应用研究 [J]. 分析测试学报, 2021, 40(3): 318-325.
[8] 周欣, 张琳, 毛婵, 等. 基于化学计量学方法结合正交偏最小二乘判别分析的陈皮饮片HPLC指纹图谱研究[J]. 中草药, 2019, 50(9): 2194-2200.
[9] 胡继藤, 唐铁鑫, 刘韬, 等. GC-MS结合化学计量学方法鉴别不同产地与种源陈皮的研究 [J]. 时珍国医国药, 2017, 28(7): 1665-1667.
[10] 李皓翔, 梅全喜, 赵志敏, 等. 陈皮广陈皮及新会陈皮的化学成分药理作用和综合利用研究概况 [J]. 时珍国医国药, 2019, 30(6): 1460-1463.
[11] 童超英, 彭密军, 施树云. 在线提取-高效液相色谱-二极管阵列检测-四极杆飞行时间质谱法快速鉴定陈皮中黄酮类化合物 [J]. 色谱, 2018, 36(3): 278-284.
[12] 张珂, 许霞, 李婷, 等. 利用UHPLC-IT-TOF-MS分析陈皮的化学成分组 [J]. 中国中药杂志, 2020, 45(4): 899-909.
[13] 黄秀芳, 庾国桢, 童晶晶. 基于网络药理学分析陈皮的药理作用机制 [J]. 中成药, 2019, 41(12): 3038-3045.
[14] 韩丹丹, 毕金峰, 周沫, 等. 柑、橘、橙果皮中天然羟基化多甲氧基黄酮的转化率研究 [J]. 中国食品学报, 2018, 18(5): 294-301.
[15] 梅振英, 张荣菲, 赵志敏, 等. 陈皮多甲氧基黄酮类成分组成、提取纯化及生物活性研究进展 [J]. 中成药, 2020, 42(10): 2709-2715.
Chemical constituents and habitats identification ofby HPLC-Q-TOF-MS and chemical pattern recognition
HUANG Fang, ZHOU Xi, LUO Hui-tai, XIE Shu-tong, ZHANG Chun-hua, XIE Meng-ting, DENG Xin, WU Hui-qin
Guangdong Engineering Research Center for Quality and Safety of Traditional Chinese Medicine, Guangdong Key Laboratory of Chemical Measurement and Emergency Test Technology, Institute of Analysis, Guangdong Academy of Sciences (China National Analytical Center, Guangzhou), Guangzhou 510070, China
To analyze the differential chemical constituents in Chenpi () from different habitats. Then, habitats ofwere discriminated by chemical pattern recognition methods.The chromatographic separation was performed on an Agilent SB-C18column(150 mm×3.0 mm, 2.7 μm) with the mobile phase consisting of acetonitrile and 0.1% formic acid for gradient elution. The chromatographic effluent was detected and analyzed by UPLC-Q-TOF/MS in positive modes. Constituents were identified by PCDL database, fragmentation regularities, and comparing to standard samples. Then, Habitats difference analysis was carried out by principal component analysis, hierarchical cluster analysis and discriminant analysis.A total of 29 constituents were identified, mainly included polymethoxyflavones and flavonoid glycoside.from XinHui was accurate discriminated by the created discriminant model with an accuracy of 94.4%.This study provide an effectively method for the habitats distinctions of, which is benefit to the identification of geo-authentic herbs for XinHui.
HPLC-Q-TOF-MS; chemical pattern recognition; principal component analysis; habitats identification;sinensetin; synephrine; hydroxy-tetramethoxyflavone; naringin; poncirin; limonin; tangeretin; hexamethoxyflavone; hydroxy-hexamethoxyflavone
R286.2
A
0253 - 2670(2022)20 - 6361 - 08
10.7501/j.issn.0253-2670.2022.20.007
2022-03-09
广州市科技计划项目(202102020530)
黄 芳 (1975—),女,硕士,主要从事分析化学及药物分析研究工作。Tel: (020)88321850 E-mail: 13642741616@139.com
吴惠勤 (1961—),男,研究员,研究方向为有机质谱分析及应用。Tel: (020)87686536 E-mail: 13802959756@139.com
[责任编辑 时圣明]