芬太尼透皮贴剂治疗晚期肺癌疼痛患者的疼痛缓解效果、心理应激反应及优势分析
高婷
肺癌在中国是发病率较高的恶性肿瘤,其发病率、死亡率均高居首位,肺癌死亡人数约占全部癌症死亡人数的23.8%,是威胁我国居民健康的主要危重症[1]。70%左右的癌症患者进展至晚期时以疼痛为主要症状,且有50%~80%患者的疼痛症状不能得到有效控制,给患者造成极大生理痛苦,因此缓解癌性疼痛成为治疗晚期肺癌患者的第一目标[2]。临床治疗晚期肺癌疼痛患者通常按照癌性疼痛“三阶梯疗法”进行,即轻度疼痛患者服用阿司匹林等非阿片类药物,中度疼痛患者给予可待因等弱阿片类药物,重度疼痛患者给予吗啡等强阿片类镇痛药物[3]。吗啡镇痛作用强大,是治疗癌性疼痛的代表药物,但长期服用吗啡容易产生多种不良反应,重者可能发生急性中毒,且肺癌进展至晚期,部分患者无法口服止痛药或不能耐受肌肉注射,因而口服吗啡的镇痛效果有限[4]。芬太尼同样属于阿片类镇痛药,对于晚期重度疼痛的肺癌患者有较好的镇痛效果,芬太尼透皮贴剂是一种外用药物,药效通过表皮细胞及角质层进入毛细血管从而发挥镇痛作用,相较于口服或肌肉注射,透皮贴剂疗法不良反应相对较少。既往研究已证实,芬太尼透皮贴剂对中重度癌性疼痛患者有效,且不良反应相对较少[5]。然而关于芬太尼透皮贴剂对患者应激反应的影响尚不明确,鉴于此,本研究对比服用吗啡患者与使用芬太尼透皮贴剂患者的临床资料,探讨其作用,详情如下。
1 资料与方法
1.1 一般资料
选取2019年1月-2021年12月福建医科大学附属第一医院收治的晚期肺癌疼痛患者80例,纳入标准:符合文献[6]《中华医学会肺癌临床诊疗指南(2018版)》中肺癌的诊断标准;均经病理学检查确诊为肺癌晚期;癌性疼痛分级为中度以上;Karnofsky功能状态评分(KPS)不低于40分。排除标准:内分泌紊乱;有药物禁忌证;合并多系统功能障碍;过敏体质;精神疾病;妊娠、哺乳期。经信封法随机分为观察组(40例)与对照组(40例),两组一般资料比较,差异无统计学意义(P>0.05),见表1。本研究经医院伦理委员会批准,患者均对本研究知情同意。
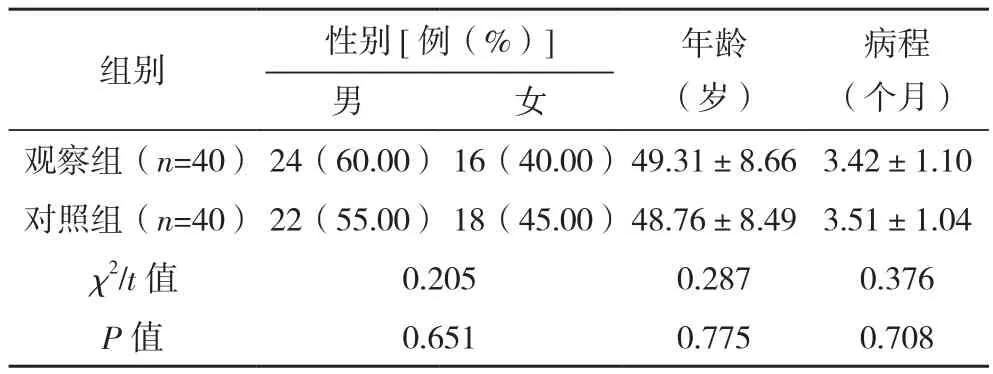
表1 两组一般资料比较
1.2 方法
所有患者均按照癌性疼痛“三阶梯疗法”给药。对照组口服硫酸吗啡缓释片(BARD PHARMACEUTICALS LIMITED,国药准字 J20140061),初始每12小时服用1次,10 mg/次,以后根据镇痛效果酌情调整计量,疗程2个月。观察组应用芬太尼透皮贴剂(常州四药制药有限公司,国药准字H20057054),未使用过吗啡的患者初始剂量25 μg/h,使用过吗啡的患者初始剂量依照吗啡与芬太尼的剂量转换公式[芬太尼透皮贴剂72 h剂量=口服吗啡(mg/d)×1.2]来确定,贴剂于躯干或上臂未受刺激和照射的平整皮肤表面贴用,每72小时更换1次,以后根据镇痛需要酌情调整剂量,疗程2个月。
1.3 观察指标及评价标准
(1)比较治疗前后两组疼痛程度及疼痛缓解效果。采用视觉模拟评分法(VAS)评估,评分范围0~10分,得分越高疼痛越剧烈。VAS得分降低≥75%为明显缓解;得分降低50%~74%为中度缓解;得分降低25%~49%为轻度缓解,得分降低25%以下为未缓解。总缓解率=1-未缓解率。(2)比较治疗前后两组心理应激指标。应用放射免疫分析法测定患者血清胰岛素(Ins)、β-内啡肽(β-EP)、促肾上腺皮质激素(ACTH)。(3)比较治疗前后两组不良反应发生情况,包括恶心呕吐、眩晕嗜睡、便秘等。(4)比较治疗前后两组功能状态。应用Karnofsky功能状态评分(KPS)衡量,总评分范围0~100分,得分高低与功能状态呈正比。
1.4 统计学处理
采用SPSS 20.0统计学软件进行数据处理,计量资料以(±s)表示,采用t检验,计数资料以率(%)表示,采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组治疗前后疼痛程度及疼痛缓解效果比较
治疗后,观察组VAS评分低于对照组(P<0.05);观察组疼痛缓解率为97.50%(39/40),高于对照组的80.00%(32/40),差异有统计学意义(P<0.05),见表2、表3。
表2 两组治疗前后疼痛评分比较[分,(±s)]

表2 两组治疗前后疼痛评分比较[分,(±s)]
组别 治疗前 治疗后 t值 P值观察组(n=40) 6.61±1.32 3.15±0.50 15.503 <0.001对照组(n=40) 6.42±1.30 4.73±0.81 6.978 <0.001 t值 0.649 10.498 P值 0.518 <0.001
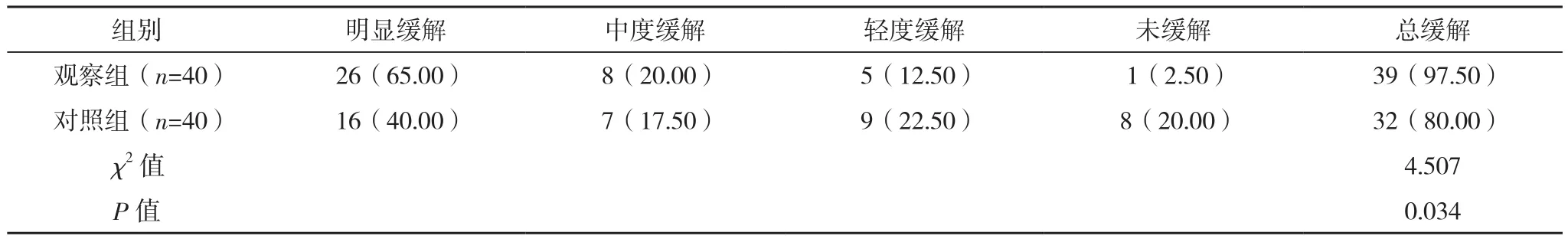
表3 两组疼痛缓解效率比较[例(%)]
2.2 两组治疗前后心理应激指标比较
治疗后,观察组Ins、β-EP、ACTH水平均低于对照组(P<0.05),见表4。
表4 两组治疗前后心理应激指标对比(±s)

表4 两组治疗前后心理应激指标对比(±s)
*与本组治疗前比较,P<0.05。
组别 Ins(μU/ml) β-EP(pg/ml)ACTH(pg/ml)治疗前 治疗后 治疗前 治疗后 治疗前 治疗后观察组(n=40) 40.37±7.62 14.34±2.36* 319.33±28.36 263.44±13.51* 308.23±27.22 254.34±17.63*对照组(n=40) 39.86±7.34 28.17±5.27* 318.87±30.39 282.73±14.72* 307.79±28.14 276.62±16.59*t值 0.305 15.148 0.070 6.106 0.071 5.821 P值 0.761 <0.001 0.944 <0.001 0.944 <0.001
2.3 两组不良反应发生情况比较
观察组恶心呕吐、眩晕嗜睡、便秘等发生率均低于对照组(P<0.05),见表5。
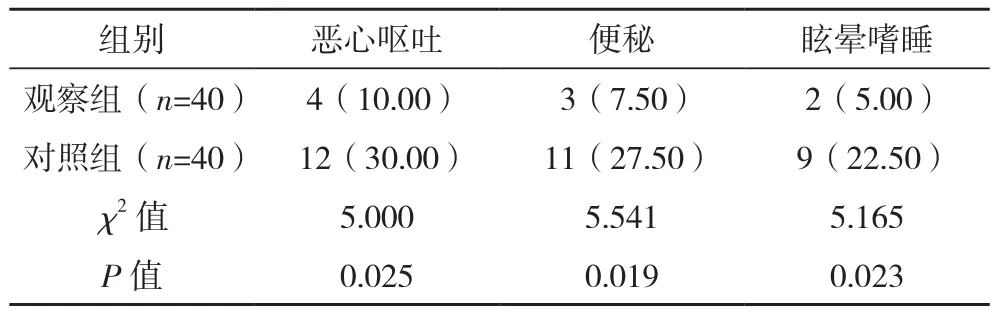
表5 两组不良反应发生情况比较[例(%)]
2.4 两组治疗前后KPS功能状态评分比较
治疗后,观察组KPS评分高于对照组(P<0.05),见表6。
表6 两组治疗前后KPS功能状态评分比较[分,(±s)]

表6 两组治疗前后KPS功能状态评分比较[分,(±s)]
组别 治疗前 治疗后 t值 P值观察组(n=40) 48.78±8.42 80.25±10.15 15.092 <0.001对照组(n=40) 49.25±8.63 73.65±9.76 11.845 <0.001 t值 0.247 2.964 P值 0.806 0.004
3 讨论
癌性疼痛是晚期肺癌患者痛苦的主要原因,肺癌本身直接对机体的破坏、肺癌的治疗均可引起中重度疼痛。剧烈生理疼痛导致晚期肺癌患者多伴有失眠状态,睡眠质量不佳又容易产生抑郁、焦虑情绪或导致癌因性疲乏,患者陷入“失眠-癌因性疲乏-疼痛-失眠”恶性循环中[7]。因此,充分缓解患者癌性疼痛对改善晚期肺癌患者生存质量有重要意义。
本研究中,治疗后观察组VAS评分低于对照组(P<0.05);观察组疼痛缓解率为97.50%(39/40),高于对照组的 80.00%(32/40)(P<0.05)。说明应用芬太尼透皮贴剂缓解疼痛的效果更佳,疼痛缓解有效率更高。芬太尼是一种阿片受体激动剂,具有强大的止痛作用。相较于吗啡,芬太尼具有以下优势:(1)芬太尼具有较好的脂溶性,且分子质量小,可透过血脑屏障作用于疼痛中枢,从而产生中枢性镇痛作用;(2)相同剂量下,芬太尼缓解疼痛的作用是吗啡的数十倍[8];(3)起效快,贴剂贴2 h后即可在血浆中检测出芬太尼;(4)血药浓度稳定、生物利用度高,贴后2 h血药浓度开始逐步升高,在8~16 h后达到峰值,经真皮层进入微循环,在皮肤中的代谢损失较少,且不受摄入食物、消化道pH的影响,生物利用度高达92%[9];(5)镇痛持续时间长,其有效血药浓度可维持72 h。胡家婷等[10]研究证实,吗啡不耐受患者应用芬太尼透皮贴剂,疼痛缓解有效率可提高约18.04%,且患者机体内疼痛介质水平均有明显改善。
患者处于疼痛状态时,会出现焦虑、焦躁、精神紧张等情绪,可刺激机体内ACTH、Ins、β-EP等分泌增加,患者处于应激反应[11]。β-EP主要由垂体、肾上腺等分泌产生,对伤害性感受器有调节作用,能有效抑制P物质传递。Ins是一种蛋白质激素,迷走神经兴奋时可导致其浓度升高。ACTH主要由垂体前叶分泌产生,可维持肾上腺正常的功能与形态,机体处于应激状态时,其表达明显上调。在本研究中,治疗后观察组Ins、β-EP、ACTH均低于对照组(P<0.05)。表明应用芬太尼透皮贴剂对于减轻患者应激状态的效果更明显。分析其原因:应用芬太尼透皮贴剂治疗后,患者疼痛程度更低,因而身体应激反应明显降低,从而ACTH、Ins、β-EP显著降低。王薇等[12]研究表明,通过应用芬太尼透皮贴剂可明显降低腹部手术患者术后应激。
本研究结果发现,观察组恶心呕吐、眩晕嗜睡、便秘等发生率均低于对照组(P<0.05)。说明芬太尼透皮贴剂的不良反应更少。这是因为芬太尼透皮贴剂为外治法,基于芬太尼分子量小、脂溶性高等特性,通过透皮贴剂系统经肌肤缓慢给药,对胃肠道刺激较小,因而不良反应更少。晋鑫等[13]报道显示,应用芬太尼透皮贴剂治疗老年中重度癌性疼痛患者,其不良反应较少,且均在可控范围内。此外,本研究结果还发现,治疗后观察组KPS评分高于对照组(P<0.05),说明使用芬太尼透皮贴剂治疗患者的功能状态恢复更好。其原因可能为应用芬太尼透皮贴剂治疗后,患者癌性疼痛得到有效缓解,其生理痛苦减轻,应激反应减少,有利于提高患者睡眠质量,减少癌因性疲乏,从而有助于身体各功能恢复,因而功能状态更好。刘伟[14]在研究中发现,通过应用芬太尼透皮贴剂,患者总疼痛缓解率可达93%,且治疗后患者KPS评分有明显升高,生存质量明显提升。
综上,应用芬太尼透皮贴剂对晚期肺癌患者的疼痛缓解效果明显,还能显著减少患者应激反应,患者功能状态恢复更好,且不良反应较少,建议临床推广应用。

