多囊卵巢综合征合并妊娠期糖尿病的影响因素及因素预测价值分析
樊周能 陈雅婷 陈慧
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是临床妇科常见的疾病,大多数PCOS患者因排卵功能障碍而出现不孕症,经月经周期调整、促排卵、辅助生殖技术治疗后,大多数患者可怀孕[1]。由于基础疾病的影响,虽然妊娠可成功,但妊娠合并症和不良妊娠结局发生率较高,其中妊娠期糖尿病(gestational diabetes mellitus,GDM)就是严重的合并症[2]。以往研究报道,20~40岁的PCOS妇女中合并GDM的发生率高达20%~40%,其核心原因可能与胰岛素抵抗有关[3]。PCOS患者妊娠后性激素代谢更加紊乱,导致胰岛素抵抗进一步增强,从而影响正常糖代谢[4]。此外PCOS合并GDM与早产、巨大胎儿、新生儿高胆红素血症的发生有明显相关性[5]。当前对GDM影响因素的研究较多,但对PCOS合并GDM影响因素的研究较少,因此,研究PCOS合并GDM的影响因素,对于疾病的诊断和降低不良妊娠结局有重要作用。
1 资料与方法
1.1 一般资料
回顾性选取2018年1月-2021年5月中国人民解放军联勤保障部队第九〇九医院妇产科诊断为PCOS后经规范治疗成功妊娠和分娩的产妇143例。纳入标准:符合2018年中华医学会妇产科学分会内分泌学组及指南专家组制定的中国PCOS诊断标准:月经稀发、闭经或不规则子宫出血是诊断必需条件,另外符合下面2项中1项即可诊断为PCOS,(1)临床或生化高雄激素表现;(2)超声为多囊卵巢形态[6]。排除标准:多胎妊娠;妊娠前糖尿病;妊娠前肝肾功能异常;妊娠前血脂明显异常;血液系统疾病、急性感染;有药物和酒精滥用史等。根据是否合并GDM将其分为GDM组(43例)和非GDM组(100例)。GDM诊断标准:妊娠24~28周,行75 g口服葡萄糖耐量试验,空腹及服用葡萄糖1、2 h后,任一血糖水平分别达到或超过5.1、10.0、8.5 mmol/L,即诊断为 GDM[7]。
1.2 方法
1.2.1 临床指标检测 采集两组妊娠24~28周晨起空腹血液 2 管(约 5 ml/管),3 000 r/min,离心5 min,其中1管标本由迈瑞BS-800M全自动生化分析仪及其配套试剂检测空腹血糖(fasting blood glucose,FBG),谷丙转氨酶、谷草转氨酶、总胆红素、直接胆红素、甘油三酯、总胆固醇、高密度脂蛋白、低密度脂蛋白、胱抑素C(cystatin C,CysC)水平。另1管标本由西门子CI2000全自动化学发光免疫分析仪及其配套试剂检测睾酮(testosterone,T)、空腹胰岛素(fasting insulin,FINS)、性激素结合蛋白(sex hormone binding protein,SHBG)、抗缪勒管激素(anti Mullerian hormone,AMH)。计算稳态模型胰岛素抵抗指数(homeostasis model assessment insulin resistance index,HOMA-IR),计算公式为HOMA-IR=FBG×FINS/22.5。
1.2.2 临床资料收集 收集两组临床资料,包括年龄、孕前体重指数(body mass index,BMI)、GDM家族史、不良妊娠史。
1.3 观察指标
比较两组临床资料及临床指标,并对PCOS合并GDM的影响因素进行Logistic回归分析,并分析不同因素对PCOS合并GDM的预测价值。比较不同因素的预测价值。比较两组不良妊娠结局(胎膜早破、羊水过多、羊水过少、产后出血)。
1.4 统计学处理
本研究数据采用SPSS 18.0、Medcalc统计学软件进行分析和处理,定性数据以率(%)表示,当理论频数>5时,且样本数大于40时,采用Pearsonχ2检验,当1≤理论频数率<5时,且样本数大于40时,采用连续校正χ2检验,正态分布的定量数据以(±s)表示,两组比较采用独立样本t检验,非正态分布的定量资料采用[M(P25,P75)]表示,组间比较采用秩和检验。采用Logistic回归分析PCOS合并GDM的影响因素,采用受试者工作曲线(ROC)分析不同因素的预测价值,通过Z检验比较不同因素预测价值,P<0.05为差异有统计学意义。
2 结果
2.1 两组不良妊娠结局比较
GDM组产后出血率高于非GDM组(P<0.05)。两组早产、胎膜早破、羊水过多、羊水过少发生率比较差异均无统计学意义(P>0.05),见表1。
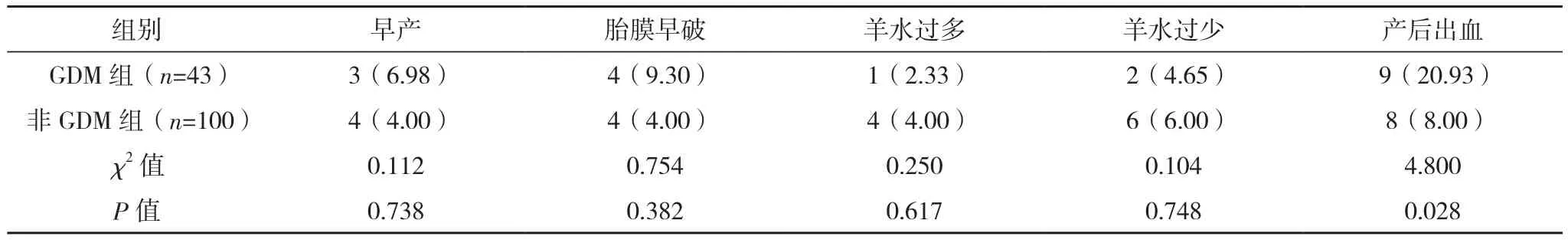
表1 两组不良妊娠结局比较[例(%)]
2.2 两组临床资料及临床指标比较
143例PCOS患者中43例合并GDM,发生率为30.07%。GDM组GDM家族史占比、HOMA-IR、FINS、T、CysC水平均高于非GDM组,SHBG水平低于非GDM组(P<0.05),见表2。
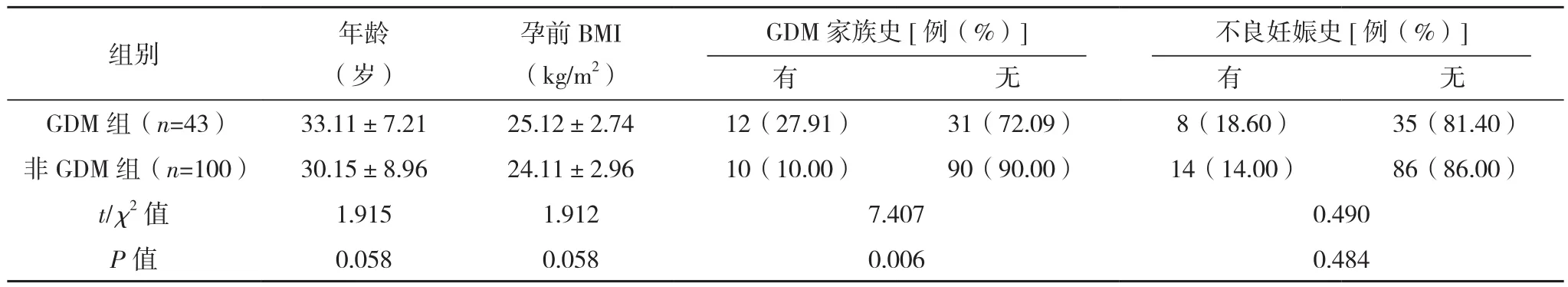
表2 两组临床资料及临床指标比较
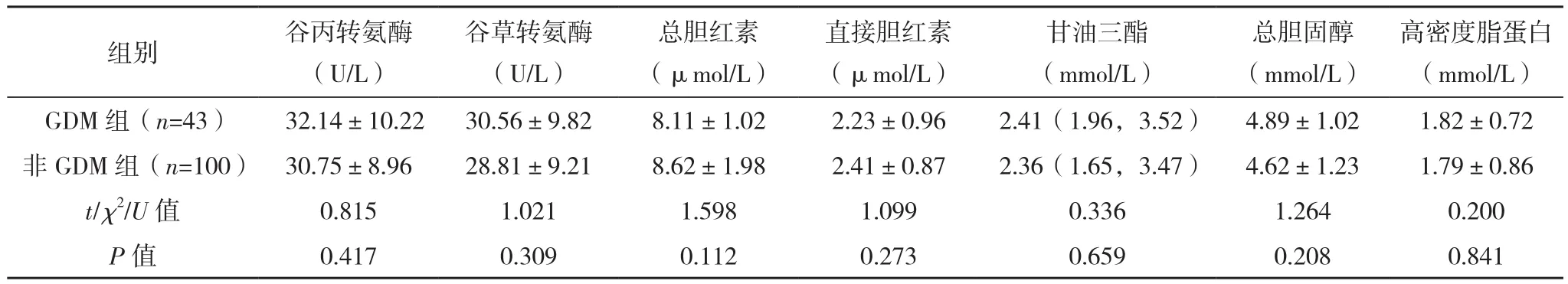
表2(续)
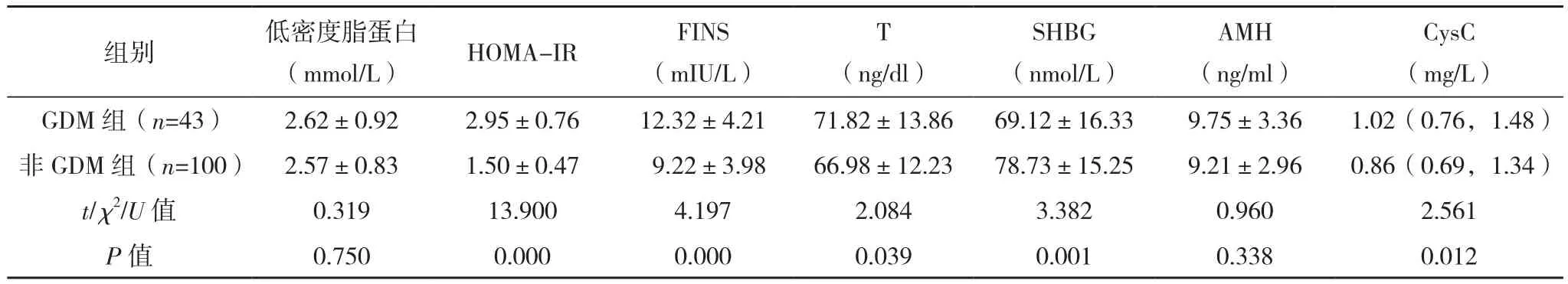
表2(续)
2.3 PCOS合并GDM的多因素分析
因FINS与HOMA-IR呈明显正相关,为了确保模型的稳定性,未将FINS纳入后续回归分析。有GDM家族史赋值为“1”,无GDM家族史赋值为“0”。研究结果显示:T、HOMA-IR、GDM家族史、CysC均为PCOS合并GDM的独立危险因素,SHBG为PCOS合并GDM的保护因素(P<0.05),见表3。
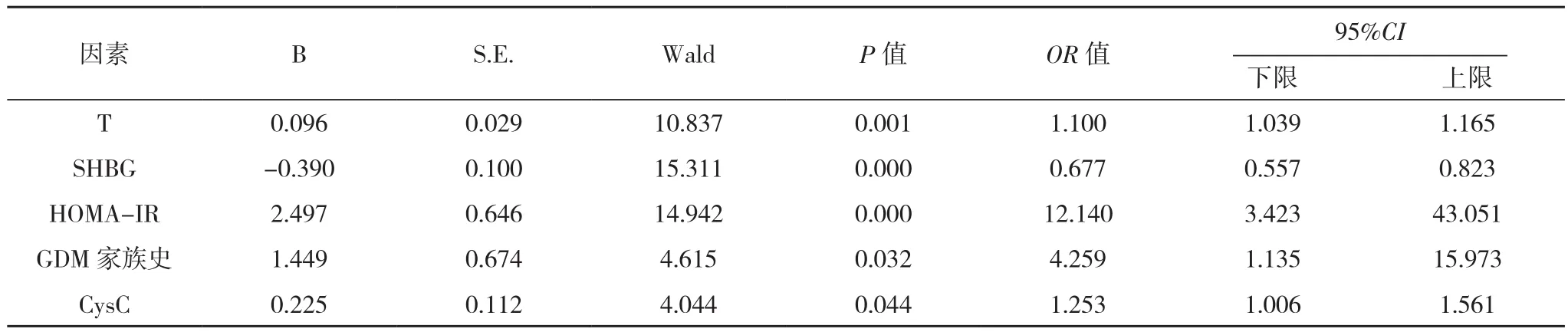
表3 PCOS合并GDM的多因素分析
2.4 不同因素对PCOS合并GDM的预测价值
T、HOMA-IR、CysC、SHBG、综合指标对PCOS合并GDM均有一定预测价值,GDM家族史预测价值较低(P>0.05),见表4、图1。
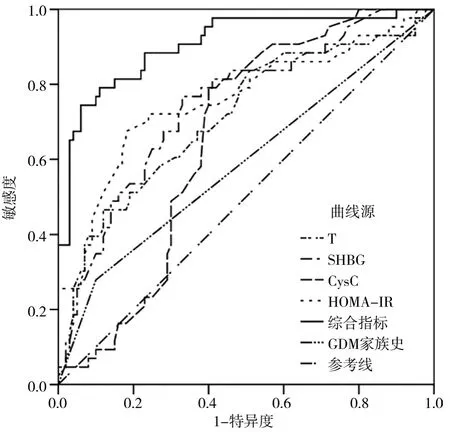
图1 不同因素对PCOS合并GDM的预测价值的ROC曲线
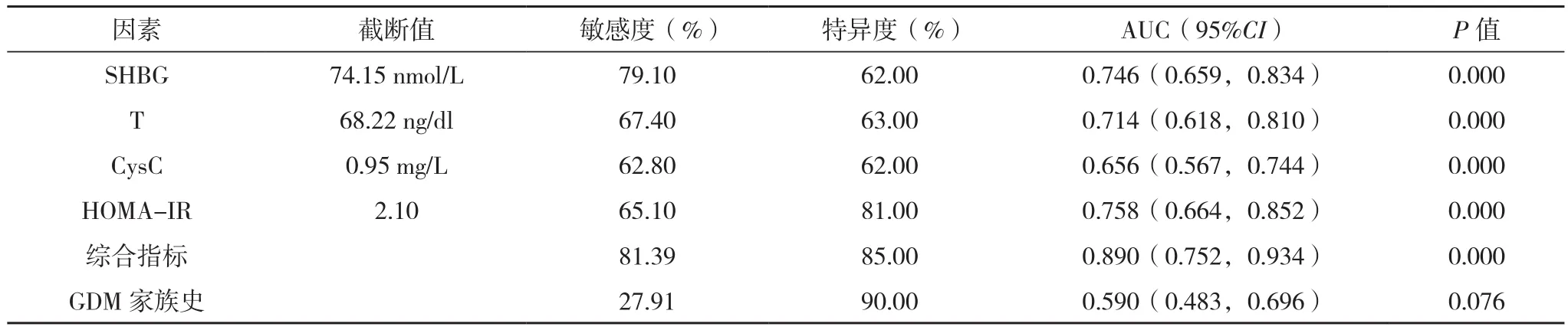
表4 不同因素对PCOS合并GDM的预测价值
2.5 不同因素预测价值比较
综合指标AUC明显高于单个因素(P<0.05),见表5。
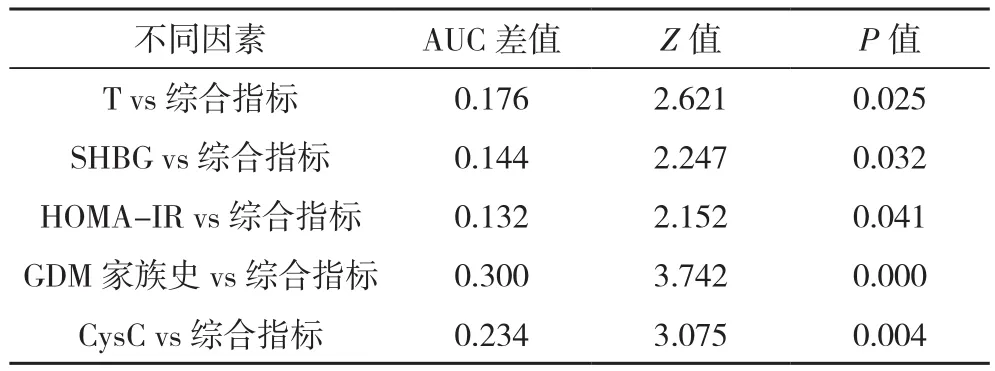
表5 不同指标预测价值比较
3 讨论
育龄女性中PCOS发病率为6%~15%,是女性中较为常见内分泌代谢性的疾病,患者常出现月经异常、多毛、痤疮、不孕等[8]。PCOS妇女经系统性治疗后,大部分可以成功妊娠,而妊娠妇女中,约32.17%合并GDM[9]。PCOS合并GDM的机制较为复杂,可能与遗传、内分泌紊乱、免疫调节、胰岛素抵抗、微量元素、环境和情绪等因素有关,目前尚无可靠的预测指标。有限的影响因素研究中,因GDM诊断时间或者影响因素的收集时间不同,导致结论差异较大。本研究在参考以往研究的基础上,结合本院孕妇检测结果筛选相关影响因素。
非妊娠期,尽管存在胰岛素抵抗,但PCOS仍然可以维持正常的葡萄糖代谢。妊娠期,由于性激素代谢水平更加紊乱,加重了胰岛素抵抗,影响葡萄糖的正常代谢,易发生GDM[10]。本研究发现,143例PCOS患者中43例合并GDM,发生率为30.07%,与文献[9]报道基本相符。GDM组GDM家族史占比、HOMA-IR、FINS、T、CysC水平均高于非GDM组,SHBG水平低于非GDM组(P<0.05)。T、HOMA-IR、GDM家族史、CysC均为PCOS合并GDM的独立危险因素,SHBG为PCOS合并GDM的保护因素(P<0.05)。SHBG是一种由肝脏产生的糖蛋白,它专门结合和运输性激素,并调节血液中性激素的浓度。SHBG同时受多种激素调节,性激素、甲状腺激素可促进SHBG的分泌,而胰岛素水平的升高可以抑制肝脏中SHBG的产生,并减少肝脏中SHBG的合成[11]。循环系统中SHBG的降低使性激素水平紊乱,引起糖脂代谢紊乱,进一步加重胰岛素抵抗,导致GDM的发生[12]。Li等[13]研究同样证实了HOMA-IR、SHBG均是PCOS合并GDM的独立影响因素。以往研究表明,PCOS患者的肾小管损伤标志物有上升的趋势,在一项长期随访研究中,发现母亲肾功能不全是GDM的独立危险因素[14]。CysC是低分子量蛋白,是肾小管损伤的重要标志物,本研究亦证实CysC是GDM的独立影响因素[15]。T是由卵巢分泌的十分重要的雄激素,PCOS患者存在高雄激素,影响卵巢的正常发育,从而导致不孕[16-18]。李文静等[19]研究发现,合并GDM的PCOS孕妇T浓度明显高于单纯PCOS孕妇,T对PCOS孕妇合并GDM有一定的预测价值,且为其独立影响因素。本研究亦证实,高浓度T的PCOS孕妇,更有可能合并GDM。陈军等[20]研究发现,GDM家族史是孕晚期PCOS合并GDM的独立影响因素,与本研究结果相符,但是在后续的ROC曲线分析中,发现GDM家族史具有较低的AUC(预测价值)。以上影响因素(GDM家族史除外)在经过ROC曲线分析后,均证实对PCOS合并GDM有较好的预测价值,但是综合指标AUC明显高于单个因素(P<0.05)。
以往研究表明,GDM组的早产、羊水过多的发生率明显高于非GDM组[21-22]。此外,研究证实GDM产妇巨大胎儿发生率明显高于非GDM产妇,因此导致产妇早产和产后出血的概率高于非GDM产妇[23],与本研究结果相符。本研究因纳入样本数较少,导致两组不良妊娠结局比较中只有产后出血发生率比较差异有统计学意义,GDM组产后出血率高于非GDM组(P<0.05)。两组早产、胎膜早破、羊水过多、羊水过少发生率比较差异均无统计学意义(P>0.05)。在后续的研究中,多中心、前瞻性、大样本的研究可能会对影响因素的分析更为全面。
综上所述,本研究证实T、HOMA-IR、GDM家族史、CysC均为PCOS合并GDM的独立危险因素,SHBG为其保护因素。T、HOMA-IR、CysC、SHBG、综合指标都对PCOS患者合并GDM均有一定预测价值,且综合指标预测价值明显高于单一因素。在临床工作中,应积极监测T、HOMA-IR、CysC、SHBG水平,可能帮助GDM的早发现,减少不良妊娠结局。

